The article presents results of research of the influence of acetylsalicylic acid in concentrations 5∙10–4, 5∙10–3, 5∙10–2 and 5∙10–1 М on the electrical activity of mollusk identified neurons RPa1 and RPa2 Helix albescens Rossm. It was shown that in these concentrations this substance had an inhibitory effect on frequency electrical potentials of these neurons. These data were allowed us to recommend acetylsalicylic acid for testing as a vehicle, having a brake effect on the nervous system.
Key words: acetylsalicylic acid, electrical activity, neurons RPa1 and RPa2 of mollusk.
Салицилаты обладают рядом нейротропных эффектов, что было показано на ряде живых организмов [9, с. 142–150; 10, с. 10–18; 27, p. 813–816]. Например, самое известное и широко распространённое на нашей планете лекарство ацетилсалициловая кислота (АК) уменьшает разряды ноцицептивных нейронов дорсального рога в ответ на предъявление термических стимулов на периферическое рецепторное поле и уменьшает кортикальные вызванные потенциалы при стимуляции зубов [5, с. 263]. Кроме того, показано угнетающее действие АК на параметры электрических потенциалов неидентифицированных нейронов моллюска Helix albescens Rossm. [2, с. 326–336]. На основе АК в Таврической академии Крымского федерального университета им. В. И. Вернадского были получена новая комплексная соль — ацетилсалицилат кобальта, обладающая активирующим эффектом в различных дозах на электрическую активность идентифицированных нейронов ППа1 и ППа2 моллюска [19, с. 69–73]. Эти факты позволяют считать целесообразным проведение поиска нейротропной активности у ацетилсалициловой кислоты на хорошо известных клеточных моделях нервной клетки, которыми и являются командные нейроны ППа1 и ППа2 моллюска Helix albescens Rossm.
Цель работы. Изучить влияние ацетилсалициловой кислоты на электрическую активность идентифицированных нейронов ППа1 и ППа2 моллюска Helix albescens Rossm.
Материал и методы. Эксперименты выполнены на 70 нейронах ППа1 и ППа2 улитки Helix albescens Rossm. Из тела моллюска извлекали окологлоточное нервное кольцо и фиксировали его неподвижно вольфрамовыми иглами в специальной экспериментальной камере (1 мл). Наружные соединительнотканные оболочки ганглиев удаляли с помощью специально подготовленного крючка. К комплексу подглоточных ганглиев моллюска постоянно подавали проток раствора Рингера для холоднокровных животных следующего состава (в миллимолях на 1 литр): NaCl — 100, KCl — 4, CaCl2–10, MgCl2–4, трис-HCl — 10 (pH 7,5) [11, с. 46–54].
Регистрацию биоэлектрических потенциалов нейронов и измерение их параметров проводили при температуре 18–21 ºС с помощью метода внутриклеточного отведения [11, с. 46–54]. Использовали заполненные 2.5 М раствором KCl стеклянные микроэлектроды с сопротивлением 10–30 МОм. Биопотенциалы усиливали с помощью УФУ-БКН (полоса пропускания 0–10 кГц) и через аналого-цифровой преобразователь передавали на компьютер IBM PC. Идентификацию нейронов осуществляли по электрофизиологическим и морфофизиологическим признакам под бинокулярным микроскопом МСПЭ-1 («Ломо») согласно карте А. Д. Сахарова [18, с. 21–139]. Запись потенциалов исследуемых нейронов и расчёт их характеристик выполняли с помощью компьютерной программы «Action Potential» [1] по схеме: фон (1 мин.), 5 мин. экспозиции раствора ацетилсалициловой кислоты заданной концентрации, отмывание раствором Рингера (20–30 мин.).
Перед аппликацией АК перекрывали проток раствора Рингера для холоднокровных животных. Затем с помощью метода фиксации концентрации во внеклеточную среду однократно апплицировали ацетилсалициловую кислоту («Merk», Германия), растворённый до необходимой концентрации раствором Рингера для холоднокровных животных. В экспериментах использовали четыре концентрации данного соединения — 5∙10–4, 5∙10–3, 5∙10–2 и 5∙10–1 М. Анализировали частоту генерации импульсов (ЧГИ) нейронами, длительность их потенциала действия (ПД), суммарные входящие и выходящие трансмембранные ионные токи (оценивали по кривым первых производных ПД), мембранный потенциал (МП). Для оценки достоверности результатов использовали непараметрический критерий Вилкоксона [13, с. 133–134]. Статистически значимыми считались различия значений показателей фона и эксперимента при p<0,05.
Результаты и их обсуждение.Концентрация 5∙10–4 М оказалась пороговой, поскольку в ней АК вызывала изменения на уровне тенденции ЧГИ и времени нарастания ПД, уровня МП нейронов ППа1 и ППа2. Оптимальная выраженность нейротропных эффектов АК проявлялась в концентрациях 5∙10–3 и 5∙10–2 М. В концентрации 5∙10–1 М АК оказывала токсическое действие. Итак, рассмотрим эти эффекты более подробно.
При воздействии 5∙10–4 М АК на нейроны улитки ППа1 (n=6) и ППа2 (n=6) уже через 5–10 с экспозиции на уровне тенденции снижалась их ЧГИ, амплитуда, время нарастания ПД и уровень МП. Эти изменения сохранялись и в течение всего последующего периода экспозиции этой концентрации вплоть до начала отмывания нейронов от АК раствором Рингера. При отмывании показатели электрической активности нейронов уже на 1–3 мин восстанавливались до исходного уровня. Полученные результаты свидетельствуют о том, что концентрация 5∙10–4 М является порогом эффектов АК на функциональное состояние нейронов.
Действие АК в концентрации 5∙10–3 М на электрические потенциалы нейронов ППа1 (n=11) и ППа2 (n=9) было угнетающим. Латентный период (ЛП), после которого происходило угнетение ЧГИ и снижение амплитуды ПД нейронов ППа1 и ППа2 под влиянием АК, составлял 20 (рис. 1, А) и 50 с соответственно (рис. 1, Б). Дальнейшая реакция клеток ППа1 на экспозицию АК практически не изменялась до начала отмывания этой кислоты раствором Рингера (рис. 1, А), тогда как у нейрона ППа2 наблюдались периоды с учащением и урежением ЧГИ (рис. 1, Б). Следует отметить, что все вызванные данной концентраций АК изменения показателей электрической активности исследованных нейронов были обратимыми, поскольку уже после 5–8 мин отмывания они восстанавливались до фонового уровня.
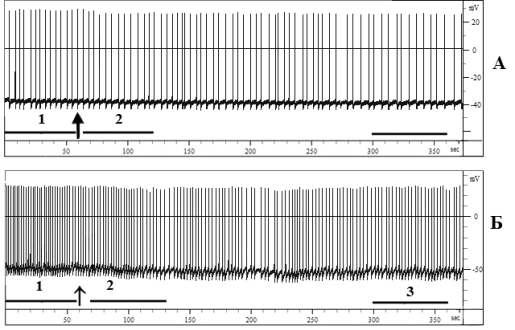
Рис. 1. Влияние ацетилсалициловой кислоты в концентрации 5∙10–3 М на электрические потенциалы нейронов ППа1 (А) и ППа2 (Б)
Примечание: горизонтальной чертой отмечены периоды усреднения потенциалов действия нейронов и их первых производных. Цифрой 1 обозначено усреднение потенциалов и их производных в фоне, 2 — на 1-ой мин. экспозиции вещества, 3 — на 5-ой мин. Стрелкой отмечен момент аппликации тестируемого вещества.
Результаты статистического сравнения основных параметров электрических потенциалов нейронов в фоне и на 5 мин экспозиции 5∙10–3 М раствора АК показали (табл. 1), что тестируемое вещество угнетало функциональное состояние всех исследованных типов нервных клеток. Об этом свидетельствует уменьшение (р≤0,05) у нейронов ЧГИ в 1,2–1,4 раз. В соответствии с классическими представлениями [6, с.3–33; 21, p. 21–30; 22, p. 265–287; 23, p. 131–169], наблюдаемые изменения ЧГИ, длительности и амплитуды ПД (табл. 1) исследованных нейронов можно объяснить увеличением проницаемости их мембраны для К+ и уменьшением для Na+. Уменьшение амплитуды и увеличение длительности ПД может являться свидетельством замедления инактивации медленных К+ каналов. Кроме того, в мембране нейронов моллюсков могут встречаться и другие типы К+ каналов: кальций-зависимые, аномального выпрямления [22, p. 265–287; 23, p. 131–169]. Среди натриевых ионных каналов входящего тока в плазмалемме нейронов моллюсков по данным работ [6, с. 3–33;23, p. 73–78] также выделяют медленно- и быстро активирующиеся типы, а в отношении нейронов ППа1 не следует забывать, что важную роль в генерации их ПД играют ионы Ca2+ [12, с. 34–41]. Это подтверждает анализ кривых первой производной ПД, который показал (табл. 2), что на 5 мин экспозиции АК в концентрации 5∙10–3 М по сравнению с фоном на уровне тенденции возрастали максимумы скорости нарастания суммарных выходящих трансмембранных токов нейронов ППа1 и ППа2. В то же время прослеживалась тенденция к снижению максимумов скоростей нарастания входящих трансмембранных ионных токов нейронов ППа1.
Таблица 1
Значения некоторых параметров электрических потенциалов нейронов моллюска Helix albescens Rossm. в фоне и на 5 минуте экспозиции ацетилсалициловой кислоты (АК)
|
Тип нейронов, их количество |
Тестируемый раствор и его концентрация, моль/л |
ЧГИ, Гц |
Амплитуда ПД, мВ |
Длительность ПД, мс |
МП, мВ |
|
ППа 1 (n = 11) |
фон |
1,6±0,11 |
70,4±5,18 |
15,0±1,45 |
- 33,5±4,87 |
|
АК 5∙10–3 |
1,2±0,13 * |
67,2±4,95 |
18,3 ±1,72 |
-36,2±5,53 |
|
|
ППа 2 (n = 9) |
фон |
1,33±0,14 |
86,5±6,51 |
16,9±2,06 |
- 47,9±6,70 |
|
АК 5∙10–3 |
0,9±0,14* |
88,1±6,30 |
14,1±2,32 |
-53,7±6,95 |
|
|
ППа 1 (n = 10) |
фон |
0,8±0,12 |
68,7±7,34 |
17±2,52 |
-40,4±5,21 |
|
АК 5∙10–2 |
0,5±0,11* |
70,2±7,08 |
23±2,78* |
-52,6±4,83* |
|
|
ППа 2 (n = 9) |
фон |
1,9±0,24 |
71,0±7,74 |
12±3,33 |
-36,2±3,55 |
|
АК 5∙10–2 |
1,0±0,19** |
64,2±7,42 |
26±3,41** |
-35,1±3,11 |
|
|
ППа 1 (n = 10) |
фон |
1,4±0,22 |
65,0±5,42 |
18,3±3,74 |
-40,2±6,71 |
|
АК 5∙10–1 |
Отсутствие ПД ** |
-54,1±5,90* |
|||
|
ППа 2 (n = 9) |
фон |
1,9±0,31 |
66,4±6,09 |
12,0±4,23 |
-42,5±4,52 |
|
АК 5∙10–1 |
Отсутствие ПД ** |
-56,0±5,13* |
|||
Примечание: ЧГИ — частота генерации импульсов, ПД — потенциал действия, МП — мембранный потенциал. Достоверные изменения по сравнению с фоном: * — р≤0,05; ** — р≤0,01.
Таблица 2
Максимумы трансмембранных ионных токов нейронов моллюска Helix albescens Rossm. в фоне и на 5 минуте экспозиции ацетилсалициловой кислоты (АК)
|
Тип нейронов |
Тестируемый раствор и его концентрация, моль/л |
Скорость нарастания ионных токов, В/с |
|
|
входящих |
выходящих |
||
|
ППа 1 (n = 11) |
фон |
11,6±1,2 |
4,4±0,9 |
|
АК 5∙10–3 |
9,7±0,9 |
6,8±1,2 |
|
|
ППа 2 (n = 9) |
фон |
24,8±3,3 |
11,5±1,7 |
|
АК 5∙10–3 |
25,6±2,5 |
12,5±1,1 |
|
|
ППа 1 (n = 10) |
фон |
10,8±1,3 |
6,1±0,7 |
|
АК 5∙10–2 |
7,6±1,0* |
8,5±,0,9* |
|
|
ППа 2 (n = 9) |
фон |
30,5±2,3 |
20,3±1,6 |
|
АК 5∙10–2 |
25,8±2,6 |
18,2±1,5 |
|
|
ППа 1 (n = 10) |
фон |
14,2±1,9 |
8,4±1,5 |
|
АК 5∙10–1 |
не наблюдается |
не наблюдается |
|
|
ППа 2 (n = 9) |
фон |
20,7±2,2 |
15,5±1,9 |
|
АК 5∙10–1 |
не наблюдается |
не наблюдается |
|
Примечание: обозначения те же, что и в табл 1.
Статистический анализ основных параметров электрических потенциалов показал, что у нейронов ППа1 на 5 мин экспозиции АК в концентрации 5∙10–2 М по сравнению с фоном достоверно уменьшалась ЧГИ и увеличивалась продолжительность ПД (табл. 1 и рис. 2), а также на уровне тенденции снижалась амплитуда ПД. Анализ первой производной ПД показал (табл. 2), что АК в этой концентрации вызывает достоверное (р≤0,05) уменьшение скорости нарастания суммарных входящих трансмембранных ионных токов и увеличение (р≤0,05) выходящих — у нейронов ППа1. У нейронов ППа2 скорости нарастания как входящих, так и выходящих трансмембранных ионных токов уменьшались на уровне тенденции. Снижение скорости нарастания суммарных входящих трансмембранных ионных токов свидетельствует об уменьшении проницаемости мембран исследованных нейронов для Na+, и, возможно, Ca2+.
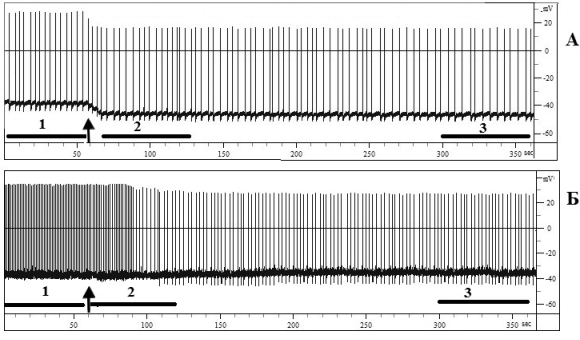
Рис. 2. Влияние 5∙10–2 М раствора ацетилсалициловой кислоты на электрические потенциалы нейронов ППа1 (А) и ППа2 (Б)
Примечание: горизонтальной чертой отмечены периоды усреднения потенциалов действия нейронов и их первых производных. Цифрой 1 обозначено усреднение потенциалов и их производных в фоне, 2 — на 1-й мин. экспозиции вещества, 3 — на 5-й мин. Стрелкой отмечен момент аппликации вещества.
В отношении ионов Ca2+ известно [11, с. 46–54; 15, с. 1139–1155; 24, p. 841–856], что они вносят определённый вклад в амплитуду ПД и генерацию пейсмекерной активности нейронов моллюсков, в особенности серотонинэргических, к которым относятся клетки ППа1. Интересно то, что в работе [3, с. 187–198] была отмечена двойственность эффектов АК на уровень серотонина: с одной стороны эта кислота снижает активность ферментов, участвующих в биосинтезе этого медиатора, а с другой — увеличивает его высвобождение в синаптическую щель. Возможно, именно с выбросом серотонина и связано резкое увеличение ЧГИ в течение 20–50 с после аппликации и появление А-потенциалов, а последующее их исчезновение и снижение ЧГИ, по-видимому, обусловлены истощением запасов этого медиатора и нарушением его синтеза. Учитывая то, что серотонинчувствительные рецепторы принимают участие в психотропных эффектах АК [8, с. 21–22], можно полагать определённую их роль и в нейротропных эффектах этого вещества. По другим сведениям [6, с. 3–33; 25, p. 323–332], одной из причин угнетения ЧГИ может быть Ca2+-зависимая калиевая проводимость мембраны.
Согласно имеющимся сведениям, наблюдаемое увеличение скоростей нарастания суммарных выходящих трансмембранных ионных токов у нейронов ППа1 при экспозиции 5∙10–2 М раствора АК может быть связано с активацией калиевых каналов не только кальций зависимого тока, но и токов аномального выпрямления, утечки калия [26, p. 366–369], АТФ-зависимого калиевого тока (тестируемая кислота угнетает синтез АТФ) [6, с. 3–33; 20, с. 210–258]. Поскольку каналы аномального выпрямления (Кir-каналы) преобладают в ЦНС беспозвоночных животных среди других типов калиевых каналов и являются мишенями модулирующего действия вторичных посредников [6, с. 3–33; 23, p. 153], их роль в эффектах АК представляется значительной. А наблюдаемая в случае нейронов ППа1 гиперполяризация может быть причиной инактивации быстрых калиевых каналов (КА-каналов), вследствие чего кратковременный выходящий ток K+ замедляет возвращение МП в сторону порога ПД и увеличивает интервалы между импульсами ПД [6, с. 3–33]. Обнаруженное под влиянием АК снижение скорости входящих трансмембранных ионных токов может лежать и в основе механизма противоболевых эффектов АК. Так, известно, что при механических повреждениях, воспалительных процессах или действии гипералгезических агентов повышается чувствительность медленных натриевых каналов наружных мембран ноцицептивных нейронов [7, с. 1–18], что обычно приводит к возрастанию их ЧГИ. Мы предполагаем, что АК может снижать ЧГИ и ноцицептивных нейронов благодаря уменьшению входа Na+ в цитоплазму, что и обуславливает в значительной мере противоболевые эффекты этой кислоты.
Реакция всех исследованных нейронов на экспозицию 5∙10–1 М раствора АК была следующей. Через 5–10 с после момента аппликации вещества происходил сдвиг МП в сторону гиперполяризации мембраны. Это сначала сопровождалось возрастанием ЧГИ и постепенным уменьшением амплитуды ПД нейронов, затем ЧГИ уменьшалась (рис 3, Б) до тех пор, пока не происходило прекращение генерации импульсов (рис. 3, А и Б), что свидетельствует о токсичности данной концентрации АК. Анализ экспериментальных данных показал отсутствие избирательности в выраженности и скорости развития эффектов данной концентрации АК от типа исследованных нейронов: как видно из табл. 3.1 на 5 мин экспозиции тестируемой кислоты у всех нейронов происходила гиперполяризация МП и подавление импульсной активности. Это сопровождалось значительным снижением скорости нарастания суммарных входящих и выходящих ионных токов и полным их исчезновением. Гиперполяризацию мембраны нейронов, возникающую при воздействии 5∙10–1 М раствора АК, в соответствии с имеющимися данными [9, с. 142–150] можно объяснить нарушением функционирования каналов выходящего калиевого и (или) входящего хлорного тока. Возможно, что АК усиливает входящий хлорный ток, что, как известно [4, с. 2121–2130, 6, с. 3–33], снижает возбудимость мембраны нейрона и способствует её реполяризации во время ПД. Авторы работы [6, с. 3–33; 169] предполагают, что деполяризация, связанная с активацией хлорной проводимости, может инактивировать некоторые Са2+- и Na+-каналы. По такому механизму происходит мембранотропное действие многих анестетиков, а согласно данным [14, с. 4–8] анестезирующие свойства характерны и для АК. Что касается выходящего калиевого тока, то наше предположение о его участии в наблюдаемом увеличении отрицательных значений МП при воздействии АК также нашло подтверждение, поскольку во время таких изменений у некоторых нейронов было отмечено увеличение скорости нарастания суммарных выходящих трансмембранных ионных токов (табл. 1).
Наблюдаемые эффекты могут быть связаны не только с непосредственным воздействием АК на ионотропные рецепторы мембран, но и с опосредованным влиянием через метаботропные рецепторы, в том числе и благодаря ингибирующим влияниям этой кислоты на синтез АТФ, простагландинов, циклических нуклеотидов; изменениям внутриклеточного уровня Са2+. Так, известно [5, с. 260–268; 14, с. 4–8], что АК снижает уровень простагландинов, ингибируя фермент ЦОГ, ответственный за их синтез. Есть сведения, что простагландин Е2 усиливает электрическую активность нейронов и его эффекты опосредованы цАМФ [17, с. 580–588]. Исходя из этого, угнетение АК электрических потенциалов нейронов может быть связано со снижением содержания этого простагландина и выключением аденилатциклазного пути передачи сигналов, модулирующих функционирование мембранных ионных каналов, которые отвечают за возбудимость и генерацию ПД.
Следует отметить, что при отмывании 5∙10–1 М раствора АК у всех исследованных нейронов вначале восстанавливался исходный уровень МП, а затем и генерация ПД. Однако их амплитудно-временные параметры приближались к фоновым только после 18–30 мин. Эти данные свидетельствуют о низкой токсичности АК даже в такой высокой концентрации.
Сходные результаты были получены в нашей лаборатории и в отношении влияния на электрическую активность нейронов улитки cалициловой кислоты — предшественника АК, близкого к ней по химической структуре [9, с. 142–150; 16, с. 107–123].
Выводы
- Концентрация 5∙10–4 М является пороговой для действия АК, а в концентрациях 5∙10–3, 5∙10–2 и 5∙10–1 М эта кислота угнетает параметры электрических потенциалов нейронов моллюска Helix albescens Rossm. (ЧГИ, амплитуду ПД, время развития ПД). Этот эффект усиливается с увеличением концентрации АК. В концентрации 5∙10–1 М АК оказывет токсическое действие, приводя к гиперполяризации мембраны нейронов и полному прекращению генерации импульсов.
- Анализ ионных механизмов угнетающих нейротропных эффектов АК показал, что это вещество может оказывать воздействие на рецепторы различных ионных каналов мембран нервных клеток — натриевых, калиевых, хлорных, а в некоторых случаях и кальциевых, на что указывают соответствующие изменения трансмембранных ионных токов. Полученные данные позволяют рекомендовать ацетилсалициловую кислоту к испытанию в качестве средства, обладающего тормозным эффектом на нервную систему.
Работа выполнена при поддержке государственного задания № 2015/701 на выполнение государственных работ в сфере научной деятельности в рамках проекта «Обоснование применения оздоровительно-превентивных технологий на основе действия низкоинтенсивных факторов различной природы» базовой части государственного задания Минобрнауки России.
Литература:
- А.с. № 1164229 Украина. Компьютерная программа для регистрации, обработки и автоматизированного анализа биоелектрических сигналов / А. А. Замотайлов, И. И. Коренюк (Украина) № 1164229; опубл. 29.11.2004 г.
- АТФ-зависимые и кальциевые механизмы влияния салицилатов на электрические потенциалы нейронов моллюска Helix albescens /И. В. Черетаев, И. И. Коренюк, Д. Р. Хусаинов и др. // Российский физиологический журнал им. И. М. Сеченова. — 2015. — Т. 101, № 3. — С. 326–336.
- Венгеровский, А. И. Лекции по фармакологии / А. И. Венгеровский. — М.: Физ.-мат. лит., 2007. — 704 с.
- Вислобоков, А. И. Современные представления о воздействии фармакологических средств на ионные каналы / А. И. Вислобоков, Ю. Д. Игнатов // Психофармакол. биол. наркол. — 2007. — Т. 7, № 3–4. — С. 2121–2130.
- Дейл, М. М. Руководство по иммунофармакологии / М. М. Дейл, Дж. К. Формен. —М.: Медицина, 1998. — 332 с.
- Зефиров, А. Л. Ионные каналы нервного окончания / А. Л. Зефиров, Г. Ф. Ситдикова // Успехи физиол. наук. — 2002. — Т. 33, № 4 — С. 3–33.
- Карымова, Е. А. Ионные механизмы кодирования ноцицептивных сигналов: роль медленных натриевых каналов: автореф. дис. на соискание уч. степени канд. биол. наук: спец. 03.00.02 «Биофизика» / Е. А. Карымова. — СПб., 2009. — 18 с.
- Катюшина, О. В. Участие серотонинэргической системы мозга крыс в реализации психотропных эффектов ацетилсалициловой кислоты и её солей / О. В. Катюшина, Т. В. Яковчук // Дни науки ТНУ им. В. И. Вернадского. — Симферополь: ДИАЙПИ, 2011. — С. 21–22.
- Коренюк, И. И. Влияние салициловой кислоты и её солей на электрическую активность нейронов виноградной улитки / И. И. Коренюк, Д. Р. Хусаинов, В. Ф. Шульгин // Нейрофизиология / Neurophysiology. — 2005. — Т. 37, № 2. — С. 142–150.
- Коренюк, И. И. Салицилаты кобальта и цинка как функциональные аналоги инициирующего фактора в нервной системе моллюска / И. И. Коренюк, Д. Р. Хусаинов, В. Ф. Шульгин // Нейрофизиология / Neurophysiology. — 2006. — Т. 38, № 1. — С. 11–18.
- Кононенко, Н. И. Механизмы генерации ритмоводящей активности в идентифицированных нейронах виноградной улитки / Н. И. Кононенко, О. В. Костюченко // Нейрофизиология / Neurophysiology — 2001. — Т. 33, № 1. — С. 46–54.
- Костюченко, О. В. Эндогенная пейсмекерная активность изолированных нейронов моллюска / О. В. Костюченко, И. И. Коренюк // Учёные записки Таврического национального университета им. В. И. Вернадского, серия «Биология, химия». — 2000. — Т. 2, № 13. — С. 34–41.
- Лакин, Г. Ф. Биометрия / Лакин Г. Ф. — М.: Высшая школа, 1990. — 352 с.
- Машковский, М. Д. Ацетилсалициловая кислота в ряду современных лекарственных средств / М. Д. Машковский // Хим.-фарм. журн. — 1994. — Т. 28, № 2. — С. 4–8.
- Мельников, К. Н. Разнообразие и свойства кальциевых каналов возбудимых мембран / К. Н. Мельников // Психофармакол. биол. наркол. — 2006. — Т. 6, № 1–2. — С. 1139–1155.
- Нейротропные эффекты химических соединений различных классов и возможные механизмы их действия / [И. И. Коренюк, Т. В. Гамма, Д. Р. Хусаинов и др.] — Симферополь: ДИАЙПИ, 2012. — 182 с.
- Никитин, В. П. Простагландины и функциональная специфичность нейронов виноградной улитки / В. П. Никитин, В. В. Шерстнёв // Нейрофизиология / Neurophysiology. — 1981. — Т. 13, № 6. — С. 580–588.
- Сахаров, Д. А. Генеалогия нейронов / Сахаров Д. А. — М.: Наука, 1974. — 184 с.
- Черетаев, И. В. Влияние ацетилсалицилата кобальта на электрическую активность нейронов ППа1 и ППа2 моллюска Helix albescens Rossm. / И. В. Черетаев., Д. Р. Хусаинов, И. И. Коренюк // Молодой ученый. — 2015. — № 4 (84). — С. 69–73.
- Шуба, Я. М. Основи молекулярної фізіології іонних каналів / Я. М. Шуба. — К.: Наук. думка, 2010. — 448 с.
- Connor, J. A. Voltage clamp studies of transient outward membrane current in gastropod neural somata / J. A. Connor, C. F. Stevens // J. Physiol. — 1971. — Vol. 213, № 1. — P. 21–30.
- Crest, M. Large conductance Ca2+-activated K+-channels are involved in both spike shaping and firing regulation in Helix neurones / M. Crest, M. Gola // J. Physiol. — 1993. — Vol. 465, № 1. — P. 265–287.
- Hille, B. Ionic channels of excitable membranes / Hille B. — University of Washington, 2001. — 722 pp.
- Jeziorski, M. C. The molecular biology of invertabrate voltage-gated Ca2+-channels / M. C. Jeziorski, R. M. Greenberg, P. A. Anderson // J. Exp. Biol. — 2000. — Vol. 203, № 5. — P. 841–856.
- Kononenko, N. I. Dissection of a model for membrane potential oscillations in bursting neuron of snail Helix pomatia / N. I. Kononenko // Comp. Biochem. Physiol. — 1994. — Vol. 107 A, № 2. — P. 323–332.
- Lopatin, A. N. Potassium channels block by cytoplasmic polyamines as mechanism of intrinsic rectification / A. N. Lopatin, E. N. Makhina, C. G. Nichols // Nature. — 1994. — Vol. 372, № 6504. — P. 366–369.
- Xu, H. Sodium salicylate reduces gamma aminobutyric acid-induced current in rat spinal dorsal horn neurons / H. Xu, N. Gong, L. Chen et al. // Neuroreport. — 2005. — Vol. 16, № 8. — P. 813–816.







