Поиск иммуномодуляторов остается актуальной проблемой прикладной иммунологии в связи со все более увеличивающейся частотой патологии иммунной системы у населения планеты. Одной из наиболее распространённых моделей для исследования характера влияния препаратов различного происхождения на иммунную систему млекопитающих является изучение динамики первичного (ПИО) и вторичного иммунного (ВИО) ответа мышей различных линий на тимусзависимые антигены. Наиболее принятой и изученной моделью для проведения этих исследований является модель на мышах BALB/c, иммунизированных эритроцитами барана (ЭБ) [3,9,10].О характере и степени выраженности иммунного ответа на ЭБ судят по большому числу тестов — титрам гемагглютининов [8], числу антителообразующих (АОК) [2] и розеткообразующих (РОК) [5] клеток в селезенке, пролиферативной активности лимфоцитов в реакции бласттрансформации (РБТЛ) [1,20], гиперчувствительности замедленного типа (ГЗТ) [4], реже — в смешанной культуре лимфоцитов (СКЛ) и числу колониеобразующих единиц в костном мозге сублетально облученных животных [13,20]. Сравнительно недавно стали использовать определение численности лимфоцитов CD34+ фенотипа, апоптоза лимфоцитов и определение длины теломер их ДНК [6,7]. Большинство перечисленных методов довольно трудоемки, требуют наличия специальной аппаратуры и дорогостоящих реактивов. В этой связи, на наш взгляд, остается актуальным поиск экспрессных и информативных методов оценки силы иммунного ответа экспериментальных животных на конкретный антиген в динамике его развития.
Цель исследования — определить информативность и возможность использования величины гранулоцитарного индекса (ГИ) и индекса миграции лейкоцитов (ИМЛ) в присутствии лизата эритроцитов барана в качестве критериев оценки силы иммунного ответа мышей на тимусзависимый антиген — эритроциты барана (ЭБ).
Материалы и методы. Работа была выполнена на мышах линии BALB/c. В экспериментах было использовано 30 животных — самцов массой не более 20,0 грамм, полученных из питомника Технологического центра АН Туркменистана.
Эритроциты, добытые из яремной вены барана (ЭБ), перед иммунизацией мышей, трехкратно отмывали 0,9 % раствором хлорида натрия путем центрифугирования в течение 10 минут при 1500 об/мин. Из отмытых ЭБ го-товили 20 % суспензию на 0,9 % растворе хлорида натрия, по 0,1 мл которой вводили внутрибрюшинно мышам BALB/c. Животных обследовали до- и на 3, 7, 14 и 21 сутки после иммунизации.
Обследование включало определение клеточного состава периферической крови, соотношение ее поли- и мононуклеаров с последующим вычислением гранулоцитарного индекса (ГИ) [17,19], подсчет числа розеткообразующих клеток (РОК) в селезенке, тимусе и костном мозге методом иммунного розеткообразования [5], определение титров гемагглютининов в реакции прямой гемагглютинации [8], вычисление индекса миграции лейкоцитов (ИМЛ) из стеклянного капилляра в модифицированной реакции торможения миграции лейкоцитов [17] с использованием в качестве инициатора миграции лизата ЭБ. Лизат получали путем трехкратного замораживания-оттаивания 2 % суспензии эритроцитов. Лизат ЭБ хранили в одноразовых пробирках по 1,0 мл при t -19ºС.
При постановке реакции иммунного розеткообразования использовали суспензии лимфоцитов селезенки, костного мозга и тимуса мышей. Для этого селезенку, тимус, костный мозг бедренных костей получали от животных, выведенных из эксперимента дислокацией шейных позвонков под эфирным наркозом. Полученные ткани гомогенизировали в гомогенизаторе Поттера на ледяной подложке и готовили суспензии клеток на физиологическом растворе хлорида натрия из расчета 2х106/мл [14]. Дизайн исследования представлен на рис.1.
Рис. 1. Дизайн исследования
Полученные в экспериментах данные математически обработаны на ПК с использованием программы SPSS.
Результаты исследования и их обсуждение. В наших экспериментах мыши линии BALB/c достаточно высоко отвечали на иммунизацию ЭБ, что соответствует данным литературы [13,14,15,16]. То есть, в селезенке, тимусе и костном мозге животных накапливалось достаточно большое число розеткообразующих клеток (РОК), в сыворотке крови — гемагглютининов.
Динамика численности РОК представлена на диаграмме (рис. 2), из которой видно, что их максимальное число во всех видах исследованных тканей приходится на 8 сутки после иммунизации (рис.2). При этом во все сроки наблюдения число РОК в тимусе мышей было минимальным по сравнению с селезенкой и костным мозгом (p<0,001 и p<0,01 соответственно). Даже на пике иммунного ответа число РОК в тимусе оставалось в 2,8 раза ниже по сравнению с их числом в селезенке и в 3,8 раза — в костном мозге (рис.2).
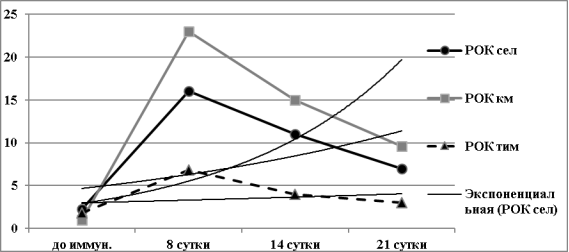
Рис. 2. Динамика численности иммунных розеткообразующих клеток (РОК) х103/на 106 кариоцитов селезенки, костного мозга и тимуса у мышей BALB/c, иммунизированных ЭБ
На 21 сутки после иммунизации во всех исследованных тканях численность иммунных РОК значительно снижалась по сравнению с 8 и 14 сутками (p<0,05 во всех случаях). При этом в костном мозге и селезенке она оставалась несколько повышенной против исходного уровня (до иммунизации) (p<0,05), в тимусе — возвращалась к исходному уровню. Линии тренда на графике (рис.2) достаточно четко иллюстрируют тенденции изменения численности РОК в иммунокомпетентных тканях иммунизированных мышей. Хорошо видно, что в тимусе тенденция к накоплению — минимальна.
Гуморальный ответ на иммунизацию ЭБ у мышей был так же хорошо выражен, как и клеточный (рис.3). Максимальный десятичный логарифм титра антител (lgT) составил 7,5±0,3 и пришелся на 6–11 сутки после иммунизации (в среднем на 8,5±0,55 сутки).
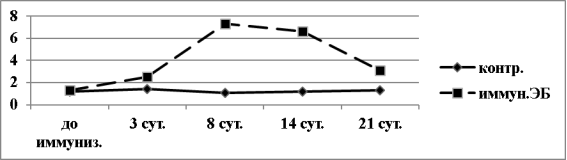
Рис. 3. Динамика lgT гемагглютининов в сыворотке крови мышей BALB/c, иммунизированных ЭБ
Исследование клеточного состава периферической крови мышей в динамике ПИО на ЭБ показало, что в лейкоформуле периферической крови животных контрольной группы, которым внутрибрюшинно вводили 0,1 мл физиологического раствора хлорида натрия,в первые 3 суток увеличилась численность полинуклеаров. В результате чего значение ГИ увеличилось до 0,8±0,05 против исходного 0,65±0,03 (p<0,05) (рис.4). Мы считаем, что это вполне физиологическая (неспецифическая) реакция организма животных на травму тканей брюшины и брюшной полости раствором хлорида натрия.
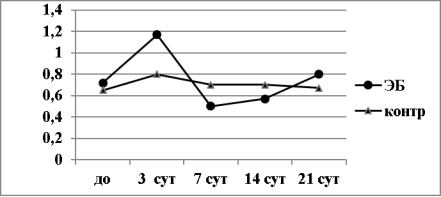
Рис. 4. Динамика значений величины ГИ (условные единицы) в первичном иммунном ответе мышей BALB/c на ЭБ в зависимости от схемы эксперимента
В дальнейшем численность мононуклеаров в периферической крови нарастала и к 7 суткам значения ГИ восстанавливались до исходного уровня (различие по отношению к исходному уровню во всех случаях не достоверно, p>0,05). Таким образом, внутрибрюшинное введение физиологического раствора хлорида натрия вызывает у мышей кратковременную физиоло-гически оправданную реакцию асептического воспаления, сопровожда-ющуюся активацией гранулоцитарного ростка кроветворения.
В группе иммунизировнных мышей на 3 сутки после иммунизации ЭБ численность гранулоцитов увеличилась в значительно большей степени по сравнению с предыдущей (контрольной) группой животных (рис.4). Ввеличина ГИ при этом составила 1,17±0,08 против исходной 0,7±0,04 (p<0,01). С 7 по 21 сутки в периферической крови иммунизированных животных преобладали мононуклеары, вследствие чего величина ГИ достоверно снизилась против уровня контроля (p<0,05). На 21 сутки чис-ленность гранулоцитов увеличилась и значение ГИ восстановилось до ис-ходного уровня (рис.4). Наши результаты находятся в соответствии с данными, как полученными нами ранее [18], так и другими исследователями [11,21]. В частности, известно, что введение антигена (ЭБ) мышам линий BALB/c и CC57W стимулирует миелоидный, но кратковременно угнетает эритроидный и лимфоидный ростки кроветворения в костном мозге. Одновременно с этим наблюдается стимуляция лимфоидного ростка в селезенке и тимусе [21]. Другими словами картина крови мышей, иммунизированных ЭБ, четко отражает динамику и выраженность реакции со стороны крови и иммунной систем животных на введение тимусзависимого антигена. На наш взгляд полученные данные позволяют использовать определение величины ГИ для характеристики функциональной активности как врожденой, так и адоптивной иммунной систем организма.
Результаты определения величины индекса миграции лейкоцитов (ИМЛ) в динамике иммунного ответа мышей на ЭБ представлены на диаграмме (рис.5).
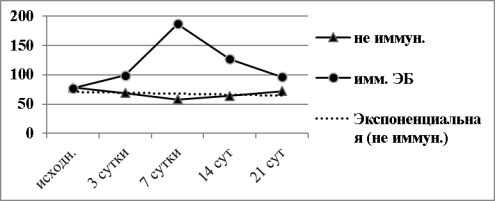
Рис. 5. Динамика значений ИМЛ в первичном иммунном ответе мышей BALB/c на ЭБ в зависимости от схемы эксперимента
Хорошо видно, что в контрольной группе животных (не иммунизированных ЭБ) изменения значений ИМЛ не достоверны на всем протяжении исследования (p>0,05). Это четко иллюстрирует линия тренда на графике. На 3 сутки после иммунизации величина ИМЛ достоверно увеличилась в сравнении с исходной и составила 99,7±2,9 против 69,3± 7,2 (p<0,01).
На 7 сутки после иммунизации ИМЛ в присутствии лизата ЭБ увеличился до 187,9±12,7 и это было максимальное значение показателя. Начиная с 14 суток ИМЛ постепенно снижался, но и на 21 сутки оставался достоверно повышенным против исходного уровня (96,8±4,9 против 69,3± 7,2) (p<0,05).
Таким образом, величина ИМЛ, на наш взгляд, соответствует выраженности иммунного ответа мышей BALB/c на ЭБ и имеет динамику, аналогичную динамике накопления иммунных РОК в селезенке (рис.4) и титров гемагглютининов в сыворотке крови (рис.3).
Мы уже отмечали, что изучение первичного иммунного ответа животных на тимусзависимый антиген (в том числе на ЭБ) является одним из наиболее принятых методических подходов к изучению иммунотропной активности различных препаратов и широко используется как в фундаментальной, так и прикладной иммунологии. Помимо необходимости наличия специальной аппаратуры, реактивов для их постановки, существует необходимость вывода животных из эксперимента на каждой точке динамики иммунного ответа.
Полученные нами результаты позволяют контролировать выраженность иммунного ответа мышей BALB/c на ЭБ в хроническом эксперименте, так как требуют для выполнения использования микроколичеств крови, не угрожающих жизни животных.
Для подтверждения этого допущения мы провели парный корреляционный анализ между численностью розеткообразующих клеток в селезенке (РОК), значениями титров гемагглютининов (lgT), величиной гранулоцитарного индекса (ГИ) и значениями индекса миграции лейкоцитов (ИМЛ) в присутствии лизата ЭБ. Результаты представлены в таблице, из которой видно, что величина ГИ и значения ИМЛ достаточно высоко коррелируют с традиционными показателями выраженности иммунного ответа на тимусзависимый антиген, а именно — РОК и титрами гемагглютининов.
Таблица 1
Результаты корреляционного анализа показателей выраженности первичного иммунного ответа мышей BALB/c на ЭБ
|
Пары показателей |
Коэффициент корреляции (r) |
|||
|
До иммунизации |
3 сутки после иммунизации |
7 сутки после иммунизации |
21 сутки после иммунизации |
|
|
РОКс- lg T |
0,2 |
0,5 |
0,88 |
0,3 |
|
РОКс- ГИ |
-0,6 |
-0,56 |
-0,78 |
-0,2 |
|
РОКс- ИМЛ |
-0,3 |
0,6 |
0,83 |
0,52 |
|
lg T- ГИ |
-0,2 |
-0,4 |
-0,68 |
-0,66 |
|
lg T- ИМЛ |
0,15 |
0,37 |
0,88 |
-0,3 |
|
ИМЛ- ГИ |
0,14 |
-0,5 |
-0,82 |
0,2 |
При этом величина ИМЛ прямо коррелирует как с числом РОК селезенки (r=0,83), так и титрами антител (r=0,88), а значения ГИ — отрицательно (r = -0,78 и r = -0,68 соответственно). Однако оба показателя, на наш взгляд, иллюстрируют выраженность имунного ответа на ЭБ у мышей.
Таким образом, в качестве характеристик выраженности иммунного отве-та мышей на тимусзависимый антиген, в том числе ЭБ, в хронических экспе-риментах мы предлагаем использовать определение величины ГИ и значения ИМЛ в присутствии лизата ЭБ.
Выводы.
- В динамике первичного иммунного ответа мышей BALB/c на тимус-зависимый антиген -ЭБ величина гранулоцитарного индекса, пред-ставляющего собой отношение суммы циркулирующих полинуклеаров к сумме мононуклеаров, обратно коррелирует с численностью иммун-ных розеткообразующих клеток в селезенке и титрами гемагглюти-нинов в сыворотке крови животных.
- Значение индекса миграции лейкоцитов в присутствии лизата эритро-цитов барана прямо коррелирует с численностью иммунных розет-кообразующих клеток в селезенке и титрами гемагглютининов в сыво-ротке крови мышей BALB/c, иммунизированных эритроцитами барана.
- ГИ и ИМЛ могут быть использованы в качестве доступных и прак-тически экспрессных характеристик выраженности иммунного ответа мышей на ЭБ в хронических экспериментах.
Литература:
- Hirschhorn K., Bach F., Kolodny R. L. at all. (1963) Immune response and mitosis of human peripheral blood lymphocytes in vitro. Science.142:1185–1187.
- Jerne N., Nordin A. (1963) Plaque formation agar by single antibody-producing cells. Science.140: 405–407.
- Khaitov R. M. Immunology (2008) Moscow, GEOTAR-Media Publishing Group. 255 p.
- Klinman N. R. and Taylor R. B.(1969)General methods for the study of cells and serum during the immune response: the response to dinitrophenyl in mice. ClinExpImmunol. Apr.4(4): 473–487.
- Zaalberg O. A.(1964) Simple method for detecting single antibody-forming cells. Nature. 202:1231–1233.
- БорисовВ.И. (2007) Укорочение длины теломерных районов ДНК при иммунодефицитных, аллергических и аутоиммунных состояниях: Автореф. Дис. канд.биол. наук. — Новосибирск. — 25 с.
- Бухтояров О. В., Самарин Д. М., Борисов В. И.,Сенюков В. В., Кожевников В. С., Козлов В. А.(2008) Гипносуггестивно индуци-рованная реинтеграция иммунной системы онкологических больных. Медицинская иммунология.10, (6): 527–534.
- Зигль Э. (1978) Реакция гемагглютинации. В кн. Иммунологические методы под ред. Г. Фримеля. Мир:М.- с. 108–112.
- Иммунологические методы (под ред. Фримель Г.). Мир:М.-1987.-472 c.
- Кисленко В. Н. Иммунологические методы диагностики(электрон-ный учебный ресурс). Новосибирск.- 2010.-72 с.
- Масная, Н. В. Реакции иммунной и кроветворной систем у мышей разных линий после антигенного и цитостатического воздействия. Автореф. дисс… д. м. н. 2005. — Томск.-35 с.
- Методические указания по изучению иммунотропной активности фармакологических веществ — в Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ под общей редакцией члена-корреспондента РАМН, профессора Р. У. Хабриева, М. Медицина.-2005.- С. 501- 514.
- Осипов Ю. Г. Генетический контроль чувствительности к иммуногенной стимуляции эритроцитами барана у мышей. Автореф. дисс… к.б.н. — Новосибирск. -1984.- 25 с.
- Петров Р. В., Манько В. М., Егоров И. К. О различной антителообразующей способности у мышей высокоинбредных линий. Докл. АН СССР. — 1963. -153, (3).с. 728–730.
- Петров Р. В., Манько В. М., Пантелеев Э. И. Межлинейные различия антителогенеза у инбредных мышей, иммунизированных одним или двумя антигенами. Бюлл. экспер. биол. мед.- 1966а. — № 8. — с. 70–74.
- Петров Р. В., Пантелеев Э. И., Манько В. М., Егорова B. C. Межлинейные различия антителогенеза у инбредных мышей и их генетическая обусловленность. Генетика. — 1966в. 2 (7).- с. 78–89.
- Плескановская С. А. Клеточный и гуморальный иммунный ответ при кожном лейшманиозе (экспериментальные исследования и наблюдения на больных).Автореф. дисс… к.м.н.- Москва. — 1982. -20 с.
- Плескановская С. А. Гематологические и цитохимические харак-теристики взаимоотношений паразит — хозяин при кожном лейманиозе. Автореф. дисс... д.м.н. — Москва. –1991.25 с.
- Плескановская С. А. Гранулоциты и гранулоцитарный индекс. Здравоохранение Туркменистана. — 1997. — № 3. с.23–26.
- Погабало А. В. Иммунотропная активность природного каротин-токоферолового комплекса. Автореф. дисс… к.м.н. — Москва. — 1997.-25 с.
- Узенбаева Л. Б., Виноградова И. А., Голубева А. Г., Чуров А. В., Илюха В. А. Возрастные изменения лейкоцитарной формулы и морфо-метрических параметров больших гранулярных лимфоцитов крови крыс при различных режимах освещения. Успехи геронтол.—2006.—вып. 19.—с. 79–84.







