Более чем у 50 % больных СД выявляются клинические проявления диабетической полинейропатии (ДПН), универсальным механизмом развития которой является оксидативный стресс (ОС). Коррекция симптомов ДПН назначением мексидола с мильгаммой была целью нашей работы. Под наблюдением на базе эндокринологического отделения ГКБ СМП № 10 г. Воронежа находилось 62 человека: 30 составили контрольную группу, 32 — основную, пациенты которой дополнительно ежедневно получали в/в 5 мл мексидола и 3 табл мильгаммы. Для диагностики ДПН применяли методы оценки неврологических симптомов по шкалам нейропатического симптоматического счета (NSS), общего симптоматического счета (TSS), невропатического дисфункционального счета (NDS) и нейропатической боли DN4. Изменение величин индексов нейропатического статуса (НС) у пациентов основной группе индекс NSS уменьшался на 27,5 %, TSS — 27,8 %, NDS — 22,4 %, DN4–30,9 % (W, p<0,05). При сравнении индексов НС снижение индексов NSS, TSS, NDS и DN4 было на 21,9 %, 21,3 %, 17,9 % и 22,5 % больше в группе пациентов дополнительно получавших мексидол с мильгаммой, что сопровождалось существенным уменьшением нейропатических проявлений ДПН (U, p<0,05).
Ключевые слова:сахарный диабет, диабетическая полинейропатия, индекс нейропатического статуса, оксидативный стресс, мексидол, мильгамма.
Сахарный диабет (СД) остаётся наиболее распространённым заболеванием органов эндокринной системы, сопровождающимся развитием хронических осложнений: ангио- и нейропатии [6]. Изучение формирования СД 2 типа и его осложнений раскрывает общие патогенетические звенья заболевания. Так рольстимулирования перекисного окисления липидов (ПОЛ), низкой эффективности антиоксидантной системы (АОС) в развитии СД 2 типа и его осложнений не вызывают сомнений [8,10].Наиболее частым хроническим осложнением СД 2 типа является диабетическая полинейропатия (ДПН) [2,6,7]. Клинические проявления ДПН встречаются более чем у 50 % больных СД. У 10–15 % пациентов с СД 2 типа инструментальные, в ряде случаев, клинические проявления ДПН опережают диагностику основного заболевания. Частота поражения нервной системы зависит как от степени компенсации углеводного обмена, так и степени оксидативного стресса (ОС) [5,8,9,10].
Одним из универсальных путей развития ДПН является ОС, представляющий дисбаланс между прооксидантами и АОС, ведущий к прогрессированию неврологических осложнений СД 2 типа [6,8]. Гликирование протеинов повышает активность оксидативных факторов и снижает уровень NO [8,9]. Склонность к гиперкоагуляции, эндотелиальная дисфункция способствуют уменьшению эндоневрального кровотока и развитию длительной эндоневральной ишемии, повышающей активность свободнорадикальных процессов [5,8]. Инактивация супероксиддисмутазы (СОД) вызывает взаимодействие NO с супероксид-анионом с увеличением пероксинитрита, способствующему прогрессированию дисфункции нейронов и эндотелия [3].
Действие этилметилгидроксипиридина сукцината(мексидола)в сочетании с в-витаминоподобными соединениями (мильгамма) направлено на усиление митохондриального окисления глюкозы, что увеличивает синтез АТФ и нейтрализацию свободных радикалов, продукция которых в условиях тканевой гипоксии возрастает [1,2,3].
В связи с этим актуальное значение приобретает проблема фармакологической коррекции ОС с помощью экзогенных препаратов, оказывающих антиоксидантное и антигипоксантное действие [2,3]. Производные 3-оксипиридина (3-ОП) эффективно регулирующих процессы окисления и перооксидации, являются структурными аналогами соединений группы витамина В6, играющих важную роль в жизнедеятельности организма. Мексидол активно реагирует с перекисными радикалами липидов, повышает активность супероксиддисмутазы (СОД) и других антиоксидантных ферментов [8], а также оказывает нормализующее действие на состояние и углеводного обменов. Всесторонние исследования биологических свойств производных 3-ОП позволили установить их цитопротекторные свойства при действии на организм различных повреждающих факторов, что позволяет применять мексидол в качестве универсального средства антиоксидантной фармакотерапии [1,3]. Применение мексидола в сочетании с мильгаммой в комплексном лечении больных СД способствовало позитивной динамике параметров ПОЛ: снижение уровня МДА, уменьшение выраженности ПОЛ, снижение уровня диеновых конъюгатов [2,5]. Установлено, что мексидол повышает чувствительность тканей к действию инсулина путём стимулирования прямого окисления глюкозы в пентозофосфатном шунте, снижая глюкозотоксичность в отношении к транспортерам глюкозы, инсулиновым рецепторам [2].
Цель исследования
Оценка клинической эффективности производных 3-ОП (мексидола) в сочетании с мильгаммой в лечении больных СД 2 типа с ДПН.
Материалы и методы исследования
Под наблюдением на базе эндокринологического отделения МБУЗ ВГКБ СМП № 10 находилось 62 человека с диагнозом: СД 2 типа, средней степени тяжести, некомпенсированная стадия, ДПН нижних конечностей, дистальный симметричный тип, сенсорная форма. Для исследования ДПН применяли стандартные методы [4,6]: оценка неврологических симптомов по шкале нейропатического симптоматического счета (NSS) и интенсивности их выраженности по шкале общего симптоматического счета (TSS), тактильной чувствительности 10 г монофиламентом Semmes-Weinstein 5.07; порога болевой чувствительности при помощи ручки Neuropen; температурной чувствительности с помощью термического прибора Thip-term; порога вибрационной чувствительности градуированным неврологическим камертоном Rydel-Seiffer 128 Гц ахиллова и коленного рефлексов неврологическим молоточком. Чувствительность определялась в зонах согласно протоколу расчёта шкалы невропатического дисфункционального счета (NDS) с последующим вычислением индекса NDS и индекса нейропатической боли по шкале DN4. ДПН классифицировалась по стадиям (0, 1, 2, 3) согласно P. J. Dyck (1988), P. K. Thomas (1997) [7,11].Все пациенты получали комбинированную гипогликемизирующую терапию производными сульфанилмочевины в сочетании с метформином в режиме титрации доз до достижения целевых показателей, рекомендуемых для больных СД 2 типа [4].
В исследование было включено 62 человека, из них женщин — 32 (51,6 %), мужчин — 30 (48,4 %). Средний возраст пациентов составил 52,1±0,8 лет, средняя длительность СД 2 типа — 6,4±0,3 лет, ДПН — 5,6±0,2 лет. В зависимости от вида аддитивной терапии больные были разделены на две группы: пациенты первой (n=30) составили группу контроля, второй (n=32) — дополнительно ежедневно получали в/в 5 мл мексидола, растворённого в 200 мл 0,9 % раствора хлорида натрия в течение 14 дней, пролонгируемую пероральным приёмом мексидола по 125 мг 3 раза в день в течение 8 недель в сочетании с мильгаммой по 1 табл 3 раза в день в течение 10 недель. Обе группы были сопоставимы по полу, возрасту, длительности СД, ДПН.Лабораторные методы исследования крови проводились по общепринятым методикам при поступлении и на 14 сутки нахождения в стационаре. При оценке биохимических параметров за основу брались физиологические нормы, соответствующие международной системе единиц в клинических исследованиях.Статистическая обработка выполнена с помощью программ Excel 2013 (Microsoft) и Statistica 8.0 (StatSoft, Inc.), тип распределения выборки оценивали с помощью критерия Колмогорова-Смирнова, исследуемые показатели приведены в виде M±m, для внутригруппового сравнения использовали критерий Вилкоксона (W), для межгруппового — критерий Манна-Уитни (U), критический уровень значимости (p) принимали равным 0,05.
Результаты исследования и их обсуждение
Первые жалобы, характерные для ДПН нижних конечностей выявлялись в течение 12–18 мес от верификации СД.Индексы оценки нейропатического статуса (НС) (NSS, TSS, NDS, DN4) у больных СД 2 типа соответствовали умеренной и выраженной степени полинейропатии (табл. 1).
Таблица 1
Общая характеристика наблюдаемой группы больных сахарным диабетом 2 типа с диабетической полинейропатией до начала лечения
|
Параметр |
Значениепараметра, M±m |
|
Уровень HbA1c, % |
9,81±0,24 |
|
Уровень глюкозы крови в 8 ч, мМ/л |
9,2±0,29 |
|
Уровень глюкозы крови в 11 ч, мМ/л |
13,1±0,22 |
|
Уровень глюкозы крови в 14 ч, мМ/л |
8,9±0,27 |
|
Индекс NSS, баллов |
9,59±0,21 |
|
Индекс TSS, баллов |
11,25±0,29 |
|
Индекс NDS, баллов |
18,48±0,45 |
|
Индекс DN4, баллов |
7,39±0,27 |
Исследование корреляционных взаимосвязей выявило высокую корреляционную зависимость длительности СД 2 типа и ДПН со степенью выраженности нейропатических проявлений по вычисленным индексам НС: индекс TSS, r+0,74 (p<0,01) и NDS, r +0,82 (p<0,01). Параметры углеводного обмена положительно коррелировали с величинами индексов НС: так уровень препрандиальной гликемии обнаруживал взаимосвязь с индексом NSS, TSS и NDS, r от +0,67 до +0,76 (p<0,05); постпрандиальная гликемия коррелировала в большей степени с индексом NDS, r = +0,71 (p<0,05). Уровень HbA1cбыл повышен у всех больных и свидетельствовал о декомпенсации у большинства наблюдаемых лиц, а также обнаруживал прямую взаимосвязь с индексом TSS и NDS, r составил +0,73 и +0,78 (p<0,05) соответственно.
Анализ исследуемых параметров у больных СД 2 типа с ДПН в группе контроля показал, что стандартная гипогликемизирующая терапия недостаточно эффективна в профилактике и лечении ДПН. Изменение величин индексов НС характеризовалось падением NSS на 11,8 %, TSS — 11,6 %, NDS — 7,5 %, DN4–15,1 % (W, p<0,05). Базисная терапия способствовала достоверному снижению уровня пре- и постпрандиальной гликемии и концентрации HbA1c по завершении стационарного периода наблюдения: гликемии в 8 часов на 20,7 %, в 11 часов на 27,2 %, в 14 часов на 17,3 %, HbA1c на 2,3 % соответственно (табл. 2; (W, p<0,05)).
Таблица 2
Состояние исследуемых параметров у пациентов группы контроля до и после базисного лечения
|
Параметр |
Значение параметра до начала лечения, M±m |
Значение параметра после базисного лечения, M±m |
|
Уровень HbA1c, % |
9,95±0,27 |
9,76±0,21 |
|
Глюкоза крови в 8 ч, мМ/л |
9,3±0,31 |
7,4±0,21* |
|
Глюкоза крови в 11 ч, мМ/л |
13,4±0,29 |
9,8±0,22* |
|
Глюкоза крови в 14 ч, мМ/л |
9,1±0,33 |
7,5±0,21* |
|
NSS, баллов |
9,61±0,19 |
8,47±0,17* |
|
TSS, баллов |
11,21±0,26 |
9,91±0,25* |
|
NDS, баллов |
18,33±0,44 |
16,95±0,47 |
|
DN4, баллов |
7,5±0,22 |
6,36±0,23* |
Примечание: «*» — уровень значимости p<0,05 при использовании критерия Вилкоксона (W).
Парентеральное применение мексидола в сочетании с мильгаммой у больных основной группы благотворно влияло на внутриклеточную утилизацию глюкозы клетками, что способствовало более существенному снижению уровня пре- и постпрандиальной гликемии (табл. 3). Антиоксидантная и антигипоксантная активность препаратов, сукцинат-опосредованное стимулирование микросомального окисления и энергопродукции, мембраностабилизирующее действие позволяют снизить степень выраженности окислительных реакций и благоприятно влиять на клинические проявления ДПН [1,2]. Так в основной группе изменениесостояния НС характеризовалось уменьшением индекса NSS на 27,5 %, TSS — 27,8 %, NDS — 22,4 %, DN4–30,9 %, что крайне положительно отражалось на общем состоянии больных и улучшало приверженность назначенному лечению (W, p<0,05). У пациентов основной группы достоверно корригировался как уровень глюкозы крови в 8 и 14 часов, а также спустя 2 часа после приёма пищи: значение гликемии снижалось на 38,1 %, 35,3 % и 33,7 % соответственно. Величина HbA1c значимо уменьшалась среди больных этой группы на 6,8 % (табл. 3; (W, p<0,05)).
Таблица 3
Состояние исследуемых параметров у пациентов основной группы до и после стандартного лечения в сочетании с применением мексидола и мильгаммы
|
Параметр |
Значение параметра до начала лечения, M±m |
Значение параметра после базисного лечения и мексидола, M±m |
|
Уровень HbA1c, % |
9,91±0,23 |
9,23±0,19* |
|
Глюкоза крови в 8 ч, мМ/л |
9,6±0,22 |
6,0±0,17* |
|
Глюкоза крови в 11 ч, мМ/л |
13,4±0,24 |
8,9±0,15* |
|
Глюкоза крови в 14 ч, мМ/л |
9,0±0,20 |
5,8±0,19* |
|
NSS, баллов |
9,58±0,17 |
6,95±0,15* |
|
TSS, баллов |
11,31±0,25 |
8,17±0,21* |
|
NDS, баллов |
18,54±0,55 |
14,38±0,45* |
|
DN4, баллов |
7,51±0,23 |
5,19±0,17* |
Примечание: «*» — уровень значимости p<0,05 при использовании критерия Вилкоксона (W).
Оценка модификации показателей гликемического статуса и HbA1c двух групп показало, что дополнение стандартной гипогликемизирующей терапии парентеральным введением мексидола на фоне приема мильгаммы оказывало более благоприятное влияние на уровень препрандиальной гликемии в 8 и 14 часов и глюкозу крови постпрандиального периода в 11 часов, а также HbA1c в сравнении с соответствующими параметрами у больных группы контроля (рис. 1, рис. 2; (U, p<0,05)).
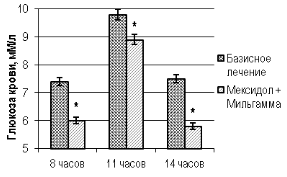
Рис. 1. Параметры гликемического статуса пациентов контрольной и основной группы после окончания стационарного этапа терапии
Примечание: «*» — уровень значимости различий значений p<0,05 при использовании критерия Манна-Уитни (U).
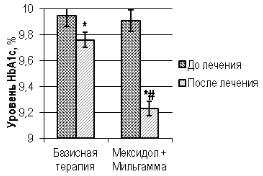
Рис. 2. Уровень гликированного гемоглобина у больных контрольной и основной группы до и после проведенного лечения
Примечание: «*» — уровень значимости разности значений p<0,05 при внутригрупповом сравнении с использованием критерия Вилкоксона (W); «#» — уровень значимости различий значений p=0,06 при межгрупповом сравнении параметра с использованием критерия Манна-Уитни (U) после окончания стационарного этапа лечения.
У больных основной группы после окончания стационарного этапа лечения величина глюкозы крови в 8, 11 и 14 часов по отношению к аналогичным параметрам в контрольной группе на базисномлечении была ниже на 23,3 %, 10,1 % и 29,3 % (U, p<0,05), а HbA1c — на 5,7 % соответственно.При сравнении индексовНС по окончании стационарного этапа лечения в контрольной и основной группах больных, выявлено значимое преимущество модификации стандартной гипогликемизирующей терапии дополнительным применениеммексидола с мильгаммой. Так снижение величины индекса NSS, TSS, NDS и DN4 было на 21,9 %, 21,3 %, 17,9 % и 22,5 % больше в группе пациентов дополнительно парентерально получавших мексидол с мильгаммой, что сопровождалось улучшением общего состояния больных и существенным уменьшением нейропатических проявлений ДПН у этой группы больных (рис. 3; (U, p<0,05)).
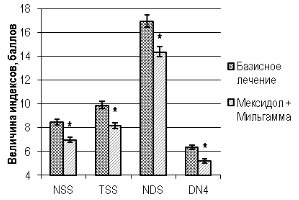
Рис. 3. Значения индексов нейропатического статуса (NSS, TSS, NDS, DN4) у больных сахарным диабетом 2 типа, осложнённым диабетической полинейропатией, в контрольной и основной группе после окончания стационарного этапа терапии
Примечание: «*» — уровень значимости разности значений p<0,05 при межгрупповом сравнении параметра с использованием критерия Манна-Уитни (U) после окончания стационарного этапа лечения.
Таким образом, производные 3-оксипиридина (мексидол) в сочетании с мильгаммой обладают выраженной антиоксидантной и антигипоксантной активностью, большой широтой терапевтического действия и нашли эффективное применение в коррекции неврологических осложнений СД. Ограничение свободнорадикальных процессов, ускорение внутриклеточного метаболизма глюкозы с потенцированием энергообеспечения тканей благоприятно влияют на состояние углеводного обмена, существенно расширяют возможности профилактики и лечения ДПН, как одного из часто выявляемых хронических осложнений у больных СД 2 типа, что позволяет использовать мексидол с мильгаммой в комплексной терапии больных диабетом.
Литература:
- Ангиопротекторная активность комбинации этилметилгидроксипиридин сукцината (мексикора) с актовегином при облитерирующем атеросклерозе артерий нижних конечностей / В. И. Инчина [и др.] // Регионарное кровообращение и микроциркуляция. — 2007. — Т. 6, № 2. — С. 58–62.
- Волчегорский И. А. Влияние препарата Мексидол на проявления дистальной симметричной полиневропатии у больных сахарным диабетом с синдромом диабетической стопы / И. А. Волчегорский, М. Г. Москвичева, Е. Н. Чащина // Фарматека. — 2007. — № 20. — С. 76–79.
- Воронина Т. А. Антиоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия / Т. А. Воронина // Психофармакология и биологическая наркология. — 2001. — № 1. — С. 2–12.
- Дедов И. И. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / И. И. Дедов, М. В. Шестакова. — М.: Медиа сфера, 2009. — 103 с.
- Новиков В. Е. Фармакология и биохимия гипоксии / В. Е. Новиков, Н. П. Катунина // Обзоры по клинической фармакологии и лекарственной терапии. — 2002. — Т. 1.— С. 73–87.
- Diabetic Neuropathy: Clinical Management SE / Ed. by A. Veves, R. A. Malik // Humana Press, 2007. — 516 p.
- Dyck P. J. Detection, characterization, and staging of polyneuropathy: assessed in diabetics / P. J. Dyck // Muscle Nerve. — 1988. — Vol. 11, N 1. — P. 21–32.
- Figueroa-Romero C. Mechanisms of disease: the oxidative stress theory of diabetic neuropathy / C.Figueroa-Romero, M.Sadidi, E. L. Feldman // Rev. Endocr. Metab. Disord. — 2008. — Vol. 9, N 4. — P. 301–314.
- Inhibitors of advanced glycation end-product formation and neurovascular dysfunction in experimental diabetes / N. E. Cameron [et al.] // Ann. N. Y. Acad. Sci. — 2005. — Vol. 1043. — P. 784–792.
- Oxidative status and lipid profile in metabolic syndrome: gender differences / A.Kaya [et al.] // Metab. Syndr. Relat. Disord. — 2010. — Vol. 8, N 1. — P. 53–58.
- Thomas P. K. Classification, differential diagnosis, and staging of diabetic peripheral neuropathy / P. K. Thomas // Diabetes. — 1997. — Vol. 46, Suppl. 2. — P. S54-S57.







