С 90-х годов наряду с исследованиями структурных и функциональных особенностей ядерного генома растений основное внимание исследователей привлекает изучение генетической системы хлоропластов и митохондрий. Генетическая система митохондрий отличается как от ядерной, так от хлоропластной своеобразием структуры генов, процессов репликации, транскрипции и процессинга первичных транскриптор. В ходе изучения молекулярных механизмов генной экспрессии и её регуляции в митохондриях растительных органов выявилось, что, помимо обеспечения процессов генерации и перераспределения энергии в клейке, она ответственна за целый ряд характеристик: устойчивость к антибиотикам и, патотоксинам, общая продуктивность эукариотических организмов, устойчивость к экспрессивным воздействиям, адаптационной изменчивости, цитоплазматической мужской стерильности [1; 2].
Материалы и методы исследования
Материалом исследований служили двухдневные этиолированные проростки и 14-дневные листья хлорапласта хлопчатника.
Методы получения рибосом митохондрий, хлоропластов и цитоплазмы хлопчатника описан ранее [1; 2]. Содержание белка в рибосомах определяли по методу [3], РНК по [4].
Коэффициент седиментации и плавучую плотность рибосом определяли по [5].
Семядоли проросших семян хлопчатника (24ч) отделяли от кожуры и инкубировали С14-уридином (120 МБК) или со смесью С14-аминокислот (по 40 МБК). Инкубацию проводили в течении 4 часов при 30оС на водяной бане при встряхивании. После инкубации семена проращивали в течении 20 часов на фильтровальной бумаге. После чего семена тщательно промывали водопроводной, потом дистиллированной водой, и использовали для получения меченых рибосом. Клеточные фракции полисом отделяли от суспензии рибосом (60.000–105000хд), несобранно связанные рибосомы (микросомы 40.000–105000хд) свободные рибосомы (105000хд).
РНК и РНК хлоропластов, митохондрий и цитоплазмы определяли по [6]. Нуклеотидный состав РНК определяли методом бумажной хроматографии [7].
Результаты и их обсуждения
Не смотря на многочисленные исследования в области биохимии растений, сведения о белках рибосом, хлоропластов, митохондрий высших растений немногочисленны.
Выделены рибосомы из хлоропластов и митохондрий ряда растений с коэффициентами седиментации 70s, 77s-78s [8; 1; 2]. Биохимическими, генетическими исследованиями показано, что цитоплазматические структуры клеток — пластиды и митохондрии относительно автономны [9; 10; 8; 1].
Рибосомы, выделенные из очищенных хлоропласт и митохондрий и цитоплазмы хлопчатника, имели типичны спектры поглощения в ультрафиолетовом свете с максимум при 126 НМ, и минимумом при 235 НМ (Е260/ Е280= 1,90; Е260/235=1,15).
Выделенные препараты рибосомы были гомогенными. По коэффициенту седиментации рибосом митохондрий показали величину 77,4s, рибосомы хлоропластов 70s, а цитоплазматические рибосомы показали 80s (рис. 1).
Таким образом, по величине плавучей плотности и по весовому соотношению РНК/белок митохондрий значительно отличается от рибосом хлоропластов и цитоплазмы хлопчатника.
Таблица 1
Некоторые физико-химические характеристики рРНК хлоропластов, митохондрий и цитоплазм хлопчатника
|
Рибосомы |
Константа седиментации |
Содержание нуклеотидов % |
||||||
|
Рибосомы |
Суб.частицы рибосом |
рРНК |
А |
Г |
Ц |
У |
Н+Ц |
|
|
Цитоплазмы |
80 s |
60 s |
25 s |
22,3 |
28,4 |
27,0 |
22,3 |
55,4 |
|
Хлоропласты |
70 s |
50 s |
23 s |
25,6 |
27,9 |
24,4 |
22,1 |
52,3 |
|
Митохондрии |
77,4 s |
58 s |
24,5 s |
22,9 |
25,1 |
27,4 |
22,2 |
52,5 |
Отличия рибосом митохондрий от рибосом хлоропластов и цитоплазмы хлопчатника были выявление путем определение нуклеотидного состава митохондриального рРНК. Сопоставление данных о нуклеотидном составе рРНК рибосом хлоропластной и митохондриальной рРНК (24,5 s — 52,5 %-ГЦ-пар, 17s-53,7 % ГЦ-пар) существенно не отличается от состава оснований рРНК хлоропластов (52,3 %-ГЦ-пар) и цитоплазмы (55,4 %-ГЦ-пар), что вероятно, обусловлено какой-то структурный особенностью митохондриальной рРНК (табл. 1).
Изучение интенсивности синтеза белка рибосом показало, что в рибосомах цитоплазмы С14-аминокислоты включаются активнее, чем в рибосомах хлоропластов и митохондрий хлопчатника (табл. 2). Оказалось, что включенные метки в рибосомах цитоплазм на 40–60 % больше чем в рибосомах хлоропластов и митохондрий.
Для изучения разных фракций рибосом митохондрий, хлоропластов и цитоплазмы хлопчатника опыты проводили по включению меченых предшественников invivo в составе рибосом.
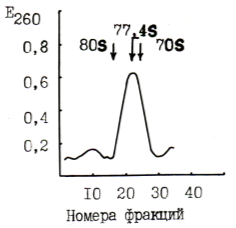
Рис. 1. Распределение рибосом хлоропластов (70S). Митохондрий (77,4s) и цитоплазмы (80S). Хлопчатника в градиенте точности сахарозы (5–20 %)
Таблица 2
Удельная радиоактивность рибосом, выделенных из хлоропластов, митохондрий и цитоплазмы хлопчатника (включение С14-аминокислоты, имп/мин/мг белка рибосом)
|
Меченая аминокислота |
Хлоропластические рибосома |
Митохондрические рибосома |
Цитоплазматические рибосомы |
|
Смесь аминокислот |
2550 ± 15 |
3400 ± 15 |
4140 ± 20 |
|
Вялен |
750 ± 20 |
1600 ± 10 |
1243 ± 35 |
|
Лизин |
500 ± 15 |
1200 ± 15 |
1462 ± 55 |
|
Глицин |
500 ± 10 |
700 ± 10 |
720 ± 15 |
|
Гистидин |
970 ± 17 |
1100 ± 15 |
1167 ± 20 |
|
Алинин |
1100 ± 22 |
1500 ± 20 |
2034 ± 15 |
|
Лейцин |
1000 ± 25 |
1200 ± 15 |
1368 ± 20 |
|
Гуталиновая кислота |
900 ± 20 |
1200 ± 10 |
1334 ± 15 |
|
Фениланин |
760 ± 25 |
1100 ± 15 |
1374 ± 20 |
Включение С14-уридана в рРНК и С14-аминокислот в белки рибосом цитоплазмы, хлоропласт и митохондрий изучалось в нескольких вариантах:
включение во фракцию свободных рибосом, полученных центрифугированием при 60000–105000д. эта фракция представлена в основном одиночными хлоропластными, митохондричными и цитоплазматическими рибосомами;
включение во фракцию микросом, полученных центрифугированием при 30000–60000д. эта фракция наряду со свободными рибосомами содержит связанные с мембранами рибосомы;
включение во фракции связанных с мембранами рибосом и свободных полисом, полученных центрифугированием при 30000–105000 д.
Установлено, что активность включения С14-уридине в РНК свободных рибосом хлоропластов в три раза, митохондрий в два раза ниже чем в РНК выделенных из микросом и полисом цитоплазмы хлопчатника.
Это освидетельствует о наличии во фракциях микросом и полисом цитоплазмы активной РНК, которая отличается от РНК свободных рибосом хлоропластов и митохондрий хлопчатника (табл. 3).
Активность включения С14-аминокислот в белках свободных рибосом хлоропластов и митохондрий в два раза ниже, чем в белки выделенных из фракции микросом и полисом цитоплазмы хлопчатника (табл. 4). Показано, что активность РНК и белков свободных рибосом, микросом и полисом в клетчатых структурах изменится по-разному. Меченые предшественники во всех фракциях рибосом цитоплазмы включаются интенсивнее, чем в хлоропластах и митохондриях.
Таким образом, данные физико-химического анализа рибосом хлоропластов, митохондрий и цитоплазмы хлопчатника подтверждают наличие значительных различий по коэффициенту седиментации, а также интенсивности биосинтеза РНК и белков рибосом, микросом и полисом. Данные о нуклеотидном составе РНК рибосом клетчатых структур свидетельствуют о том, что состав митохондриальной рРНК существенно не отличается от состава рРНК хлоропластов, что вероятно, обусловлено (какой-либо) структурной особенностью митохондриальной рРНК (табл. 1 [8]).
Таблица 3
Включение С14-уридина во фракциях РНК рибосом хлоропластов, митохондрий и цитоплазмы хлопчатника, имп/мин/иг РНК
|
Фракция |
Цитоплазмы |
Хлоропласт |
Митохондрий |
|
Свободные рибосомы 60.000–105.000 д. |
4975±90 |
214±20 |
3200±80 |
|
Мембраносвязанные рибосомы 30.000–60.000 д. |
12450±150 |
4000±30 |
7000±40 |
|
Полисомы 30.000–105.000 д. |
10625±120 |
2800±20 |
5000±180 |
Таблица 4
Включение С14-аминокислот во фракциях белков рибосом хлоропластов, митохондрий и цитоплазмы хлопчатника имп/мин/иг белка
|
Фракция |
Цитоплазмы |
Хлоропласт |
Митохондрий |
|
Свободные рибосомы 60.000–105.000д. |
4140±25 |
2650±15 |
3860±20 |
|
Мембраносвязанные рибосомы 30.000–60.000 д. |
5455±33 |
3900±20 |
4500±35 |
|
Полисомы 30.000–105.000 д. |
5600±30 |
2500±14 |
3900±18 |
Литература:
- Юсупов Т. Ю. «Изучение структуры митохондриального генома хлопчатника», автореф. дис. докт. биол. наук. — Ташкент, 1994. — 43 с.
- Рахматов Н. А. «Физико-химическая характеристика ДНК и рибосом хлоропластов хлопчатника», Дисс. доктора биол.наук. — Ташкент, 1990. — 390 с.
- Lowry. O.H., Losenbtouch F. J., Parr A., RandellL. “Protein measurement with pholinphonelreagent”. J. Bill Chem., 1951, v 193, 1.265–275.
- Спирин А. С. “Спектрофактическое определение суммарного количества нуклеиновых кислот”. Биохимия, 1958, — Т.23, — № 5, — С. 656–661.
- Гуликова О. М., Дынга Л. Н., Похомова М. Б., Зайцева Г. Н. “Рибосомы из сине-зеленой водоросли Anabaenavariables. Седиментационная, плотностная характеристика и анализ рибосом РНК”. Биохимия, 1976, — Т.41. — № 9, — С. 1567–1572.
- Kitby K. S. “The preparation of DNA by the psmisalicylatephool method” Biochim of biophys, Acta, 1959, 35, — P. 117–124.
- Векстрел Т. Б. «Первичная структура транспортной рибонуклеиновой кислоты». — М., Наука, 1970. — С. 13–26.
- Хазратов П. Р. «Изучение некоторых структурных особенностей транскриптов митохондриального Иком хлопчатника». — Ташкент, 1990, — с.19.
- Одинцова М. С. «Исследования генетического и фракционного аппаратов хлоропластов». Дисс. доктора биол.наук. — М, 1971, — 385 с.
- Ирисметов А. А. «Сравнительное исследование некоторых структурных особенностей митохондральной ДНК различных видов хлопчатника». Автореф.дисс... кандидата биол.наук. — Ташкент, 1990, — с. 17.







