Координационные соединения микроэлементов с биологически активными лигандами являются более активными по сравнению с их неорганическими солями и поэтому имеют важное значение в медицине.
Глютаминовая кислота (ГлютН2) является двухосновной кислотой и поэтому может образовывать как кислые, так и средние соли.
Настоящее исследование посвящено синтезу и исследованию геометрически изомерных координационных соединений Cu(II), Co(II), Mn(II) с глютаминовой кислотой, выявлению конкурентной координации донорных атомов глютаминовой кислоты к ионам металлов, расширению числа цис- транс- изомерных соединений и выяснению условий превращения одних изомеров в другие.
Нами синтезированы цис- транс- изомерные координационные соединения глютаминовой кислоты, содержащие одновременно два микроэлемента.
Синтез соединения K2 [Cu(Глют — 2Н)]·4H2O проводили по следующей методике: 0,1моль глютаминовой кислоты растворяли в растворе 0,2моль КОН (1:2) в 5мл воды, добавляли 0,1моль Cu(CH3COO)2 и перемешивали на магнитной мешалке до полного растворения последнего. Образовавший раствор ярко — синего цвета многократно обрабатывали спиртом до получения порошка, промывали эфиром и высушивали на воздухе. Выделен порошок фиолетового цвета, хорошо растворимый в воде, не растворимый в ацетоне, спирте, эфире.
При растворении полученного соединения в наименьшем количестве воды и нагревании до 90–100°С получено соединение состава K2 [Cu(Глют — 2Н)]·4H2O голубого цвета.
Синтез растворимого в воде соединения Mn [Cu(Глют — 2Н)]·4H2O проводили по следующей методике: 0,1 моль глютаминовой кислоты растворяли в растворе 0,1 моль КОН (1:2) в 5мл воды, добавляли 0,1 моль Cu(CH3COO)2 и перемешивали на магнитной мешалке до полного растворения. К полученному раствору синего цвета добавляли 0,1 моль Mn(CH3COO)2 и продолжали перемешивание на магнитной мешалке в течение 1часа. Продукт высаливали этиловый спиртом и обрабатывали спиртом до образования порошка. Порошок отделяли, промывали спиртом, эфиром и высушивали на воздухе. Полученное соединение — порошок светло — голубого цвета, растворяется в воде, не растворяется в ацетоне, спирте, эфире. Реакция протекает по следующей схеме:
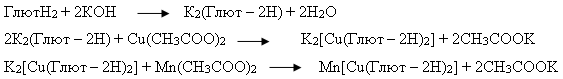
Синтез нерастворимого в воде соединения Mn [Cu(Глют — 2Н)2]Н2О. Растворимое соединение Mn [Cu(Глют — 2Н)2]4Н2О, полученное по описанной выше методике, растворяли в небольшом количестве воды и нагревали до 90–100°С. При этом осаждалось соединение голубого цвета, не растворимое в воде, спитре, ацетоне и эфире.
Соединение Со [Cu(Глют — 2Н)2]4Н2О растворимое в воде. Как и ранее, к двузамещенной калиевой соли глютаминовой кислоты при перемешивании на магнитной мешалке добавляли 0,1 моль Сu(CH3COO)2 и затем 0,1 моль Со(CH3COO)2. Продукт также высаливали спиртом и многократно обрабатывали спиртом до образования порошка, так как вещество гигроскопично. Выделен порошок светло — фиолетового цвета, хорошо растворимый в воде, не растворимый в ацетоне, сприте, эфире. Реакция протекает по следующей схеме:

Для синтеза нерастворимого в воде соединения Co [Cu(Глют — 2Н)2]·3Н2О к растворимому соединениюCo [Cu(Глют — 2Н)2]·4Н2О добавили небольшое количество воды и нагрели до 90–100°С. Выпал осадок синего цвета не растворимый в воде, в спирте, ацетоне, эфире.
Соединение Mn [Cо(Глют — 2Н)2]Н2О растворимое в воде получали аналогично вышеуказанной методике. К двузамещенной калиевой соли глютаминовой кислоты при перемешивании на магнитной мешалке добавляли 0,1 моль Co(CH3COO)24Н2О и затем 0,1 моль ацетата марганца. Продукт высаливали спиртом и обрабатывали спиртом до образования порошка. Отметим, что вещество очень гигроскопично, и поэтому его многократно обрабатывали спиртом. Получен порошок фиолетового цвета, очен хорошо растворимый в воде, не растворимый в спирте, ацетоне, эфире. Реакция протекает по схеме:
![]()
Соединение Mn [Cо(Глют — 2Н)2]Н2О не растворивое в воде синтезировали растворением соединения Mn [Cо(Глют — 2Н)2]Н2О в небольшом количестве воды и нагреванием до 90–100°С. Выпал осадок бардового цвета, не растворимый в воде. Соединение не растворяется также в спирте, ацетоне и эфире.
Анализ кординационных сединений глютаминовой кислоты состава
Mn [Cu(Глют — 2Н)2]4Н2О и Со [Cu(Глют — 2Н)2] · 4Н2О проводили по следующей методика. Навеску вещества разлагали при нагревании под действием смеси концентрированных HNO3 и H2SO4 в соотношении 5:1 до обесцвечивания слоя H2SO4, разбавляли водой до 100мл и нейтрализовали раствором NaOH. Из раствора определяли медь методом йодометрии. Для этого добавляли 3мл концентрированной уксусной кислоты, 3г KJ, накрывали колбу часовым стеклом, оставляли (для завершения реакции) в темноте на 5мин. Смесь титровали раствором Na2S2O3 до светло — желтого окрашивания, затем добавляли 2–3мл крахмала и титровали до обесцвечивания синей окраски от одной капли Na2S2O3 [1].
После количественного определения меди количество раствора доводили до 200мл, и оставляли на сутки. Из раствора медь осаждалась в виде Cu2J2. После полного оседания меди отмеряли 100мл раствора и анализировали количественное содержание Co(II) и Mn(II) комплексонометрическим методом.
В соединении Mn [Co(Глют — 2Н)2] · H2O количественное содержание Mn(II) определяли персульфатным методом [2]. Для этого навеску вещества около 0,01мг разлагали при нагревании в присутствии смеси концентрированных HNO3 и H2SO4 в отношении 5:1 до обесцвечивания слоя серной кислоты, добавляли 3мл концентрированной H2SO4, 10мл 0,8 % раствора AgNO3, 10мл 25 % раствора персульфата аммония и кипятили в течении 1мин. Затем добавляли заданное количество щавелевой кислоты и избыток ее оттитровывали раствором перманганата калия до светло — желтого окрашивания.
Для определения содержания Со(II)к навеске около 0,1мг этого соединения после растворения в 5–10мл воды добавляли ацетон с таким расчетом, чтобы в конце титрования содержание ацетона в жидкости было не менее 50 %, добавляли 2–3г роданида аммония в качестве индикатора и 1мл насыщенного раствора уксуснокислого натрия. При этом жидкость приобретала бирюзовый цвет за счет образования (NH4)2 [Co(CNS)4]. Окрашенный раствор титровали раствором комплексона III до исчезновения бирюзовой и появления розовой окраски.
Количественное содержание азота в синтезированных комплексных соединениях определяли по микрометоду Дюма [3], содержание воды определяли весовым методом.
Данные элементного анализа синтезированных соединений приведены в таблице.
Таблица 1
Результаты элементного анализа комплексных соединений некоторых 3d — ионов с глютаминовой кислотой
|
Вычислено, % |
H2O |
14,25 |
14,25 |
14,87 |
4,18 |
14,87 |
11,22 |
4,24 |
14,92 |
24,40 |
|
N |
5,54 |
5,54 |
5,83 |
6,57 |
5,78 |
6,00 |
6,60 |
5,85 |
7,70 |
|
|
Mn |
- |
- |
11,32 |
12,89 |
- |
- |
13,01 |
11,50 |
- |
|
|
Co |
- |
- |
- |
- |
12,15 |
12,86 |
13,36 |
12,32 |
7,94 |
|
|
Cu |
12,58 |
12,58 |
13,18 |
14,84 |
13,10 |
13,37 |
- |
- |
- |
|
|
|
H2O |
15,01 |
15,19 |
14,33 |
4,14 |
14,24 |
11,86 |
4,00 |
14,29 |
24,30 |
|
N |
5,10 |
5,77 |
6,17 |
6,27 |
5,17 |
5,76 |
6,17 |
5,16 |
6,78 |
|
|
Mn |
- |
- |
11,63 |
13,46 |
- |
- |
13,30 |
11,64 |
- |
|
|
Co |
- |
- |
- |
- |
11,82 |
12,88 |
14,05 |
12,78 |
7,80 |
|
|
Cu |
12,43 |
12,66 |
13,19 |
15,17 |
13,27 |
13,91 |
- |
- |
- |
|
|
Соединение |
K2 [Cu(Глют — 2Н)2] · 4H2O |
K2 [Cu(Глют — 2Н)2] · 4H2O |
Mn [Cu(Глют — 2Н)2] · 4H2O |
Mn [Cu(Глют — 2Н)2] · H2O |
Co [Cu(Глют — 2Н)2] · 4H2O |
Co [Cu(Глют — 2Н)2] · 3H2O |
Mn [Co(Глют — 2Н)2] · H2O |
Mn [Co(Глют — 2Н)2] · 4H2O |
Na3 [Co(Глют — 2Н)2] · 10H2O |
|
Из литературных данных известно, что глицин образует изомерные соединения находясь не только в составе кинетически инертных комплексных соединений, но также и кинетически лабильных комплексов. Были выделены игольчатая и пластинчатая модификации глицината меди состава Cu(NH2CH2COO)2 · H2O [4].
В дальнейшем А. В. Абловым с сотрудниками установлено, что в пластинчатой форме функциональные группы лиганда имеют транс- расположение, а в игольчатой форме его аминный азот и карбоксильная группа имеют цис- расположение. Методом ИК спектроскопии авторами установлено, что в спектре моногидрата глицината меди в области 1390 см-1 имеется полоса симметричных валентных колебаний СOO- группы. У пластинчатой модификации т. е. у цис- изомера наблюдается расщепление полосы на два компонента 1393 и 1402 см-1.
Нахождение Cu(II) во внутренней сфере в соединениях Mn [Cu(Глют -2H)2]и Co [Cu(Глют-2H)2] установлено изучением реакции взаимодействия водного раствора этих соединений с ацетатом свинца. При этом через сутки выпадал осадок синего цвета, содержащий Си (II).
В ИК — спектре двузамещенной натриевой соли глютаминовой кислоты полосы νNH2 расположены при 3410 и 3270 см-1. В ИК — спектре соединений K2 [Cu(Глют-2H)2], Mn [Cu(Глют-2H)2], Co [Cu(Глют-2H)2] и Mn [Cо(Глют-2H)2] наблюдается смещение этой полосы в низкочастотную область, что указывает на образование связи M-NH2, где M=Cu, Co. Кроме того, в ИК — спектрах этих соединений имеются полосы при 1625 и 1410 см-1, характерные для карбоксилатной группы, что свидетельствует о замещении кислотных водородов на Cu(II), Mn(II), Cо(II). Для выяснения взаимного расположения амино- и карбоксильной групп двух молекул глютаминовой кислоты в синтезированных соединениях проведено сравнение полос поглощения растворимой и нерастворимой форм этих соединений.
ИК — спектры растворимой и нерастворимой форм в обезвоженном состоянии в общем схожи, но имеются и различия. Так, у нерастворимой формы соединения Mn [Cu(Глют-2H)2] в области 3200–3400 см-1 имеются три полосы поглощения при 3240, 3300 и 3340 см-1, обусловленные валентными колебаниями NH2 — группы, а у растворимой формы хорошо разрешены только две полосы при 3250 и 3310 см-1. Аналогичная картина наблюдается для голубой и фиолетовой форм соединения K2 [Cu(Глют-2H)2], что совпадает с различиями в ИК — спектре цис- и транс- изомерных соединений глицината меди Cu(NH2CH2COO)2•H2O.
В области 1410 см-1 присутствует полоса симметричных валентных колебаний СOO-группы. У растворимой формы комплексных соединений глютаминовой кислоты, содержащих два микроэлемента, имеется единичная частота в области 1410 см-1, а у нерастворимой формы полоса расщепляется на два компонента.
Из теории молекулярных орбиталей известно, что в случае плоскостных квадратных комплексов типа М(АВ)2 у транс- изомера, который имеет центр симметрии колебания, симметричные относительно центра группы должны быть неактивными. В связи с этим, у цис- изомера должно быть большее количество полос в спектре, чем у транс- изомера. Это требование соблюдалось для бис- глицината платины [5], а также и для октаэдрических комплексов [6, 7].
Таким образом, растворимая форма является транс- изомером, нерастворимая форма — цис- изомером, а для соединения K2 [Cu(Глют-2H)2] голубая форма является транс- изомером, а фиолетовая форма имеет цис- расположение.
Соединения различаются также окраской, формой кристаллов, данными спектра ДСО и другими физико-химическими свойствами.
Литература:
- Алексеев В. Н. Количественный анализ. М.: Химия, 1972, с. 336.
- Гиллебранд В. Ф., Лендель Г. Э., Брайг Г. А., Гофман Д. И. Практическое руководство по неорганическому анализу. — М., 1975, с. 460.
- Климова В. А. Основные микрометоды анализа органических соединений. –М.: Химия, 1975, с. 91.
- Гринберг А. А. Гольдбрайх З. Е. К вопросу о свойствах гликоколята меди. Журнал общ. химии, 1941, т.11, вып.12, с.1039–1045.
- Варшавский Ю. С., Инькова Е. Н., Гринберг А. А. Инфракрасные спектры и строение глициновых производных двухвалентной платины. — Журн. неорган. химии, 1963, т. 8, вып. 12, с. 2659–2667.
- Foust P., Quagliano J. V. The trans effect in inorganic coordination compounds. 1. Ultraviolet and infrared studies of cis- and trans- Dinitrotetramminecobalt (III) Chloride. — Jorun. Amer. Chem. Soc., 1954, vol. 76, p. 5346–5349.
- Melvin L. Morris and Daryle H. Busch. Infrared Spectra Studies on cis- and trans- Isomers of Diacidobis-(ethylendiamihe)-cobalt (III) complexes. Jorun. Amer. Chem. Soc., 1960, vol. 82, p. 1521–1524.







