Определения состава, устойчивости и доли накопления dl-тартратных комплексов циркония (IV) в водном растворе методом pH-метрии и математического моделирования равновесий, в широком диапазоне рН при мольном соотношении 1:1, 1:2 и 1:3.
До некоторого времени не был в достаточной степени изучен вопрос о состоянии циркония в водных растворах. Были предложены формулы некоторых комплексных ионов, таких, как [(ZrO(SО4)2]2- и [ZrOCl4]2-. Отличительной особенностью водных растворов циркония является значительное число образующихся различных комплексных ионов, высокая степень гидролиза их соединений, склонность к образованию полимерных соединений [1]. Гидролиз циркониевых соединений оказывает определенное влияние на свойства растворов циркония. С процессом гидролиза соединений циркония(IV) в растворе, связано образование полимерных соединений. На их образование в растворах указывают многие явления, которые протекают при потенциометрическом титровании, экстрагировании и нейтрализации [2].
Если рассматривать комплексные ионы Zr4+ в растворах, то нужно учитывать координацию молекул воды. При образовании устойчивого комплексного иона с ионной связью требуется; чтобы не только центральный ион имел большой заряд и малый радиус, но и лиганд в достаточной степени удовлетворял указанным условиям. Имея донорные свойства и обладая значительным дипольным моментом, вода образует устойчивые акваионы характеризующиеся ионным типом связи. Первостепенной задачей при исследовании аквакомплексов должно являться определение условии кислотности, при которых они существуют в присутствии анионов, не являющихся комплексообразователями [3].
Комплексообразование циркония с оксикислотами исследовалось при различных условиях (рН, концентрации растворов).
С использованием радиоактивных изотопов циркония, при концентрации протонов 2 моль/л, цирконий образует в растворе с некоторыми оксикарбоновыми кислотами следующие комплексы: тартраты MeHT3+ малаты MeHMal, Me(Lact)2+ триоксиглутараты MeHTog и Me(HTog)2.Если меньшая кислотность раствора, цирконий образует с оксикислотами комплексы с соотношением компонентов 1:1 и 1:2, в двумолярном растворе хлорной кислоты, цирконий взаимодействует с винной кислотой, образуя комплексы состава 1:1. В области концентраций ионов водорода 1,6–2.0 моль/л из молекулы винной кислоты выделяется один ион водорода, и реакция может быть описана уравнением:
Zr4+ + H2T = ZrHT3+ + Н+ (К1 = 98)
Если концентрация, ионов водорода меньше 1.6 моль/л, от кислоты, отщепляется два иона водорода, и тогда имеет место реакция:
Zr4+ + H2T=ZrT2+ + 2Н+(К2= 150)
Несмотря: на одинаковое соотношение, металл: лиганд при разных концентрациях ионов водорода, состав комплексов может быть различным, состояние ионов циркония в растворах зависит от кислотности среды. С уменьшением концентрации ионов водорода в растворе усиливается гидролиз металла или реакция может проходить с отщеплением разного числа протонов от молекулы оксикарбоновой кислоты [4]. Наиболее вероятно взаимодействие циркония с оксикислотами по уравнению:
Zr4+ + H nL = ZrHn-1 L3+ + H+
Экспериментальная часть.
В работе для определения устойчивости комплексных соединений и состава, мы применяли рН-метрический метод совместно с методом математического моделирования. В эксперименте использовались цирконилхлорид, марки ХЧ, dl -винная кислота. Растворы готовились на бидистилляте. Концентрацию ионов циркония (IV) определяли стандартным раствором ЭДТА в присутствие индикатора СПАНДС. Концентрацию винной кислоты определяли титрованием раствором гидроксида натрия концентрацией, в присутствие индикатора фенофталейна [5]. Активность протонов определяли на рН-метре. Моделирование равновесий в системе Zr4+ dl-винная кислота, и расчет констант устойчивости образующихся комплексов и их вклада в среднюю степень оттитрованности проводили с использованием программ CPESSP Ю. И. Сальникова.
Результаты иих обсуждения.
Методом pH-метрического титрования мы изучили комплексообразование в системе цирконий(IV) dl-винная кислота [5]. Комплексообразование иона циркония(IV) с винной кислотой начинается в кислой среде (рН <2) и приводит к образованию ряда комплексов. Нами проведено исследование системы ZrOCl2– виннаяя кислота методом рН метрического титрования в интервале рН 1,9–11,00. Для системы цирконий(IV) — dlH4T на рис.1 представлены зависимости функции образования Бьеррума от рН для соотношения металл: лиганд 1:1, 1:2 и 1:3.
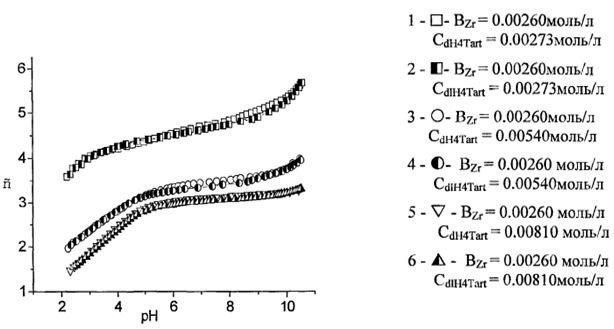
Рис. 1. Зависимость функции Бьеррума от рН для системы цирконий (IV) dl-винная кислота
Комплексообразование dl- винной кислоты начинается в кислой среде (рис.1) на начальном этапе образуется ZrHT+, который далее тетрамеризуется по схеме:
4ZrHT+ =Zr4T40 +4H+
Далее процесс комплексообразования сопровождается установлением равновесия, где последовательно оттитровываются восемь протонов.
Можно отметить что в областях рН от 2 до 5 для соотношения 1:2 и 1:3 поведение кривых от концентрации иона циркония(IV) не зависит, функция Бьеррума плавно растёт, наблюдается точка перегиба. При соотношении концентраций 1:1 образование комплексов состава металл: лиганд 1:1 и 4:4. Увеличение концентрации лиганда в два раза ведет к образованию комплекса состава 1:2 и 4:8. При соотношении реагентов 1:3, процессы комплексообразования описывают комплексы состава 1:2, 4:8 и 1:3. В диапазоне рН=4,5 до 10 преобладают комплекс Zr(HT)35-.При рН=7 доля комплекса состава Zr4(HT)3T513- увеличивается. В сильнощелочной среде происходит разрушение тетраядерного комплекса с высвобождением кислоты.
Состав и константы образования dl-тартратов приведены в таблице1.
Таблица 1
Константы образования dl-тартратов являются «эффективными», отражают вклад всех возможных изомеров
|
№ |
КОМПЛЕКС |
Стехиометрическая матрица |
(dl-) lgβq |
||
|
H4T (q) |
Zr4+ (p) |
H+ (r) |
|||
|
1 |
ZrНТ+ |
1 |
1 |
3 |
1.16+ 0.03 |
|
2 |
Zr4Т40 |
4 |
4 |
16 |
2.52±0.15 |
|
3 |
Zr4(ОН)Т-4 |
4 |
4 |
17 |
1.73 ±0.09 |
|
4 |
Zr4(ОН)2Т42- |
4 |
4 |
18 |
-2.30 ± 0.09 |
|
5 |
Zr4(ОН)3Т43- |
4 |
4 |
19 |
-8.52 ±0.11 |
|
6 |
Zr4(ОН)5Т45- |
4 |
4 |
21 |
-26.47± 0.11 |
|
7 |
Zr(Н2Т)НТ- |
2 |
1 |
5 |
-1.10+ 0.15 |
|
8 |
Zr(Н2Т)22- |
2 |
1 |
6 |
-4.83 ± 0.23 |
|
9 |
ZrТ24- |
2 |
1 |
8 |
-18.68 ±0.12 |
|
10 |
Zr4(НзТ)4(Н2Т)44+ |
8 |
4 |
12 |
20.48 ±0.12 |
|
11 |
Zr4(НТ)5Т311- |
8 |
4 |
27 |
-22.49± 0.21 |
|
12 |
Zr4(НТ)4Т412- |
8 |
4 |
28 |
-28.82± 0.18 |
|
13 |
Zr4(НТ)3Т513- |
8 |
4 |
29 |
-34.05± 0.15 |
|
14 |
Zr(Н3Т)2(Н2Т)0 |
3 |
1 |
4 |
3.80± 0.12 |
|
15 |
Zr(Н2Т)32- |
3 |
1 |
6 |
-1.34±0. 21 |
|
16 |
Zr(Н2Т)(НТ)24- |
3 |
1 |
8 |
-8.67± 0.12 |
|
17 |
Zr(НТ)35- |
3 |
1 |
9 |
-13.41+ 0.11 |
|
18 |
Zr(НТ)2Т6- |
3 |
1 |
10 |
-22.69± 0. 14 |
Таким образом, как показали расчеты комплексообразование циркония(IV) в водных растворах dl-винной кислоты сопровождается образование тетрамерных комплексов в интервале рН 1,9–11,0.
Литература:
- Елинсон С. В. Аналитическая химия циркония и гафния. М.: Наука, 1965. — 240 с.
- Конунова Ц. Б. Координационные соединения циркония и гафния с органическими лигандами. Кишинев: Штиица, 1975. 224
- Слободов А. А. Термодинамический анализ химических взаимодействий циркония с водными растворами / А. А. Слободов, А. В. Крицкий, В. И. Зарембо, Л. В. Пучков // Журн. приклад. химии. 1992. Т. 65. С. 1031–1041.
- Пятницкий, И. В. Исследование и аналитическое применение комплексов тартрат — кобальт — алюминий (цирконий, висмут) / И. В. Пятницкий, Л. М. Глущенко, Е. А. Погребная // Журнал аналитической химии. — 1974
- Шарло Г. Методы аналитической химии. М.: Мир, 1965. 950 с.







