В статье рассматривается органическое соединение растительного основания –алкалоида цитизина и получение из него биологически активного вещества(БАВ). Описаны методы получения фосфорсодержащих производных алкалоида цитизина по реакциям Тодда-Атертона и Кабачника-Филдса. Приведены данные по строению, изучению и получению фосфорсодержащих производных алкалоида цитизина, обладающие гепатопротекторным, антибактериальным действием.
Ключевые слова: синтез, алкалоид, цитизин, О,О-диметил-N-цитинизилфосфат, аминофосфаты.
Одним из перспективных направлений фарминдустрии является создание новых высокоэффективных биоактивных препаратов вследствие модифицирования природных растительных оснований — алкалоидов[1]. Интерес к алкалоидам проявляется тем, что многие из них являются лекарственными препаратами. Алкалоид цитизин широко распространен в природе, найден во многих растениях и извлечение его из растительного сырья ионообменным методом является главным промышленным способом его получения
В настоящее время многие фосфорорганические соединения нашли широкое применение в качестве эффективных лекарственных средств [2]. Основную долю фосфорорганических соединений нашедших наибольшее практическое применение составляют вещества, имеющие четырехкоординированный атом фосфора в молекуле, причем более половины из них имеют фосфатное строение. Введение фосфорсодержащего фрагмента в молекулу природного соединения может привести к созданию новых высокоэффективных биологически активных веществ. Данные вещества действуют на биологическую систему живого организма, регулируя их жизнедеятельность.
На сегодняшний день на базе инновационного научно-образовательного центра «Инновационные материалы и технологии» Карагандинского государственного технического университета проводятся работы по разработке методик получения гепатопротекторного препарата.
Экспериментальная часть
Получение амидофосфатов и аминофосфатов цитизина
Фосфорорганические соединения со связью P-Nпредставляют одну из больших групп среди фосфорсодержащих лекарственных препаратов. Методы получения биологически важных амидофосфатов хорошо изучены и широко используются в препаративной химии. Одним из методов синтеза амидофосфатов на основе аминов является реакция Тодда-Атертона. Взаимодействие диалкилфосфористых кислот с алкалоидом цитизином в условиях реакции Тодда-Атертона осуществляли в среде бензола в присутствии четыреххлористого углерода и триэтиламина [3].
- Синтез 0,0-диметил-N-цитизинилфосфата (1)
К смеси 2,86 г диметилфосфита и 24,6 г четыреххлористого углерода в 100 мл абсолютного бензола прикапывали при температуре 0–10 °С смесь 5 г цитизина и 2,63 г триэтиламина в 100 мл абсолютного бензола. Затем смесь перемешивали в течение 5 ч при комнатной температуре. Отфильтровывали и промывали гидрохлорид триэтиламина, отгоняли растворитель. Получили 5,6 г (72,1 %) продукта (перекристаллизация из бензола) с т.пл. 156 °С. [3] по следующей схеме:
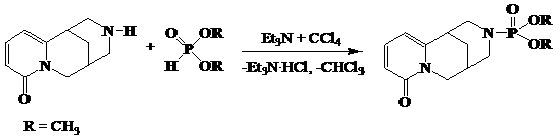
В спектрах ИК соединений присутствуют интенсивные полосы поглощения, характерные для фосфорильной группы (Р=0) с максимумом 1265–1270 см’1, в интервале частот 1025–1050 см’1 наблюдается полосы для Р-О-С-группы, а в области 825–835 см»1 расположены полосы поглощения для связи P-N.
При анализе ЯМР спектра наряду с сигналами протонов для алкалоидной части присутствуют сигналы неэквивалентных ме-токси-группы, которые проявляются в виде дублета дублетов в области 3,20- 3,55 м.д., что является следствием спин-спинового взаимодействия с ядром атома фосфора.
При анализе спектра ЯМР1 Н 0,0-диметил-N-цитизинилфосфата три группы сигналов низкого поля соответствуют протонам α-пиридинового ядра. Сигналы при 7,30 м.д. соответствуют β-протону. Расщепленный дублет при 6,36 м.д.- α-протону.следующая группа линий, представляющая собой сложный сигнал в области 3,81–4,12 м.д. соответствует аксиальному и экваториальному протону в положении С10.
С целью установления пространственного строения амидофосфатов было проведено рентгеноструктурное исследование 0,0-диметил-N-цитизинилфосфата. Установлено, что координация атома фосфора в исследуемом соединении — искаженная тетраэдрическая, обычная для фосфатных группировок. Дигидропиридиновый цикл плоский, карбонильный атом кислорода отклоняется от этой плоскости незначительно. Тетрагидропиридиновый цикл принимает конформацию софы. Пиперидиновый цикл имеет почти идеальную конформацию кресла.
Одним из широко известных методов синтеза фосфонметилированных производных азотосодержащих соединений является классичексая реакция Кабачника-Филдса. Изучение влияний катализатора на выход продуктов реакции Кабачника-Филдса было проведено на примере N-диалкоксифосфо- рилметильных производных цитизина. С этой целью были поставлены ряд параллельных опытов с использованием каталиатора и без него. Установлено, что применение краун-эфиров позволяет повысить селективность процесса и способствует увеличению выхода целевых продуктов на 20–25 %. Действие краун-эфиров можно объяснить их способностью участвовать в образовании водородных связей с гидрофосфорильными соединениями, переводя тем самым последние в реакционноспособную симметричную форму Р-О-Н.
- Синтез Диметил -2-(-N-цитизинил)-2-пропилфосфоната (2):
Смесь 3,8г (0,02М) цитизина, 1,16г (0,02М) ацетона,2,2г (0,02М) диметилфосфита и каталитического колоичества 15-кр-5 в 100мл бензола кипятят 3 часа с одновременной отгонкой образующейся в ходе реакции воды. После окончания реакции образовавшийся осадок отфильтровывают, промывают несколько раз эфиром и сушат в вакууме. Получают 3,74 (55,0 %) соединения Rf=0,60, элюент ацетон:спирт =2:1.
- Синтез Диметил-2-(-N-цитизинил)-2-изобутилфосфонат (3):
Смесь 3,8г (0,02М) цитизина, 1,44г (0,02М) изомасляного альдегида, 2,2г (0,02М) диметилфосфита и каталитического количества 15-кр-5 в 100мл бензола кипятят 4ч. С одновременной отгонкой образующейся в ходе реакции воды. После окончания реакции растворитель выпаривают на роторном испарителе, остаток промывают несколько раз сухим эфиром и очищают перекрисстализацией из смеси бензола:гексана=2:0,5. Получают 6,15г (87 %) соединения Rf=0,62, элюент ацетон:спирт =2:1.
В ИК-спектрах соединений (2) и (3) имеются характерные полосы поглощения в областях 1220–1238см-1 (Р=О) и 1020–1035см-1 (Р-О-С). Валентные колебания карбонильной группы соединений проявляются интенсивной узкой полосы в области 1650–1700 см-1.
В спектрах ЯМР1 Н аминофосфатов (2) и (3) протоны основного алкалоидного скелета проявляются в характерных областях. Три группы сигнала низкого поля соответствуют протонам α-пиридинового ядра. Сигналы при 7,20м.д соответствует Н2, расщепленный дублет при 5,94м.д. соответствует протону Н3,а расщепленный дублет 6,32 м.д — протону Н1.Следующая группа линий, представляющая собой мультиплет в области 3,20–4,40 м.д. соответствует экваториальному и аксиальному протонам в положений С7. Сигналы протонов Н8 имеют расщепление в области 2,38м.д в виде дублета. Группа линий в области 2,98–3,10 м.д. представляют собой сигналы Н4, Н6 протонов. Метиленовые протоны Н5 проявляется в виде сложного мультиплета в области с центром 1,96 м.д.
При сравнении спектров амидофосфонатов и цитизина наблюдается сдвиг сигналов С8. Это связано с тем, что не поделенная пара электронов соседнего атома азота, занимающая экваториальное положение в цитизине, при замещении атома водорода на более сложный радикал, становитсяаксильной. Благодаря этому становится возможной делокализацию неподеленной пары электронов на разрыхляющую орбиталь С-Н связи, что приводит к увеличению экранирования этих протонов.
При использовании в качестве карбонильного соединения — параформа в условиях Кабачника-Филдса, реакция протекает с образованием N,N-дицитинизилметана. Установлено, что диметилфосфит не успевает участвовать, так как цитизин быстрее конденсируется с формальдегидом с образованием соответствующего продукта конденсации. Это обусловлено, по-видимому, большей нуклеофильностью цитизина по сравнению с диметилфосфитом и высокой реакционной способностью формальдегида.
Обсуждения результатов
Результаты фармакологического исследования 0,0-диметил-М- цитизинилфосфата (1) [4] показали, что он обладает выраженным лечебным гепатопротекторным действием на моделях подострого и хронического тетрахлорметанового гепатита: увеличивает выживаемость животных, снижает уровень индикаторов цитолиза и уменьшаются признаки альтерации ткани, препятствует развитию цостнекротического цирроза и обеспечивает относительную сохранность биохимических процессов в клетках ткани печени. В механизме гепатопротекторного действия амидофосфата (1) присутствует антиоксидантный мембраностабилизирующий, желчегонный эффект и эффект индукции микросомальных ферментов печени.
Амидофосфат (1) обладает антигепатотоксическим свойством при остром отравлении CCL4, увеличивая выживаемость животных, защищая целостность структуры гепатоцитов, в основном стабилизируя мембраны, увеличивая компенсаторно-приспособительные возможности клеток и их детоксицирующую функцию. Вероятно, в защитном действии амидофосфата (1) при отравлении гепатотропным ядом, может иметь значение и установленный авторами факт индуцирования микросомальных ферментов печени в тесте «гексеналового сна». Кроме того, амидофосфат (1) обладает явным желчегонным действием на фоне не токсического поражения печени. По данным параметрам амидофосфат (1) вполне сопоставим с препаратом «Эссенциале», известного как гепатопротекторный препарат.
Можно констатировать следующие эффекты амидофосфата (1):
- антиоксидантный;
- мембраностабилизирующий;
- способность индуцировать микросомальные ферменты печени;
- желчегонный.
Амидофосфат (1) относится к классу малотоксичных фармакологических соединений — LDso — 4300 мг/кг (3200–5800) при пероральном введении соединения и LD50–1800 мг/кг (1250–2550) при внутривенном введении [5].
Синтезированные аминофосфатные производные цитизина прошли первые клинические испытания на гепатопротекторную активность. В результате скрининговых исследовании установлено, что соединение диметил-2-(- N-цитизинил)-2-изобутилфосфонат оказывает защитное действие при отравлении гепатотропным ядом ССl4 и обладает выраженным гепатопротекторным действием.
Литература::
- Кулаков И. В., Исабаева Г. М., Нуркенов О. А., Фазылов С. Д. Синтез 3-бензил-5-(4-нитрофенил)тиазол-2(3H)- тиона на основе 4-нитрофенилоксирана, бензиламина и сероуглерода // Химия гетероциклических соединений. 2009. Т. 45. № 4. С. 631–632.
- Юделевич В. И., Комаров Е. В., Ионин Б. И. Фосфорорганические лекарственные препараты (обзор)// Хим.-фарм. Журн.-1985.№ 6.- С.668–685.
- Номер патента:2156130; авторы: Витик Андрей Зиновьевич (KZ);Гуляев Александр Евгеньевич (KZ) Газалиев Арстан Мауленович (KZ).
- Предварительный патент РК № 3676 0,0-диметил-N-цитизинилфосфат, обладающий гепатопротекторной активностью/ Газалиев А. М., Тулеулов Б. И., Журинов М. Ж., Шалхаров С., АлиякпаровМ.Т., Гуляев А. Е.
- Тулеуов Б. И. Синтез, строение и биологическая активность новых фосфорсодержащих производных алкалоида цитизина//Автореферат дисс.канд.хим.наук.-Караганда-1992.-24с.







