)
В статье дается анализ фондовых материалов, мирового опыта обогащения живых кормов.
Ключевые слова: подращивание, личинки, науплиусы артемии, обогащенные корма, жирные кислоты, витамины, пробиотики.
В раннем постэмбриогенезе личинкам многих видов рыб при переходе на экзогенное питание необходимо вводить легкоусвояемые высокобелковые компоненты [1]. В качестве стартового живого кома используют науплиусы артемии, к достоинствам которых наряду с физиологической полноценностью можно отнести их размеры и легкость захвата личинками. Кроме того, сухие цисты артемии можно хранить в течение длительного времени [2]. Однако, несмотря на все преимущества артемии, она не является кормом, который обеспечивает личинкам рыб оптимальное для развития количество питательных веществ [2]. Особенно недостаточное в артемии содержание высоконенасыщенных жирных кислот (ВНЖК, HUFA) - эйкозапентаеновой (EPA) и докозагексаеновой (DHA), которые необходимы в процессе роста личинок, но в то же время не могут быть синтезированы [2].
Бельгийскими учеными разработан метод повышения питательной ценности метанауплиусов артемии с помощью обогащения (биоинкапсуляции) рачков ВНЖК [2]. Этот метод заключается в вылуплении артемии, отделении науплиусов, их отмывке от продуктов метаболизма и дальнейшем содержании в течение 24 часов в обогащенной среде. На второй метанауплиальной стадии артемия способна потреблять частицы, которые собираются в результате неселективной фильтрующе-питательной деятельности ее вторых антенн [2].
Для достижения этой цели используют морские водоросли, составные и микрокапсулированные корма и эмульсии. За рубежом (фирма INVEAquacultureNV; Бельгия) более 25 лет для биоинкапсуляции рачков применяют препарат Selco и его разновидности (Selco-Experimental, SuperSelco, SuperSelco-DHA и др.), представляющие собой комплексы экстрагированных жиров морепродуктов и витаминов [3]. Исследования по повышению пищевой ценности различных рас артемии прямым и косвенным методами показали, что науплиусы артемии очень легко ассимилируют ВНЖК 3, жирорастворимые 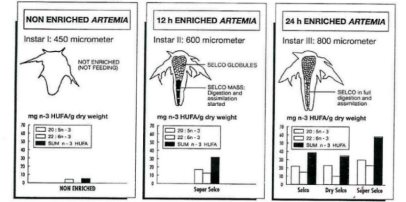
витамины и витаминные комплексы [4](рисунок 1) [3].
Рис. 1 – Содержание ВНЖК у обогащенных метанауплиусов артемии при использовании препаратов Selco, SuperSelco, SuperSelco-DHA [3]
После обогащения эмульсией Selсo науплиусы содержат в себе высокий уровень незаменимых полиненасыщенных жирных кислот - докозагексаеновой (22:6ω3) и эйкозапентаеновой (20:5ω3) [4].
Следует отметить, что через обогащение артемии личинки рыб могут быть «напитаны» как витаминами, так и пробиотиками, аминокислотами, гормональными препаратами, профилактическими, терапевтическими и другими средствами [1].
В настоящее время разработаны различные диеты для биоинкапсуляции артемии как стартового живого корма личинок морских видов рыб и ракообразных. Отработаны биотехнологические приемы, включая временные интервалы до и после обогащения, количество питательной эмульсии и температура для обогащения рачков [5, 6, 7].
Экспериментальные работы по кормлению личинок морских видов рыб артемией показали, что выживаемость европейского морского окуня (Dicentrarchuslabrax), морского леща (Sparus aurata), тюрбо (Scophthalmusmaximus), японской камбалы (Paralichthysolivaceus) тесно связана с содержанием у науплиусов артемии (A. franciscana) эйкозапентаеновой кислоты, в то время как скорость роста этого вида зависит от количества докозагексаеновой [2, 3].
Таким образом, для того чтобы обеспечить высокий темп роста и выживаемость личинок, обогащенная артемия должна содержать как 22:6ω3, так и 20:5ω3. Наибольший результат в темпах роста личинок морских видов рыб показывают диеты, имеющие соотношение DНА:ЕРА как 2:1 в течение первых двух недель кормления [2].
Известны экспериментальные работы по кормлению мальков африканского сомика-кошки (Clariasgariepinus), желтого судака (Stizostedionvitreum), полосатого окуня (Moronesaxatilis) и некоторых других видов рыб артемией (A. franciscana), обогащенной ВНЖК и витамином С [3].
Для ракообразных Mysidopsisbahia, Penaeusstylirostris и Penaeusmonodon питательная ценность обогащенных науплиусов в 1,5 раз выше, чем только что вылупившихся. При этом отмечается улучшение физиологического состояния личинок, увеличение их выживаемости и роста [3, 6, 8]. В то же время, следует отметить, что положительный эффект от кормления обогащенной артемией наблюдается лишь через 15-20 суток после введения в рацион биоинкапсулированных живых кормов [3].
Наблюдения иранских специалистов показали снижение смертности личинок персидского (Acipenser persicus) и сибирского (Acipenser baerii) осетра на 5–12 % после кормления науплиусами артемии (A. urmiana), обогащенными эмульсией из DHA, EPA и витамина С (20 %) [9], а также ВНЖК с поли-β-гидроксибутиратом [10], соответственно, в сравнении с кормлением необогащенной артемией.
При кормлении личинок сибирской стерляди (Acipenser ruthenus marsiglii Brandt)науплиусами, обогащенными препаратом Selco-DHA (с высоким содержанием докозагексаеновой кислоты), их скорость роста по массе на 20-е сутки была в 3,9 раза выше, чем при использовании стартового искусственного корма и в 1,6 раз больше, чем при кормлении необогащенной артемией [1].
С помощью метода биоинкапсуляции науплиусов артемии (A. franciscana) удалось повысить скорость весового роста личинок русского осетра (Acipenser gueldenstaedtii Brandt) в 2,9 раза по сравнению с использованным ранее методом кормления (в течение трех суток - науплиусы артемии, далее - перевод на стартовый искусственный корм Aller Aqua) и сократить смертность молоди в 1,3 раза (выживаемость у 18-суточных личинок достигала 97,6 %), что крайне важно в условиях промышленного подращивания осетровых [11].
В последние годы за рубежом в экспериментальных и коммерческих целях используют новые препараты для обогащения артемии (A. franciscana): MenhadenOil, ALGAMAC-2000, DOCOSAGOLD, MicroFeastL-10, Sander’sRich (Utah, USA) [11]; AlDHASelco (ArtemiaInternationalLLC, USA) [13];PROLON, P. SPARCLE, EASYDHASelco (INVEAquacultureNV, Belgium) [14, 15]. В эмульсии AlDHASelco и EASYDHASelco добавлены витамины А, Д3, С и Е, а также антиоксиданты [16].
Недавние исследования индийских ученых показали возможность использования для обогащения науплиусов вместо коммерческих препаратов некоторых видов микроводорослей: комплексы Nannochloropsissalina, Chlorellasalina и Spirulinasubsalsa или Chaetoceroscalcitrans, Skeletonemacoastatum, DunaliellasalinaиD. Bardawil [16], богатые высоким содержанием ЕРА, протеинов и витаминов. Науплиусы артемии (Artemiasp.), обогащенные в течение 15-ти суток Dunaliellasalina, имели повышенное содержание протеинов, углеводов и жирорастворимых витаминов – бета-каротинов, при внесении в течение 22 дней микроводоросли Chaetoceroscalcitrans– липидов [17].
Помимо микроводорослей, в качестве альтернативы наиболее часто используемого препарата Selco для обогащения рачков применяют рыбий жир (печень трески), а также масло Бурачника, основу которого составляет гамма-линоленовая кислота [17].
При кормлении личинок стерляди иртышской популяции (Acipenser ruthenus marsiglii Brandt) обогащенными науплиусами из водоемов Западной Сибири (A. parthenogenetica), калорийность сухого вещества 11-ти суточных личинок в 1,2 раза превышала калорийность личинок, питавшихся необогащенными рачками. Максимальные среднесуточные приросты у личинок сибирского осетра (до 38 %) отмечены при суточной норме кормления обогащенными кормами, равной 100 % от массы тела личинок осетра [1].
Итак, научный и коммерческий интерес к методу обогащения науплиусов артемии достаточно велик во многих странах, где занимаются выращиванием объектов аквакультуры. Перспективы использования биоинкапсулированных науплиусов артемии в огромны. Особенно эффективен этот метод при кормлении рыбы в период раннего личиночного развития.
Литература:
- Чепуркина М.А., Гилева Е.А. Прусиньска М., Кольман Р. Использование метода обогащения науплиусов артемии в осетроводстве. Вестник рыбохозяйственной науки. 2014.Т.1.№4(4).С.78-90.
- Литвиненко Л.И., Мамонтов Ю.П., Иванова О.В., Литвиненко А.И., Чебанов М.С. Инструкция по использованию артемии в аквакультуре. Тюмень. 2000. 58 с.
- Merchie G. Use of nauplii and meta-nauplii. Manual on the production and use of live foot for aquaculture. Edited by Lavens P., Sorgeloos P. Ghent, Belgium. University of Ghent. 1996. Р.137-158.
- Гершанович А.Д., Пегасов В.А., Шатуновский М.И., Экология и физиологиямолоди осетровых//М. ВО Агропромиздат. 1987. 52 с.
- Sorgeloos Р., Lavens P., Leger Ph., Tackaert W., Versichele D. Manual for the culture and use of brine shrimp in aquaculture. Belgium: Ghent universiteit, 1986. 319 p.
- Merchie G., LavensP.,DhertPh. Dietary ascorbic acid requirements during the hatchery production of turbot larvae. Journal of Fish Biology. 1996. Р. 573-583.
- Fushimi T. The food for fish larval of the Artemia. Bulletin of Japanese Society of Scientific Fisheries. 1975. Vol. 47, № 5. P. 67 - 83.
- Romdhane M.S., Devresse P., Leger P., Sorgeloos P. Effect of feeding omega 3 HUFA enriched Artemia during a progressively increasing period on the larviculture of the fresh water prawn Macrobrachium rosenbergii. Journal of Aquaculture Research. 1994. P. 581.
- Fashtomi H.R.P., Mohseni M. Survival and growth of larval and juvenile Persian sturgeon (Acipenser persicus) using formulated diets and live food // Journal of Applied Ichthyology. 2006. Vol. 22. P. 303–306.
- Прусиньска М., Чепуркина М.А. Кормление натуральным кормом осетров на ювенальных стадиях развития. Проблемы выращивания ювенальных стадий осетровых рыб, Ольштын, 2011. С. 23-33.
- Чепуркина М.А. Сохранение биоресурсов осетровых видов рыб Обь-Иртышского бассейна путем искусственного воспроизводства с использованием геотермальных вод: Автореферат диссерт. Насоиск. уч. степениканд. биол. наук. Новосибирск, 2010. 20 с.
- Tamaru C.S., Ako H., Paguirigan R., Pang L. Enrichment of Artemia for use of Ornamental Fish Production // Center of Tropical and Subtropical Aquaculture Publication, USA / Journal of Aquaculture. № 133. 2000. Р. 48-54.
- Lakshmana Senthil S., Maruthu Pandi T., Ajith Kumar T.T., Nandhini Devi K., Balasubramanian T. Exigent of Micro Algae for the Enrichment of Artemia salina // Journal of Aquaculture Feed Science and Nutrition 4 (2). 2012. P. 34-38.
- De Wolf T., Candreva P. Prolonged Artemia enrichment: an easy tool to reduce the Artemia consumption in marine finfish hatcheries // 3rd fish and Shellfish Larviculture Symposium “Larvi 2001”. Oostende, Belgium, 2001. P. 153-156.
- Naz M. The changes in the biochemical compositions an enzymetic activities of rotifer (Brahionus plicatilis Müller) and Artemia during the Enrichment and starvation periods // Springer. Fish Physiol. Biochem. № 34. 2008. P. 391-404.
- Djousse L., Arnett D.K., Carr J.J., et al. Dietary Linolenic Acid Is Inversely Associated With Calcined Atherosclerotic Plaque in the Coronary Arteries. Circulation. 2005. Vol. 111. P. 2921-2926.
- Hannah С., Mani M., Ramasamy R. Evaluation of the Biochemical Composition of Four Marine Algae and Its Nutritional Value for Brine Shrimp // Journal of Pharmacy and Biological Sciences. Vol. 6, Issue 3. 2013. P. 47-51.







