В статье рассмотрен состав основного компонента квасильного раствора овсяной муки, его действие на процесс квашения, зависимость квасильного раствора от состава ячменной муки, процесс приготовления квасильного раствора, его действие на шкуру, роль ферментов в проведении этого процесса, а также протекание микробиологических процессов.
Ключевые слова: квашения, процесс, овсяная мука, мех, вода, температура, шкура, коллаген, волокна, состав, фермент, углевод, сахар, кислота, активность, концентрация, рН.
In clause the structure of the basic component of a solution of the basic flour(torment), his(its) action on process of a solution from structure of a barley flour(torment), process of preparation квасильного of a solution, his(its) action on a skin, role in realization of this process, and also course of microbiological processes is considered.
Key words: process, a flour(torment), fur, water, temperature, skin, fibres, structure, carbohydrates, sugar, acid, activity, concentration, рН.
Квашение, или киселевание — один из наиболее старых способов обработки меха, сохранившийся при выработке некоторых видов меховых шкур (каракулевой группы, овчин).
Квасильные растворы приготовляют из овсяной или ячменной муки, отрубей и поваренной соли. Муку размешивают в воде при температуре 40–420С и выдерживают около суток для образования органических кислот (закисания).
Отмоченные шкуры загружают в указанный раствор, куда добавляют поваренную соль. Обработка продолжается от 4 до 6 суток. Проквашенность определяется по достижению своеобразного разрыхленного состояния шкур и появлению на мездряной поверхности при надавливании белой полоски, как и при оценке пропикелеванности.
По мере обработки шкур в растворе продолжается нарастание кислотности, достигающее к моменту их выгрузки 10–12 г/л в пересчете на молочную кислоту.
Изменения, происходящие в результате обработки шкур квашением, заключаются в частичном отслаивании эпидермиса, повреждении неороговевших компонентов волосяных сумок и луковиц, что может привести при чрезмерно резком воздействии к ослаблению волосяного покрова на шкуре. В практике это служит признаком их проквашенности, при продолжении квашения возможно непоправимое повреждение шкур.
Коллагеновые волокна при квашении распадаются на «открытые» волоконца примерно в 20 раз меньшего диаметра; разрыхленность их превосходит результат, достигаемый пикелеванием. Эта глубокая разрыхленность создает высокую пластичность шкур. Прочность волоконец после обработки не снижается.
Зерно злаков, употребляемых для приготовления квасов, состоит из трех главных слагаемых: многослойной оболочки, эндосперма и зародыша.
Наибольшее значение имеют крахмал и белковые вещества эндосперма и зародыша, осахаривающие и протеолитические ферменты, находящиеся в периферийных слоях и зародыше зерна.
Состав зерна (табл.1) зависит от разновидности злаков, климатических факторов, почвы, условий последующего хранения: влажности, температуры, содержания в воздухе кислорода и углекислоты.
Таблица 1
Примерный химический состав злаков,%
|
Злаки |
Вода |
Азотистые вещества |
Безазотистые вещества |
Жир |
Клетчатка |
Зола |
|
Овес |
12,8 |
10,2 |
59,7 |
5,2 |
10,0 |
3,0 |
|
Ячмень |
12,4 |
12,3 |
65,7 |
2,5 |
4,5 |
2,6 |
|
Рожь |
15,1 |
11,5 |
67,8 |
1,8 |
2,1 |
1,7 |
Состав зерна влияет на ход квашения: количество углеводов, активность осахаривающих ферментов предопределяют накопление сахаров и кислот; активность протеолитических ферментов связана с белковыми превращениями в шкуре. От начальной кислотности зерна, зараженности его микрофлорой зависит протекание микробиологических процессов.
Ферменты играют существенную роль в квашении, они имеют самостоятельное значение при обработке мехов посредством мягчения.
Многие процессы, обусловливающие развитие живых организмов, регулируются ферментами. Гидролиз белков, углеводов, эфиров в процессе усвоения питательных веществ, а также синтез тканей из простейших соединений, дыхание, микропроцессы, протекающие в клетках организма и регулирующие их обмен с окружающей средой, развитие организма в целом и его гибель немыслимы без участия ферментов.
Ферменты представляют собой белковые вещества. Некоторые из них выделены в чистом кристаллическом виде. Химическая природа ряда ферментов в настоящее время расшифрована. Установлены молекулярные веса, например, пепсина 35 000, папаина 27 000. Ферменты отличаются способностью ускорят химические реакции, которые самопроизвольно протекают с незначительной скоростью.
Ферменты можно рассматривать как катализаторы, созданные живым организмом. Каталитические реакции объясняются образованием промежуточных нестойких соединений катализатора и субстрата, которые немедленно разрушаются, образуя продукты распада вещества и свободный фермент, способный взаимодействовать с новой частичкой субстрата.
Механизм ферментативных процессов связан с явлениями адсорбции субстрата на поверхности фермента. Это приводит к увеличению концентрации реагирующего в данном месте вещества и следовательно, к повышению скорости реакции.
Ферменты либо тесно связаны с тем органом, работу каторого они регулируют, либо вырабатываются соответствующими железами и выделяются во внешнюю среду (ферменты пищеварительной системы).
Ферменты отличаются большой специфичностью. Каждый из них может воздействовать на узкую группу объектов, не затрагивая другие. Среди ферментов, расщепляющих белки, пепсин разрушает, а папаин не разрушает натуральный альбумин; пепсин разрушает коллаген, чистый трипсин действует на него в малой мере. Карбоксиполипептидаза разрушает полипептиды, на которые пепсин и папаин влияния не оказывают.
Название ферменту дается по тому веществу, на которое он действует, с прибавлением окончания «аза», например протеаза, липаза, мальтаза, полипептидаза; сохраняются и собственные наименования: пепсин, папаин.
Действие ферментов определяется температурой, величиной рН, активирующими и тормозящими реагентами. Результаты ферментативной реакции оцениваются либо по количеству неизмененого исходного вещества, либо по количеству и характеру образовавшихся продуктов реакции.
Принято разделять ферменты на четыре группы: регулирующие процессы гидролиза (или обратные ему); катализирующие окислительно-восстановительные реакции; вызывающие свертывание (коагуляцию) и, наконец, ферменты брожения (десмолазы). Наибольший интерес для нас представляет первая группа ферментов — гидролизы. Она в свою очередь разделяется на ферменты, гидролизующие углеводы (эфиразы), представителями которых являются амилолитические ферменты: амилаза и мальтаза; ферменты амидазы, гидролизующие преимущественно пептидные связи, в том числе в белках и продуктах распада; ферменты, расщепляющие эфиры (эстеразы): липаза, фосфотаза и др.
Среди ферментов, действующих на углеводы в процессе квашения, представляют интерес амилолитические ферменты. Они содержатся в зерне злаков, в особенности в прорастающем зерне (солоде); присутствуют в пищеварительной системе животных (выделениях слюнных желез). Амилазы растительного происхождения оказывают оптимальное воздействие при рН около 5; с повышением температуры до 550С активность их возрастает.
Солод представляет собой совокупность нескольких ферментов, из которых фосфотаза отщепляет фосфорную кислоту от соединений ее с углеводами, остальные вызывают разжижение и распад крахмала до мальтозы. Распад мальтозы до глюкозы происходит под действием фермента мальтазы. Она содержится в зерне и действует при рН около 7.
Ферменты, разрушающие белковые вещества и продукты их распада (протеазы), разделяются на протеиназы, способные расщеплять белки, и пептидазы, действующие на продукты деструкции белка. Протеиназы классифицируются в зависимости от заряда белка, на который они действуют.
Трипсин (триптаза) — продукт выделения поджелудочной железы, действует в слабощелочной среде при рН = 7,8÷8,7 (рис 1), где белок является анионом. Он представляет собой смесь расщепляющих белок ферментов, которым сопутствует ряд пептидаз.
Трипсин применяется для мягчения кожевенного голья. На необработанный коллаген дермы трипсин действует слабо, но после обработки коллагена пепсином, кислотами, щелочами, в особенности известью, действие его, выражающееся преимущественно в разрыхлении структуры коллагена, усиливается.
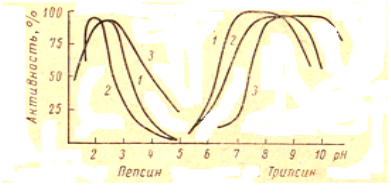
Рис. 1. Влияние рН на активность пепсина и трипсина: желатин; 2 — казеин; 3- гемоглобин
Обработка трипсином использовалась для мягчения тонких шкур. В этом случае исключается процесс мездрения, поскольку разрыхление подкожных мускульных слоев достигается путем ферментативного воздействия.
Пепсин — фермент, выделяемый стенками желудка, действует на белки в кислой среде, разрушая их до пептонов.
Изоэлектрическая точка для пепсина соответствует значению рН = 2,2÷2,7.
Пепсин вызывает растворение коллагена, ослабляет прочность шкуры. Наблюдается расщепление пепсином коркового слоя волоса.
Тканевые и растительные ферменты, а также ферменты дрожжей являются как бы переходными между трипсином и пепсином, но они обладают рядом характерных особенностей. К этим ферментам относится катепсин селезенки, печени; из растительных ферментов может быть отмечен папаин, получаемый из сока дынного дерева.
Ферменты группы папаина — катепсина вырабатываются некоторыми культурами дрожжей и плесеней; они обнаружены также в семенах растений (овса, пшеницы, ячменя, фасоли, сои и др.). Некоторые из них, например получаемые из культуры aspergillusoryzae, используются при обработке кож в качестве мягчителя; они были проверены и при обработке меховых шкур.
Оптимальные условия действия ферментов этой группы — слабокислая среда при рН=5÷6 (рис 2), т. е. вблизи изоэлектрической точки белка. С повышением температуры до 500С активность фермента возрастает.
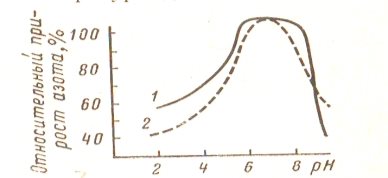
Рис. 2. Влияние рН на активность ферментов овса, определяемую методом формольного титрования (по И. П. Стефановичу): 1 — коллаген; 2 — желатин
Активность этих ферментов изменяется также при добавлении восстановителей или окислителей. Активирование достигается сероводородом, цистеином, синильной кислотой, закисным железом. Это связано с восстановительной способностью указанных соединений и заключается в восстановлении группы — S — S — фермента, с переводом ее в активную форму — SH.
Тормозит действие ферментов присутствие окислителей и соединений тяжелых металлов.
Одновременно с постепенным накоплением в растворе продуктов глубокого распада белка, оцениваемых, например, методом формольного титрования, наблюдается также дезагрегирующее действие. В этом случае образующиеся продукты распада способны диффундировать через мембраны, непроницаемые для нативных белков, и дают положительную биуретовую реакцию. Дезагрегация не сопровождается увеличением в растворе продуктов глубокого распада белка. Такое действие протеолитических ферментов в известной мере подобно разжижающему и осахаривающему действию амилазы (рис 3).
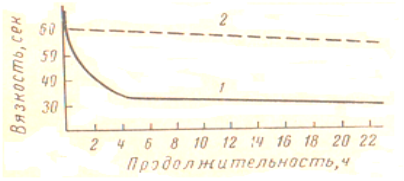
Рис. 3. Зависимость разжижения желатина ферментами овса от времени (по И. П. Стефановичу): 1 — ферментативное действие; 2 — глухой опыт
Изменения физических и коллоидных свойств белкового вещества (вязкости, суммарного объема реагирующей системы и т. п.) происходят в короткий срок, измеряемый десятками минут.
Явление дезагрегации и разрыхления структуры белка, в противоположность его глубокому разрушению до растворимых продуктов распада, важно для объяснения сущности процесса квашения.
Литература:
- Стефанович И. П. Технология меха, Легкая индустрия, Москва 1967.
- Аронина Ю. Н., Ефремева П. Я. Технология меха, Гизлегпром, 1963.
- Зайдес А. Л. Структура коллагена и ее изменения при обработках, Ростехиздат, 1960.
- Кавказов Ю. Л. Взаимодействие кожи с влагой, Гизлегпром, 1962.
- Михайлов А. Н. Химия дубящих веществ и процессов дубления, Гизлегпром, 1953.
- Химия и технология кожи и меха: Учебник для вузов. — 4-е изд., перераб.и доп./И. П. Страхов, И. С. Шестакова, Д. А. Куциди и др., М., Легпромбытиздат1985.







