Рак желудка занимает четвертое место по частоте заболеваемости и второе по смертности от злокачественных опухолей в мире [1]. В связи с поздним возникновением клинических симптомов, в более чем 75 % случаев лечение рака желудка возможно только в объеме паллиативной операции или химиотерапии [2]. Это диктует необходимость поиска предикторов возникновения и методов ранней диагностики рака желудка.
Многочисленные исследования показали, что одним из самых перспективных кандидатов на эту роль является аберрантная экспрессия микроРНК в тканях слизистой оболочки. МикроРНК представляют собой некодирующие рибонуклеотидные кислоты, состоящие в среднем из 22 нуклеотидов [3]. Связываясь с 3’-UTR мРНК генов-мишеней по принципу полной или частичной комплементарности, разрушают мРНК либо ингибируют ее трансляцию соответственно, за счет чего микроРНК постранскрипционно регулируют генную экспрессию. Благодаря такому механизму микроРНК участвуют в регуляции пролиферации, дифференцировки, [4, 5] и апоптоза клеток [6, 7], процессов, играющих ключевую роль в патогенезе многих заболеваний, в том числе и онкологических [8, 9], что подтверждается аберрантной экспрессией микроРНК во многих опухолях [10].
Общепринятым является положение о хроническом гастрите, вызванном Helicobacterpylori (H. pylori), как о стартовой площадке аденокарциномы желудка кишечного типа. Эта бактерия, колонизируя слизистую оболочку желудка, как напрямую [11], так и косвенно [13] (за счет хронического воспаления) вызывает нарушения в экспрессии многих микроРНК. Разнообразные исследования показали наличие аберрантной экспрессии микроРНК при раке желудка [7, 14]. В связи с вышеперечисленным и тканеспецефичным характером экспрессии микроРНК [15], описание аберрантного паттерна экспрессии при верифицированном диагнозе злокачественной опухоли важно с точки зрения понимания механизмов канцерогенеза, поиска маркеров для прогноза выживаемости, контроля возникновения рецидивов, возможного использования в качестве новых мишеней для таргетной терапии [16].
Несмотря на это, данные, отражающие экспрессию микроРНК на разных стадиях канцерогенеза и, соответственно, хронического гастрита в сравнении с таковыми при аденокарциноме желудка, остаются недостаточными.
Цель исследования — изучить паттерн экспрессии микроРНК у пациентов с хроническим гастритом и раком желудка в сравнительном аспекте, как этапов канцерогенеза, для оценки возможности использования в качестве предиктора развития рака желудка и как новой молекулярной мишени при разработке таргетной терапии.
Материалы и методы исследования.Объектами исследования были фрагменты слизистой оболочки желудков: 10 биоптатов с минимальными изменениями слизистой оболочки антрального отдела желудка подростков в возрасте 9–14 лет инфицированных H. pylori, выступающих в качестве контрольной группы и 9 биоптатов слизистой оболочки антрального отдела желудка взрослых в возрасте 40–70 лет с H. pylori-ассоциированным хроническим гастритом; 28 образцов операционного материала желудков, резецированных по поводу рака, у которых для исследования были взяты фрагменты опухоли (низкодифференцированная аденокарцинома кишечного типа) и ткань дистантной зоны, вне опухолевого роста (хронический атрофический гастрит). В каждом случае имелось информированное согласие пациентов на проведение молекулярно-генетического исследования. Проведение молекулярно-генетического исследования было одобрено локальным этическим комитетом ОмГМУ.
Фрагменты слизистой оболочки фиксировали в 10 %-ном нейтральном забуференном (рН 7,2–7,4) формалине на протяжении 12–24 часов. Проводку материала, заливку в парафин и приготовление парафиновых срезов проводили по общепринятой методике. Состояние слизистой оболочки желудка оценивали по гистологическим препаратам, окрашенным гематоксилином и эозином.
Содержание РНК определяли методом qRT-PCR в парафиновых срезах, полученных из фрагментов слизистой оболочки желудка. Среди микроРНК были выбраны те, относительно которых в литературе представлены данные, показывающих их роль в канцерогенезе желудка [17]. Определяли содержание следующих микроРНК: микроРНК-146а, микроРНК-155, микроРНК-21, микроРНК-223, микроРНК-192, микроРНК-200b, микроРНК-221, микроРНК-375. Нормализацию проводили на малую РНК U6 (РНК).
В качестве основных характеристик описательной статистики числовые данных был использован непараметрический критерий — U-критерий Манна–Уитни для 2-х независимых выборок (основные группы и группа сравнения). Критическим уровнем значимости при проверке статистических гипотез принимали р≤0,05.
Результаты исследования и их обсуждение. Отмечается гиперэкспрессия всех исследованных микроРНК в образцах хронического атрофического гастрита и рака желудка по сравнению с контрольной группой биоптатов слизистой оболочки желудков подростков, за исключением микроРНК-375, экспрессия которой при раке желудка снижена по сравнению с таковой в образцах хронического атрофического гастрита, что можно связать с ее описанной в литературе ролью онкосупрессора. Среди исследованных микроРНК наиболее показательные результаты были выявлены при анализе экспрессии микроРНК-21 (рис. 1, 2, 3) и аналогичные результаты были получены и для микроРНК-223.
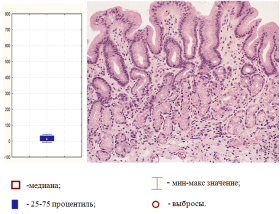
Рис. 1.Минимальные изменения слизистой оболочки желудка, ассоциированные с низким уровнем экспрессии микроРНК-21 (окраска гематоксилином-эозином, ув.100)
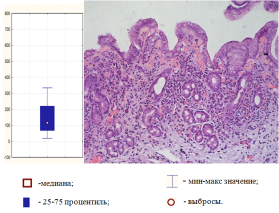
Рис. 2.Хронический атрофический гастрит, ассоциированный с промежуточным уровнем относительной экспрессии микроРНК-21 (окраска гематоксилином-эозином, ув.100)

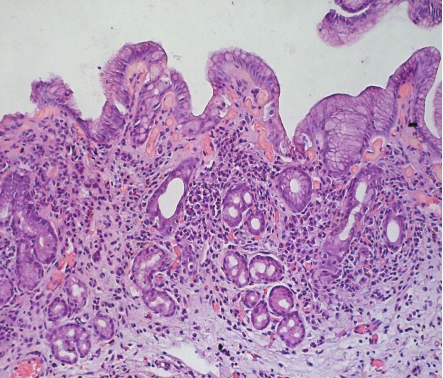
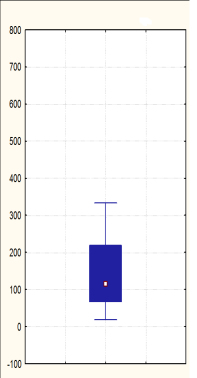
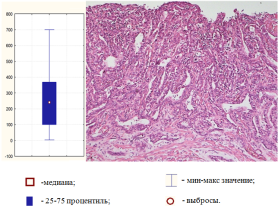
Рис. 3.Низкодифференцированная аденокарцинома желудка кишечного типа, ассоциированная с резким повышением уровня относительной экспрессии микроРНК-21 (окраска гематоксилином-эозином, ув.100)
Таким образом, значимое и последовательно нарастающее повышение экспрессии микроРНК-21, микроРНК-223 по мере малигнизации в ряду образцов хронического неатрофического и атрофического гастрита, аденокарциномы желудка кишечного типа (рис. 4), свидетельствуют о важной роли этих микроРНК в развитии рака желудка кишечного типа. Полученные данные согласуются с данными представленными в мировой литературе относительно микроРНК-21, -223, которые играют важные функциональные роли в развитии злокачественных опухолей других локализаций [8].
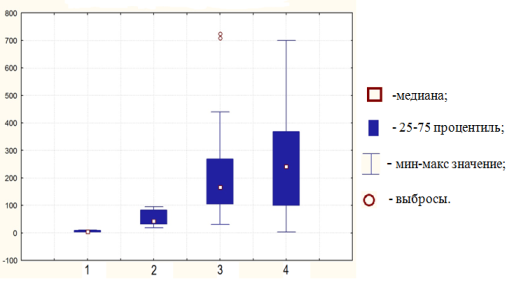
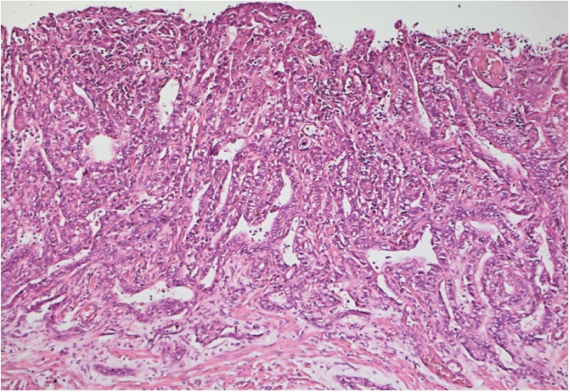 Рис. 4.Относительный уровень экспрессии микроРНК-21 в образцах тканей слизистой оболочки желудка (нормировано на количество РНК U6 в пробе). 1 — минимальные изменения слизистой оболочки желудка подростков, 2 — H. pylori-ассоциированный хронический гастрит, 3 — дистантная зона (вне опухолевого роста — хронический гастрит с атрофией желез), 4 — аденокарцинома кишечного типа
Рис. 4.Относительный уровень экспрессии микроРНК-21 в образцах тканей слизистой оболочки желудка (нормировано на количество РНК U6 в пробе). 1 — минимальные изменения слизистой оболочки желудка подростков, 2 — H. pylori-ассоциированный хронический гастрит, 3 — дистантная зона (вне опухолевого роста — хронический гастрит с атрофией желез), 4 — аденокарцинома кишечного типа
Вовлеченность в канцерогенез микроРНК-21, -223 происходит за счет контроля многих генов, основные из которых и биологические эффекты, связанные с их подавлением при гиперэкспрессией микроРНК, представлены в табл. 1.
Таблица 1
Гены мишени ибиологические эффекты микроРНК-21 имикроРНК-223
|
МикроРНК |
Гены мишени микроРНК |
Эффект на биологический процесс |
|
Регуляция клеточного цикла |
||
|
микроРНК-21 |
PTEN,RECK, TGFBR1, TGFBR2 |
Промоция клеточной пролиферации, миграции и инвазии, ингибирование апоптоза |
|
микроРНК-223 |
EPB41L3, E2F1, FOXO1 and NFI-A |
Промоция клеточной пролиферации, миграции и инвазии |
|
Регуляция воспаления |
||
|
микроРНК-21 |
IL1, IL13 |
Иммунный ответ |
|
микроРНК-223 |
IL6, IL1B |
Иммунный ответ |
В ходе исследований были выявлены более высокие уровни экспрессии микроРНК-21, микроРНК-223 в фрагментах, полученных из дистантной зоны желудков (гистологически — хронический атрофический гастрит), резецированных по поводу аденокарциномы кишечного типа, чем в образцах с аналогичной гистологической картиной, но без ассоциации с раком желудка. В тоже время, статистически значимых отличий между экспрессией этих микроРНК в парах аденокарцинома желудка — хронический атрофический гастрит в дистантной зоне резецированного желудка не обнаружено (р>0,05). Также уровень экспрессии микроРНК может быть использован в качестве контроля эффективности при разработки экспериментальных химотерапевтических препаратов [18].
Полученные данные, возможно, рассматривать как подтверждение теории опухолевого поля и метахронного рака, с мультифокальной инициацией, последующей спонтанной промоцией и прогрессией в одном из этих участков, при сохранении аберраций, в том числе и паттерна экспрессии микроРНК в остальных участках.
Выводы. Уровень экспрессии онкогенных микроРНК-21, -223 значимо и последовательно повышается в ряду от хронического неатофического гастрита до аденокарциномы желудка кишечного типа, что отражает важную роль этих микроРНК в процессе канцерогенеза рака желудка. МикроРНК-21 и -223 могут быть использованы как биомаркеры для прогнозирования риска развития аденокарциномы желудка.
Литература:
- Jemal A. [et al.] Global cancer statistics // CA Cancer J Clin. — 2011. — № 61. — C. 69–90.
- Fletcher C. D. M. Diagnostic histopathology of tumors. — 4th ed. — Ph: Elsevier, 2013. — 2296 c.
- Ambros V. [et al.] A uniform system for microRNA annotation // RNA — 2003. — № 9. — С. 277–279.
- Kawasaki H., Taira K. Hes1 is a target of microRNA-23 during retinoic-acid-induced neuronal differentiation of NT2 cells // Nature — 2003. — № 423. — С. 838–842.
- Wang Y. S. [et al.] Role of miR-145 in cardiac myofibroblast differentiation // MolecularandCellular Cardiology — 2014. — № 66. — С. 94–105.
- Brennecke J. et al. Bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila // Cell — 2003. — № 113. — С. 25–36.
- Zhang Z. [et al.] miR-21 plays a pivotal role in gastric cancer pathogenesis and progression // Laboratory investigation — 2008. — № 88. — С. 1358–1366.
- Nikitina E. G., Urazova L.N, Stegny V. N. MicroRNAs and human cancer // Experimental oncology -2012. — № 34. — С. 2–8.
- Farazi T. A. [et al.] MicroRNAs in Human Cancer // Advances in experimental medicine and biology — 2013. — № 774. — С. 1–20.
- Esquela-Kerscher A., Slack F.J. Oncomirs — microRNAs with a role in cancer // Nature reviews. Cancer — 2006. — № 6. — С. 259–269.
- Zhu Y. [et al.] MicroRNAs up-regulated by CagA of Helicobacter pylori induce intestinal metaplasia of gastric epithelial cells // PLoS One — 2012. — № 7. — С. 135–147.
- Feng Y. [et al.] FoxM1 is overexpressed in Helicobacter pylori-induced gastric carcinogenesis and is negatively regulated by miR-370// Molecular cancer research — 2013. — № 11. — С. 834–844.
- Liu X. [et al.] miR-23a targets interferon regulatory factor 1 and modulates cellular proliferation and paclitaxel-induced apoptosis in gastric adenocarcinoma cells // PLoS One — 2013. — № 9. — С. 647–660.
- Baud J. [et al.] Helicobacter pylori initiates a mesenchymal transition through ZEB1 in gastric epithelial cells // PLoSOne — 2013. — № 8. — С. 603–615.
- Lu J. et al. MicroRNA expression profiles classify human cancers // Nature — 2005. — № 435. — С. 834–835.
- Hackl M. [et al]. miR‐17, miR‐19b, miR‐20a, and miR‐106a are down‐regulated in human aging // Aging cell — 2010. — № 9. — С. 291–296.
- Shrestha S. [et al.] A systematic review of microRNA expression profiling studies in human gastric cancer // Cancer Medicine — 2014. — № 9. — С. 878–888.
- Mohammadian F. [et al.] Down regulation of miR-18a, miR-21 and miR-221 genes in gastric cancer cell line by chrysin-loaded PLGA-PEG nanoparticles // Artificial cells, nanomedicine, and biotechnology — 2016. — № 15. — С. 1–7.







