В данной серии опытов нами исследовано состояние ПОЛ и активность ферментов АОС в печени, тимусе, селезенке экспериментальных крыс, получавших ксенобиотики.
Важным фактором в патогенезе поражений органов являются изменения, возникающие в структуре и функции органов, усиление интенсивности ПОЛ непредельных жирных кислот ФЛ с образованием токсических метаболитов, которые приводят к повреждению биологических мембран [1, 2,3].
Гидроперекиси, диеновые кетоны, диеновые коньюгаты, малоновый диальдегид являются метаболитами, обладающими цитотоксичностью [4, 62, 5, 6].
В связи с этим представляет интерес изучение состояния окисления липидов в печени и в органах иммунной системы, где происходит метаболизм ксенобиотиков и выработка иммунных тел.
Результаты проведенных исследований показали, что в процессе интоксикации гепатотропными ксенобиотиками происходит усиление интенсивности ПОЛ (рис.1.) не только в печени, но и в органах иммунной системы. Так, в тимусе крыс, получавших гелиотрин на 50-ый день опыта, содержание МДА по сравнению с контролем повышалось в 5 раз, в селезенке- 4,5 раза, в сыворотке крови — в 6 раз, а в печени в 9,5раз. На 70-й день исследования происходило постепенное снижение содержания МДА в исследуемых объектах, кроме сыворотки крови. У крыс, получавших ССl4, также наблюдалось увеличение количества МДА во всех исследуемых органах и в сыворотке крови. Но в данном случае эти показатели были гораздо больше и составляли: на 50-й день количество МДА в тимусе увеличилось в 8,4, в селезенке в 5,2 раза, в сыворотке крови в 6,3раза, а в печени в 14,6 раза. На 70-й день эти показатели продолжали нарастать и составили в тимусе в 13, а в селезенке в 6,3 раза, в сыворотке крови в 7,5 раза, а в печени в 17,4раза.
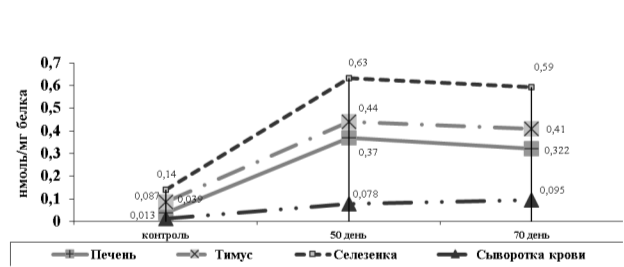
Рис. 1. Изменение содержания МДА у крыс при интоксикации гелиотрином
Наибольшее содержание МДА выявлено в печени, что, вероятно, объясняется метаболизмом в ней гелиотрина и CCl4 (табл.1.).
Таблица 1
Содержание МДА (нмоль/мг белка) в органах крыс при введении ССl4n=8–10
|
Исследуемые материалы |
Контроль M±m |
Дни исследований |
|
|
50-й M±m |
70-й M±m |
||
|
Печень |
0,039±0,003 |
0,570±0,038* |
0,682±0,029* |
|
Тимус |
0,087±0,003 |
0,312±0,095* |
0,483±0,034* |
|
Селезенка |
0,142±0,03 |
0,724±0,016* |
0,895±0,050* |
|
Сыворотка крови |
0,013±0,001 |
0,082±0,018** |
0,098±0,013* |
|
Примечания: *Р < 0,001 рассчитано по сравнению с контролем. **Р < 0,01 рассчитано по сравнению с контролем. |
|||
Реакционно-способные пирролы, которые образуются из гелиотрина и CCl4 активно блокируют сульфгидрильные группы микросомальных ферментов и ферментов окислительного фосфорилирования в митохондриях. Все это приводит к усилению ПОЛ, нарушению энергетического обмена в клетках, повреждению биологических мембран, цитолизу клеток.
Одновременно с усилением ПОЛ, происходило снижение активности ферментов АОС — каталазы и СОД (рис. 2.). Активность СОД в тимусе крыс получавших гелиотрин на 50-й день опыта была снижена на 26 %, селезенке — на 26,3 %, в сыворотке крови на 26,8 %, а в печени на 35,6 %.
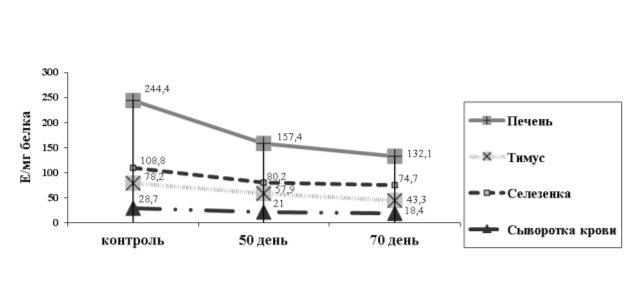
Рис. 2.Изменение активности СОД у крыс при интоксикации гелиотрином
По мере прогрессирования патологического процесса (на 70-й) активность СОД продолжала снижаться в тимусе — на 44,6 %, в селезенке на 31,6 %, в сыворотке крови на 35,9 %, а в печени на 46 %.
Параллельно с показателями СОД снижалась и активность каталазы (рис 3). Этот процесс наиболее выражен в печени и тимусе.
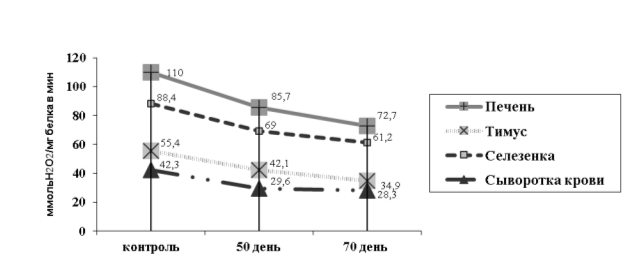
Рис. 3. Изменение активности каталазы у крыс при интоксикации гелиотрином
При интоксикации крыс четыреххлористым углеродом (табл. 2)также наблюдается уменьшение активности СОД и каталазы. Так активность СОД в в тимусе уменьшалась на 50-й день на 27 а на 70-й день 49 %, в селезенке на 27,5 и 60 %, в сыворотке крови на 23 и 47 % и в печени 30,2 % и на 64 %, соответственно по мере прогрессирования патологического процесса.
Параллельно со снижением активности СОД, также снижается и активность каталазы.
Как, видно, из полученных результатов исследования при интоксикации крыс гепатотропными ксенобиотиками независимо от этиопатогенетических факторов и формы течения патологического процесса происходит усиление ПОЛ как в органах иммунной системы, так и в печени. Причем, интенсивность ПОЛ усиливается на фоне снижения активности ферментов АОС. Возможно, активность ферментов СОД и каталазы ингибируется высокими концентрациями промежуточных и конечных продуктов ПОЛ, вследствие изменения рН среды. Выраженность этих изменений находится в прямой зависимости от прогрессирования патологического процесса.
Таблица 2
Активности СОД (Е/мг белка) икаталазы (ммольН2О2/мг белка вмин) в органах крыс при введении CCl4 (n=6–8)
|
Исследуемые материалы |
Контроль M±m |
Дни исследований |
|
|
50-й M±m |
70-й M±m |
||
|
Печень |
244±18,2 110,0±5,9 |
170,2±6,7* 88,9±4,4** |
87,9±4,9* 64,2±3,5* |
|
Тимус |
78,2±6,7 55,4±4,9 |
57,1±3,3** 38,3±2,3** |
38,3±2,2* 28,3±2** |
|
Селезенка |
108,8±19,2* 88,4±7,4 |
78,9±4,38** 66,8±3,6*** |
43,6±2,2* 45,5±3,02** |
|
Сыворотка крови |
28,7±2,1 42,3±3,2 |
22,1±1,6*** 30,9±2,6*** |
15,2±1,2** 22,0±2,02* |
|
Примечания: В числителе показатели активности СОД, а в знаменателе каталазы. *р< 0,001, **р<0,01, ***р<0,05 рассчитано по сравнению с контролем. |
|||
Следует также отметить, что характер действия гепатотропных ядов на организм имеет свои особенности. Если алкалоид гелиотрина приводил к усилению ПОЛ в исследуемых органах в 4,5–9,5 раз, то ССl4 в 6 -17 раз по сравнению с контролем, что свидетельствует о более сильном влиянии ССl4.
Таким образом, на основании проведенных исследований состояния оксидантной и антиоксидантной системы мембран иммунокомпетентных органов и печени, можно придти к выводу, что гепатотропные ксенобиотики приводят к усилению ПОЛ, снижению активности ферментов АОС в мембранах исследуемых органов. Это приводит к образованию высокотоксичных метаболитов, способствующих повреждению биологических мембран, повышению их проницаемости и выходу содержимых ферментов из клеток и их органелл во внеклеточную жидкость.
В связи с вышеизложенным, нам представлялось интересным изучить в сыворотке крови и в гомогенатах органов активность ключевых ферментов гликолиза, которые локализованы в цитозоле и в митохондриях клеток исследуемых органов.
Литература:
- Абдусаматов А. Состояние ПОЛ ткани печени крыс при отравлении гелиотрином и их коррекция координационными соединениями кобальта. //Узб. биол. журнал. — 1998. — № 1. — С.3–6.
- Блюгер А. Ф., Лабановская Ж. Л. Обмен липидов при хронических поражениях печени //Изменение липидного обмена при патологии внутренних органов. — Серия «Экспериментальная медицина». — Рига: Зинатне. — 1987. — 23. — С.17–20.
- Владимиров Ю. А., Арчаков А. И. Перекисное окисление липидов в биологических мембранах /М.: Изд-во Наука. — 1972. — С.43.
- Владимиров Ю. А., Арчаков А. И. Перекисное окисление липидов в биологических мембранах /М.: Изд-во Наука. — 1972. — С.43.
- 61 Зиямутдинова З. К., Тургунова Х. З., Талимбекова Г. З. Содержание малонового диальдегида и состояние антиоксидантной системы в органах крыс с патологий печени //Тиббиёт фани ва соглик. саклаш. долзарб. масала. буйича илмий тек. багиш. йиллик илмий анжуман. Тезислари. Тошкент. — 1995. 182 б.
- 62.Зиямутдинова З. К., Холмухамедова Н. М. Изменение процессов перекисного окисления липидов и содержания индивидуальных ганглиозидов, фосфолипидов в печени крыс с токсическим экспериментальным гепатитом //Ж.Вопр.мед.химии. — 1991. № 5. С.16–18.
- 64 Иванов И. И. Эстафетные механизмы в процессах перекисного окисления липидов биологических мембран //Успехи. биолог. химии. — 1984. — Т.25. — Вып.5. — С.110–122.
- 73 Каримов Х. Я. Нарушение процессов липопероксидаций и активности АОС в слизистом кишечнике при остром токсическом гепатите.//Пробл. биол. и мед. 1997 № 2 с.18.
- Москвичев Д. В. Свободнорадикальные процессы и состояние биомембран при действиипиретроидныхпестицидов в тканях белыхкрыси в модельных системах: Дис..канд. биол. наук. Ростов-на-Дону, 2000.-146 с.
- Ada А. О., Coban Т., Kapucuoglu N., Aydin A., Isimer A. The responses of rat testicular CYP and GST enzymes to Cd & Ni // Toxicol. Lett.-2001.-123, прил. 1, P. 48.
- Ahmed R. S., Banerjee B. D., Seth. V. Protective effect of dietary zingiber officinales rose (ginger) against lindane induced lipid peroxidation and alteration of free radical scavengers in rats // Toxicol. Lett.-2001.-123, прил. 1, P. 134.
- Sen Alaattin, Tin Yasemin, Arslan Savas. In vivo effects of metallic environmental pollutants and detergents on hepatic GST activities of leeping mullet (Liza saliens) // Drug Metabol. Rev.-2001.-33, suppl. № l.-p.l29.
- Shimada Hiroki, Fumuro Hidenori, Hirai Kei-Ichi, Koyama Junko, Ariyama Jun, Simamura Eriko. Paraquat detoxicative system in the mouse liver postmitochondrial fraction // Arch. Biochem. and Biophys. 2002. — 402, № 1. -p.149–157.







