Для решения поставленной задачи применяли адсорбционно-калориметрический метод исследования, дающий непосредственно количественную и качественную характеристики природы и сил адсорбционного взаимодействия.
Адсорбционные измерения и дозировку адсорбата проводили с помощью универсальной адсорбционной установки, в рабочей части которой использовались исключительно ртутные затворы, заменяющие краны со смазкой. Установка позволяет осуществлять дозировку адсорбата как газо-объемным, так и объемно-жидкостным методами.
Теплоты адсорбции измеряли дифференциальным микрокалориметром ДАК-1–1, записывающим в функции времени тепловые мощности медленно протекающих процессов. Дифференциальные теплоты адсорбции оценивалась точностью от 1 до 3 %.
Обменные катионы играют главную роль в адсорбции воды и других малых полярных молекул на цеолитах. Энергетически однородные центры (катионы) в однотипных кристаллографических позициях определяются с помощью измерения дифференциальных теплота адсорбции таких пробных молекул как вода, метанол и аммиак [1]. Чистокремнеземные цеолиты, такие как силикалит, показывают гидрофобность, т. е. адсорбция воды на этих цеолитах очень мала [2].
Начальная теплота адсорбции паров воды на CsZSM-5 (без учета адсорбции на примерном центре) равна 61,5 кДж/моль (рис.1). Количество сильно адсорбированной воды соответствует схеме 2Н2О:Cs+. Теплота линейно снижается до 49 кДж/моль. Адсорбция последующих трех молекул протекает с постоянной теплотой 49 кДж/моль. Образуя ступеньку, адсорбция шестой молекулы воды сопровождается понижением теплоты до уровня конденсации 43,5 кДж/моль. Еще одна молекула воды адсорбируется с теплотой, равной теплоте конденсации.
Комплексы Cs+ с шестью молекулами воды располагаются в перекрестьях прямых и зигзагообразных каналов. Полная адсорбция составляет 7 молекул воды в пересчете на катион.
Изотерма адсорбции воды (рис.2) на CsZSM-5 вогнутая при низких давлениях, что указывает на существование сильновзаимодействующих адсорбционных центров. Далее изотерма круто поднимается вверх при больших давлениях и она доведена до 7,38 N/M при P/Ps=0,68. Изотерма адсорбции воды на CsZSM-5 полностью описывается трехчленным уравнением ТОЗМ [3]:
a=0,851exp [-(A/18,22)2]+1,63exp [-(A/6,3)2]+1,748exp [-(A/2,094)2]
где а — величины адсорбции в ммоль/г, А=RTlnPs/P — работа адсорбции в кДж/моль.
Параметры с индексами 1, 2 и 3 являются характеристиками взаимодействия на катионах. Параметры с индексом 1 характеризуют адсорбцию молекулы воды при сильном взаимодействии на катионах, с индексом 2 — при менее сильном взаимодействии на катионах, а с индексом 3 — при слабом взаимодействии на катионах.
На рис.2 представлена соответствующая изотерма адсорбции воды на цеолите CsZSM-5 в полулогарифмических координатах, где — экспериментальные точки, а — рассчитанные на основе уравнения ТОЗМ. Из рис.2 видно, что расчетные данные хорошо согласуются с экспериментальными.
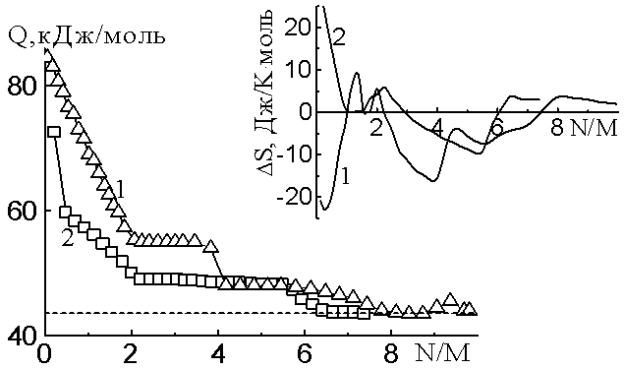
Рис.1. Дифференциальные теплоты и нтропии (вверху) адсорбции воды а цеолитах: 1-LiZSM-5, 2-CsZSM-5
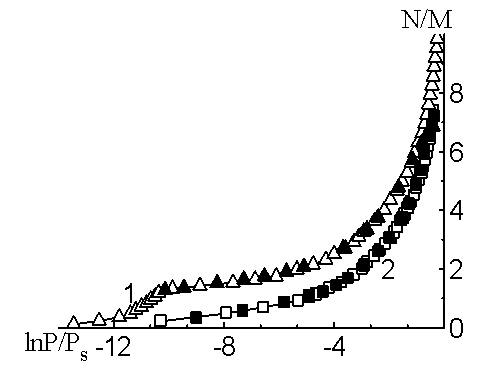
Рис. 2. Изотермы адсорбции воды на цеолитах: 1-LiZSM-5, 2-CsZSM-5
Энтропия (рис.1) адсорбции воды линейно снижается с максимального значения (25 Дж/Кмоль) до нулевой линии, которая принята за энтропию жидкой воды при адсорбции одна молекула воды на Cs+. Далее энтропия волнообразно меняется. В целом подвижность молекул воды, ассоциированных с катионами Cs+, близка к подвижности жидкой воды.
Время установления адсорбционного равновесия до полного формирования молекула/катион комплекса в соотношении Н2О:Cs+-1:1 замедлено. В целом процесс адсорбции завершается примерно за 50 минут. Исключением является область, где формируется четырехмерный комплекс, когда наблюдается замедление процесса адсорбции и кривая проходит через максимум.
Начальные теплоты адсорбции воды на LiZSM-5 около 86 кДж/моль (рис.1). Количество сильно адсорбированной воды соответствует схеме 2Н2О:Li+. Линейное падение теплот указывает на извлечение водой катионов лития из их экранированной позиции за пределами основных каналов. Адсорбция третьей и четвертой молекулы идет с постоянной теплотой 55 кДж/моль, которая при завершении резко падает до 49 кДж/моль. Эти две молекулы воды завершают образование тетраэдрического ион-дипольного комплекса.
Такой комплекс локализуется в перекрестьях прямых и зигзагообразных каналов. Потом идет заполнение второй координационной сферы. Еще 4 молекулы адсорбируются с теплотой, превышающей теплоту конденсации. Дальнейшая адсорбция идет уже с теплотой, равной теплоте конденсации, демонстрируя адсорбцию воды на предадсорбированной воде посредством водородной связи. Полная адсорбция составляет 10 молекул воды в пересчете на катион.
Изотерма адсорбции воды на LiZSM-5 доведена до 10 N/M при P/Ps=0,8 (рис.2). В соответствии с дифференциальными теплотами адсорбции область прочной адсорбции отмечена линейным подъемом кривой. При дальнейшей адсорбции изотерма вогнутая, а затем линейно поднимается до насыщения. Полная адсорбция составляет около 2,8 молекул на одно перекрестье каналов.
Изотерма адсорбции также подтверждает формирование высоко энергетического одномерного комплекса. Изотерма адсорбции воды на LiZSM-5 удовлетворительно описывается трехчленным уравнением ТОЗМ при заполнениях от двух до семи молекул/катион:
a=1,203exp [-(A/36,65)2]+1,531exp [-(A/8,26)2]+1,333exp [-(A/3,77)2]
где а — величины адсорбции в ммоль/г, А=RTlnPs/P — работа адсорбции в кДж/моль.
Энтропия адсорбции воды на LiZSM-5 в целом расположена ниже энтропии жидкой воды, что указывает на ограничение подвижности молекул воды в цеолите. Sа имеет отрицательное значение за исключением начальной области до одной молекулы воды на катион, что указывает на сильное взаимодействие H2O на Li+.
Интересен ход кривой зависимости времени установления адсорбционного равновесия от заполнения. До соотношения 1 N/M процесс установления равновесия замедляется. При более высоких заполнениях резко ускоряется. Этот факт указывает на диффузию катионов в решетке цеолита, что приводит к такому резкому замедлению процесса сорбции. Ступеньки при адсорбции 4 N/M и 8 N/M коррелируют со ступеньками на кривых дифференциальных теплота при тех же заполнениях и подтверждают образование тетраэдрического ион-дипольного комплекса в первой координационной сфере и адсорбцию четырех молекул воды во второй координационной сфере.
Литература:
- Rakhmatkariev G. U., Isirikyan A. A. Crustallochemical structure of zeolite micropores and adsorption-energetical characteristics //Studies in Surface Science and Catalysis. –1991. -v.62. -P.525–529.
- Flanigen E. M., Bennet J. M., Grose R. W., Cohen J. P., Patton R. L., Kirdiner R. M. Silicalite a new hydrophobic crystalline silics molecular sieve //Nature. -1978. -v.271. -P.512–516.
- Рахматкариев Г. У., Исирикян А. А. Полное описание изотермы адсорбции уравнениями теории объемного заполнения микропор //Изв.АН СССР, Сер.хим. -1988. -№ 11. -С.2644–2645.







