Проблема борьбы с коррозией оборудования и трубопроводов является весьма актуальной для нефтегазодобывающей промышленности. Интенсивная коррозия оборудования и трубопроводов снижает срок их службы и приводит к порывам труб, сопровождающимся загрязнениями окружающей среды и большими потерями нефти, надежность оборудования нефтепромыслов в значительной мере определяется эффективностью защиты их от коррозии.
Среди различных методов борьбы с коррозией нефтепромыслового оборудования и трубопроводов ведущее место в настоящее время и на ближайшую перспективу принадлежит ингибиторной защите, как не требующей значительных капитальных вложений и серьёзной перестройки технологии добычи, сбора и подготовки нефти. [1]
В данной работе изучено влияние новых синтетических азотсодержащих органических молекул на коррозионно-электрохимическое поведение стали в агрессивной сероводородсодержащей среде. Объекты исследования в данной работе – это азот - и кислородсодержащие органические соединения, синтезированные на кафедре органической химии и химии природных соединений химического факультета КазНУ им. аль-Фараби. Эти вещества, синтезированные на базе доступного сырья и по простой технологии, являются промежуточными продуктами синтеза новых биологически активных веществ. Все эти вещества ранее не были испытаны на ингибирующую активность. Несмотря на широкое применение высших аминов, амидов, имидозолинов и других малорастворимых в воде соединений в качестве ингибиторов сероводородной коррозии в двухфазных системах, часто разумнее использовать водорастворимые ингибиторы, которые, мало растворяясь в углеводородной фазе, расходовались бы более экономно и по назначению. Исследованные в работе вещества были водорастворимы и представлены в виде гидрохлоридов.
Выбор исследованных соединений обусловлен в первую очередь наличием в их молекулах определенных реакционноспособных центров, главными из которых являются гетероатомы азота и кислорода.
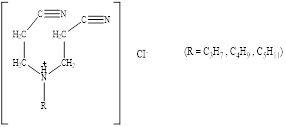
В процессе эксперимента было изучено 4 соединения: (моноцианоэтил)-(карбококсиалкил)амин и 3 дицианоалкиламина с различными радикалами.
1. 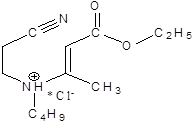 2.
2. 
Коррозионной средой служил 3% раствор NaCl и 3% раствор NaCl, насыщенный H2S (0,8 г/л). Это модельная среда (NACE) содержит сильные активаторы коррозионного процесса. В растворе хлорида натрия данной концентрации наблюдается его максимальная активность. Растворимость кислорода в воде непрерывно понижается по мере повышения концентрации NaCl. [2]
Для проверки защитной способности ингибиторов коррозии согласно требований ГОСТ 9.506 использовали два независимых метода исследований: электрохимический и гравиметрический. Первый метод основан на измерении потери массы образцов-свидетелей после выдержки в агрессивной среде, а второй – на измерении мгновенных токов коррозии при малых величинах поляризации контрольных электродов. Такой подход, основанный на двух независимых методах оценки скорости коррозии, позволяет получать более объективную информацию о поведении ингибиторов в растворе. [3]
Предварительная оценка защитных свойств исследованных соединений проводилась нами гравиметрическим методом. Оценку эффективности в этом методе проводят по потере массы металла в единицу времени с единицы поверхности. В этом случае эффективность защиты оценивают коэффициентом торможения, показывающим во сколько раз ингибитор, замедляет скорость коррозии, или степенью защиты, характеризующей полноту защиты [4]. В таблице представлены значения степени защиты исследуемых соединений, найденные методом гравиметрии. Данные приведены только для соединения 1, т.к. остальные вещества не проявляют защитного эффекта, и даже ускоряют процесс коррозии стали.
Таблица 1 - Результаты гравиметрических измерений защитного действия в растворе 3% NaCl + 0.8 г/л H2S
|
Инг |
Z, % при Синг, моль/л |
|||
|
1*10-5 |
1*10-4 |
1*10-3 |
1*10-2 |
|
|
1 |
24.6 |
48.5 |
78.2 |
98.2 |
Оценку эффективности ингибитора можно проводить по поляризационным кривым, отражающим изменения в ходе протекания коррозионного процесса в присутствии ингибитора. Обычно поляризационные кривые, характеризующие парциальные коррозионные процессы представляют в виде полулогарифмических зависимостей.
Для определения скорости коррозии стали в сероводородсодержащих ингибированных и неингибированных средах в работе использован метод снятия поляризационных кривых на вращающемся дисковом стальном электроде [5].
На рисунках 1-3 представлены потенциодинамические кривые для соединений 1 и 2.
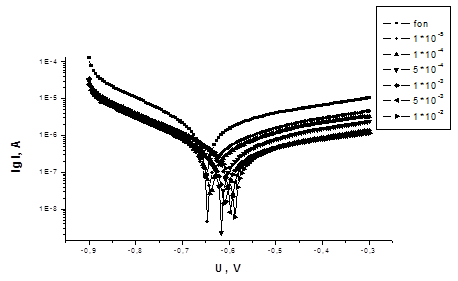
Рисунок 1 - Потенциодинамические кривые Ст3 в 3% растворе NaCl +
0,8 г/л H2S (подкисленном HAc, pH = 5) с добавками ингибитора 1
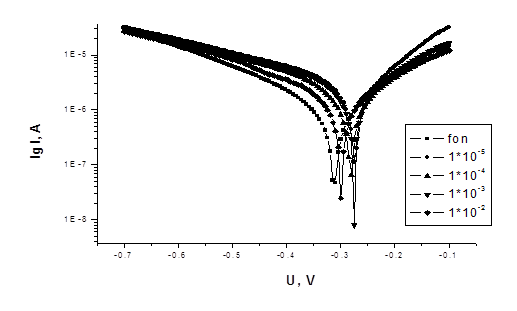
Рисунок 2 - Потенциодинамические кривые Ст3 в 3% растворе NaCl +
0,8 г/л H2S (подкисленном HAc, pH = 5) с добавками ингибитора 2
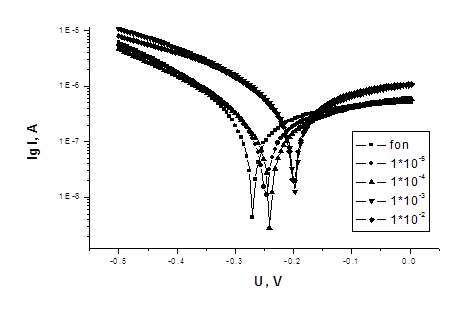
Рисунок 3 - Потенциодинамические кривые Ст3 в 3% растворе NaCl
с добавками ингибитора 2
Из потенциодинамических кривых экстраполяционным методом и альтернативным способом Агреса рассчитаны значения токов коррозии для анодной и катодной реакций коррозионного процесса и защитные эффекты по формуле:
|
Z=[(i0-iин)/i0]*100% |
(1) |
Таблица 2 - Результаты электрохимических измерений защитного действия в растворе 3% NaCl + 0.8 г/л H2S
|
3% NaCl, Синг (моль/л) |
|||||||
|
Инг |
|
1*10-5 |
1*10-4 |
5*10-4 |
1*10-3 |
5*10-3 |
1*10-2 |
|
|
Zk |
19.4 |
39.3 |
48.7 |
69.2 |
76.4 |
90.3 |
|
Za |
18.8 |
33.2 |
41.6 |
64.3 |
69.2 |
88.2 |
|
|
3% NaCl + 0.8 г/л H2S, Синг (моль/л) |
|||||||
|
Инг |
|
1*10-5 |
1*10-4 |
5*10-4 |
1*10-3 |
5*10-3 |
1*10-2 |
|
1 |
Zk |
84.5 |
82.1 |
85.9 |
96.9 |
95.8 |
77.3 |
|
Za |
95.5 |
96.9 |
98.3 |
98.9 |
98.3 |
97.9 |
|
Данные также приведены только для соединения 1 как и в случае гравиметрического метода соединения с двумя С≡N стимулируют процесс коррозии.
Установлено [6], что защитные свойства органических ингибиторов в значительной степени определяются природой адсорбции (хемосорбция, физическая или специфическая адсорбция) и показано, что наилучшими ингибиторами являются те, которые образуют хемосорбционную связь металл – атом азота.
Адсорбционное поведение выбранных соединений изучено методом снятия кривых дифференциальной ёмкости двойного электрического слоя на границе сталь – электролит.
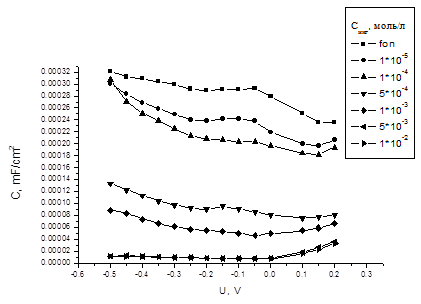
Рисунок 4 - Кривые дифференциальной ёмкости в сероводородсодержащей
среде (3% NaCl + 0.8 г/л H2S) с добавками ингибитора 1
Для соединения 1 в сероводородсодержащих растворах ингибирующие добавки вызывают значительное падение емкости двойного электрического слоя в довольно широкой области потенциалов.
Для доказательства того, что амины с двумя цианогруппами стимулируют процесс коррозии методом атомно-абсорбционной спектроскопии с помощью атомно-абсорбционного спектрофотометра (SHIMADZU, AA - 6200) было замерено количество железа, находящегося в растворе до и после электрохимических измерений.
Таблица 3 - Результаты атомно-абсорбционных измерений
|
Синг (моль/л) |
До эксперимента Fe мкг/мл |
После эксперимента Fe мкг/мл |
|
- |
0,1504 |
17,2809 |
|
1*10-5 |
0,2584 |
35,7084 |
|
1*10-4 |
0,2577 |
33,9768 |
|
1*10-3 |
0,1939 |
41,0700 |
|
1*10-2 |
0,2469 |
44,2542 |
На основании табличных данных ясно видно, что с увеличением концентрации органических соединений с двумя цианогруппами растет количество растворенного железа.
Выводы:
Высокий защитный эффект соединений, имеющих в своем составе С≡N группу, объясняется тем, что электроноакцепторная группа С≡N проявляет свойства донора электронов по отношению к металлу и, являясь главным адсорбционным центром, образует защитную плёнку. С другой стороны, наличие второй сильнополярной С≡N группы, которая имеет подвижные электронные облака, способствует тому, что она выступает в роли катодного деполяризатора при выделении водорода и может заметно стимулировать процесс коррозии, что особенно заметно при малых концентрациях. В результате, амин, имеющий две цианогруппы, в отличие от аналога, содержащего одну цианогруппу и одну сложноэфирную группу, не проявляет ингибирующих свойств. Таким образом, амин, содержащий в своём составе одну цианогруппу, может быть рекомендован как эффективный ингибитор сероводородной коррозии стали.
Литература:
1. Левашова В.И., Никонорова Н.И. Синтез и исследование свойств четвертичных аммонийных солей на основе N,N' – тетраметилдиаминометана и 4-хлор-2-пентена // Нефтехимия. – 2009. – Т.49, №3. – С. 268-271.
2. Кузнецов Ю.И. Физико-химические аспекты ингибирования коррозии металлов в водных растворах // Успехи химии. – 2004. – Т.73, № 1. – С.79-93.
3. Мельников В.Г., Муравьёва С.А., Шехтер Ю.Н., Ульяненко В.И., Юрьев В.М. Влияние строения ингибиторов аминного типа на подавление ими сероводородной коррозии // Защита металлов. – 1999. – Т.35, № 4. – С.412-417.
4. Решетников С.М. Ингибиторы кислотной коррозии металлов. – Л.: Химия, 1986. – 144с.
5. Дорохова Е.А., Буркитбаева Б.Д., Мельситова И.Б., Ахметов Т.З. Ингибирование коррозии стали в кислой и нейтральной водной среде 2-оксифенилиминодиуксусной и 2-окси-3-карбокси-1-нафтилиминодиуксусной кислотами // Вестник МН АН РК. – 1999. – № 5. – С. 35-39.
6. Антропов Л.И., Макушин Е.М., Панасенко В.Ф. Ингибиторы коррозии металлов. – Киев: Техника, 1981. – 181с.







