Рассмотрены методики кондуктометрического определения железа раствором аскорбиновой кислоты на различных по кислотно-основным свойствам фоновых электролитах и буферных смесях. Полученные экспериментальные результаты обработанные методами математической статистики, позволили определить железо(III) раствором аскорбиновый кислоты.
Кондуктометрические методы анализа по сравнению с другими методами анализа имеют следующие преимущества: они дают возможность: без больших затруднений проводить определение не только в прозрачных, но и в окрашенных и мутных растворах, а также в присутствии окислителей и восстановителей, проводить исследование не только водных, но и неводных и смешанных водно-органических средах, сравнительно легко осуществлять автоматизацию процессов титрования; во многих случаях избежать отделения примесей, обычно мешающих определению другими методами; производить дифференцированное титрование смесей электролитов, что невозможно осуществить другими методами [1].
Железо и его соединения получили широкое применение в различных отраслях техники и народного хозяйства, что обусловлено всё возрастающей ролью и масштабов его производства. Широкое применение железа в промышленности, фармацевтике и медицине, а также непосредственный контакт с ним человека определили интерес учёного мира к изучению его биологического действия [2].
Поэтому интенсивное развитие науки, техники и промышленности на современном этапе выдвигает перед химиками-аналитиками задачи по созданию новых и совершенствованию существующих методов анализа с улучшенными метрологическими характеристиками и возможностью их использования в широком интервале определяемых концентраций железа в различных по природе промышленных и биологических материалах, а также других объектах.
Одним из направлений решения вышеуказанных задач является кондуктометрия, обладающая высокой правильностью, воспроизводимостью, экспрессностью, надёжностью, широкими диапазонами определяемых концентраций металлов и простотой аппаратурного и методического оформления.
В связи с этим представляло интерес определение макро — и микрограммовых количеств железа в различных по природе модельных смесях, реальных объектах и природных материалах.
Экспериментальная часть
Методика определения железа(III). При выполнении эксперимента был использован 0,1 М раствор железа(III) для приготовления, которого брали его хлоридную соль, растворяли в воде и доводили его объем до метки бидистиллятом в мерной колбе (100 мл).
Для определения железа(III) использовали 0,1 М раствор аскорбиновый кислоты. После проведения такой предварительной подготовительной операции приступили к реализации кондуктометрической методики определения железа раствором аскорбиновой кислоты.
0,1 н. раствор аскорбиновой кислоты готовили растворением 8,85 г его в 1 л бидистиллированной воды, к которому добавлено 0,1 г комплексона (III) 0,4 мл муравьиной кислоты [3].
Используемая аппаратура, металлы, реагенты и растворы. Для титрования железа(III) раствором аскорбиновой кислоты с целью установления значений рН среды — были применены иономер универсальный ЭВ-74 и рН-метр рН/мV/ТЕМР MeterP25 EcoMet корейского производства. В работе были использованы кондуктометр КЭЛ — 1 М 2, ячейка С1–0,1009, емкостью 20,0 мл, магнитная мешалка марки М М 3 М-5065 и микробюретка первого класса точности.
Все применяемые реактивы имели квалификации «ос.ч»., «х.ч». и «ч.д.а».. Стандартные растворы железа и других применяемых в работе металлов с концентрацией 1,0 мг/дм3 готовили растворением их азотнокислых солей в бидистиллированной воде. Рабочие же растворы используемых металлов получали последовательным разбавлением их исходных крепких растворов перед началом проведения эксперимента.
Результаты иобсуждение
Кондуктометрическом титровании происходит изменение общей концентрации электролитов и соответственно электропроводность анализируемого раствора. На основе полученных при титровании данных строят график, где по оси абсцисс откладывают число миллилитров пошедшего рабочего титрующего раствора реагента, а ординат — электропроводность всей исследуемой системы. Анализируемый раствор титруют равными порциями титранта, отмечая каждый раз его электропроводность. Полученные результаты наносят на график в виде точек и затем соединяют их линиями. Тем самым получают две кривые, пересечение (экстраполяция) которых, соответствует конечной точке титрования. Возможен и другой способ определения точки эквивалентности, где прибор для измерения электропроводности исследуемого раствора соединяют с регистрирующим аппаратом (самописцем) с целью получения более воспроизводимой и непрерывной записи кривой титрования при определении концентрации компонента в анализируемой пробе в процессе проведении кондуктометрического титрования [4].
При подготовке анализируемого раствора в него вводят различные по природе и концентрации фоновых электролитов или буферных смесей, обуславливающих высокую электропроводность исследуемой системы, гашение миграционных токов, лучший массоперенос (транспорт) и другие факторы, влияющие на ход, результаты и другие физико-химические параметры кондуктометрического титрования 5,6.
Проведенные исследования показали, что характер и форма кривых кондуктометрического титрования железа с помощью аскорбиновый кислоты в анализируемых растворах, содержащих различные по природе и концентрации буферные смеси или фоновые электролиты сильно зависят от рН среды.
Полученные при выполнении эксперимента значения рН среды характерны для реакций комплексообразования железа с аскорбиновой кислотой, протекающих практически количественно, быстро и полно. Если значение этого параметра будет ниже оптимальной величины, то обратимость реакции усилится, а если выше — то она будет протекать еще полнее.
Нами установлено, что при оптимизированной слабощелочной среде (рН 8,25) достаточно хорошо определятся железо(III), образующий наиболее устойчивый комплекс с аскорбиновой кислотой, где конечная точка титрования наблюдается при молярном соотношении компонентов реакции, равном 1:1. Некоторые из полученных результатов приведены в рис. 1 и в таблице 1.
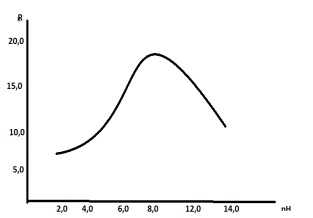
Рис. 1. Результатыкондуктометрическоготитрования 5,6 мгжелезарастворомаскорбиновыйкислотывприсутствииразличныхрНсреды (1,81–13,86) буфернойсмесиБриттона- Робинсона
Однако следует заметить, что при переходе от нейтральных в слабощелочную среду комплексообразование железа(III) и аскорбиновой кислоты улучшается, а при переходе к слабо кислой, ухудшается образование его основных комплексов, что значительно изменяет условия кондуктометрического титрования, соответственно ухудшается вид кривых, а результаты определения становятся менее точными.
Результаты табл. 1 показывают, что найденные концентрации железа(III) при кондуктометрическом титровании раствором аскорбиновой кислоты находятся в строгом соответствии с введенными его количествами. Нами также установлено, что из всех выбранных рН сред наилучшим оказалась слабощелочная среда — буфера, где при определении железа раствором аскорбиновым кислотам относительное стандартное отклонение (Sr) не более 0,019.
Таблица 1
Результаты кондуктометрического титрования 5,6 мг железа(III) раствором аскорбиновой кислоты вприсутствии различных количеств буферной смеси Бриттона- Робинсона (Р = 0,95; ![]() ± ΔХ, n-5)
± ΔХ, n-5)
|
Объем буферной смеси, мл |
pH среды |
Найдено железа(III), мг |
Воспроиз-водимость (S) |
Относительное стандартное отклонение (Sr) |
|
2,0 |
8,25 |
5,51±0,12 |
0,08 |
0,014 |
|
3,2 |
5,54±0,17 |
0,11 |
0,019 |
|
|
3,6 |
5,61±0,11 |
0,09 |
0,016 |
|
|
4,0 |
5,65±0,08 |
0,07 |
0,012 |
|
|
4,4 |
5,63±0,09 |
0,06 |
0,011 |
|
|
4,8 |
5,58±0,08 |
0,05 |
0,009 |
|
|
5,2 |
5,61±0,14 |
0,09 |
0,016 |
При кондуктометрическом титровании железа(III), раствором аскорбиновой кислоты образованы высокоустойчивые комплексы в соответствии с теоретическими предпосылками и соответствующие кривые титрования имеют наилучшие по форме изломы в точки эквивалентности при рН 7,71–8,83.
Для выявления правильности и воспроизводимости кондуктометрического титрования железа раствором аскорбиновой кислоты нами проведено титрование его различных количеств с параллельным повторением каждого определения, (не менее четырех раз) результаты которого приведены в табл. 2.
Как видно из данных таблиц, при титровании миллиграммовых содержаний железа раствором аскорбиновой кислоты получаются достаточно правильные и воспроизводимые результаты, причем во всех случаях найденные количества соответствуют его введенным концентрациям с относительным стандартным отклонением (Sr), не превышающим 0,169, что свидетельствует о высокой точности разработанной нами кондуктометрической методики.
Таблица 2
Результаты кондуктометрического титрования различных количеств железа(III) стандартным раствором аскорбиновой кислоты (Р = 0,95; ![]() ± ΔХ; Vобщ=20,0 мл)
± ΔХ; Vобщ=20,0 мл)
|
Введено железа(III), мг |
Найдено Железа(III), мг |
Число параллельных определений (n) |
Воспроиз-водимость (S) |
Относительное стандартное отклонение (Sr) |
|
0,56 |
0,53±0,11 |
5 |
0,09 |
0,169 |
|
1,12 |
1,15±0,09 |
5 |
0,11 |
0,073 |
|
2,24 |
2,25±0,09 |
4 |
0,16 |
0,064 |
|
2,80 |
2,79±0,08 |
5 |
0,17 |
0,061 |
|
3,92 |
3,96±0,08 |
5 |
0,18 |
0,045 |
|
5,60 |
5,62±0,07 |
5 |
0,22 |
0,039 |
|
9,52 |
9,54±0,06 |
5 |
0,25 |
0,026 |
С целью изучения степени селективности найдено мешающее влияние следующих катионов, результаты которых показывают, что определению железа(III) мешают Th(IV), Sc(III) и U(IV) в любых соотношениях, не мешают Na+, K+ (1:500), Mn2+(1:100), Cd2+, (1:50), Bi3+(1:2,5), Zn2+, Тi4+(1:1), Ni2+,Al3+(1:5) соотношениях. Это свидетельствует о высокой избирательности разработанной методики определения железа(III) с аскорбиновой кислотой.
Литература:
- Худякова Т. А., Крешков А. П. Кондуктометрический метод анализа. — М.: Высшая школа, 1975. — 207 с.
- Петров Ю. М., Старикова О. Б., Куртякова З. Н. Железо в морской воде. Океанология,1976, № 5, С.832–854.
- Коростелев П. П. Приготовление растворов. М. Наука, 1964, с. 194–195.
- Худякова Т. А., Крешков А. П. Теория и практика кондуктометрического и хронокондуктометрического анализа. — М.: Химия, 1976. — 304 с.
- Мешкова Л. А. Теоретические основы кондуктометрического анализа солей металлов. — Горький: Наука и техника, 1972. — 236 с.
- Золотов Ю. А., Дорохова Е. Н., Фадеева В. И., Алов Н. В., Гармаш А. В., Барбалат Ю. А. Основы аналитической химии. В 2 кн., Кн. 2. Методы химического анализа. — М.: Высшая школа, 2002. — 494 с.







