Введение. Пересадка почки является наиболее распространенным видом органной трансплантации и одним из эффективных методов лечения больных с терминальной стадией хронической почечной недостаточности (ХПН). На 2002 по Беларуси в аппарате “искусственная почка” нуждалось 1184 человека, по Витебску — 104 человека. Трансплантация почки по сравнению с лечением программным гемодиализом или перитонеальным диализом обеспечивает более полную медицинскую и социальную реабилитацию пациентов, сокращает стоимость лечения больных терминальной ХПН. Важнейшей проблемой современной трансплантологии остается профилактика инфекционных осложнений. Развитие фарминдустрии и применение современных иммунодепрессантов на фоне совершенствования методов профилактики, диагностики и лечения инфекций за последние годы значительно снизило количество осложнений инфекционной природы после проведения трансплантации органов. И не смотря на это не существует идеальных иммуносупрессантов способных обеспечить длительную функцию трансплантата без развития отторжения и при этом обеспечивать достаточный уровень резистентность организма к инфекциям. Среди причин летальности пациентов после трансплантации почки эта группа осложнений продолжает занимать одно из ведущих мест. По данным разных авторов, частота инфекционных осложнений в течение первого года после пересадки почки, приводящих к летальным исходам, составляет от 2,6 % до 51,7 % [1], а среди реципиентов старше 60 лет инфекции являются причиной смерти в 18–43 % случаев [2]. Иммуносупрессивная терапия способствует развитию вирусных инфекций в 50 % случаев [3], и лидирующую роль среди них занимает цитомегаловирусная инфекция [4]. В зарубежных публикациях широко обсуждаются основные предрасполагающие факторы развития инфекций, необходимость и длительность антибиотикопрофилактики, влияние иммунизации и сроков ее проведения на повышение резистентности организма. Так, R. de Souza и соавт. [5] считают, что лечение путем пролонгирования антибактериальной терапии ведет к росту резистентности микрофлоры. E. El Amari и соавт. считают, что следует ограничить применение антибиотиков при бессимптомной бактериурии у реципиентов почечного трансплантата [6]. По данным H. Green и соавт., длительная антибактериальная терапия снижает риск послеоперационной бактериурии на 87 % [7]. L. Linares и соавт. [8] установили наличие полирезистентной бактериальной флоры у 14 % больных, что достоверно ухудшало прогноз течения заболевания. На базе семи Канадских Центров по пересадке почки проведено двойное слепое рандомизированное исследование обоснованности приема левофлоксацина в течение 3 месяцев с целью профилактики последующей бактериемии в посттрансплантационном периоде, и доказана не только необоснованность данного предположения, но и выявлен риск развития высоко резистентных штаммов [9]. И не смотря на широкий спектр рациональных схем профилактики и лечения предлагаемых авторов, все они сходятся во мнении, что длительный курс применения антибактериальных препаратов чаще приводит к развития полирезистентных форм микроорганизмов, чем к положительным результатам.
Цель. Изучить частоту встречаемости отдельных микроорганизмов в биологических жидкостях (моче и мокроте) у пациентов после трансплантации трупной почки. Оценить резистентность микрофлоры к антибиотикам разных групп. Определить удельный вес осложнений инфекционного характере среди осложнений возникающих у пациентов после трансплантации трупной почки.
Материалы иметоды. Проведен анализ 50 историй болезни пациентов с гетеротопической трансплантацией выполненой с сентября 2015 по февраль 2017 г. Для оценки факторов риска послеоперационных осложнений и степени санации хронических очагов инфекции использовались данные микробиологического исследования мочи и мокроты. Для диагностики ранних послеоперационных осложнений и анализа высеваемой флоры использовались клинико-микробиологический методы (определение степени значимой лейкоцитурии, микроорганизмов и их чувствительности к антибактериальным препаратам), ультразвуковое исследование.
Результаты иобсуждение. За период с сентября 2015 г. по февраль 2017 г. на базе ВОКБ выполнено 50 гетеротопических аллотрансплантаций трупной почки пациентам с терминальной стадией хронической болезни почек. Среди пациентов 27 мужчин и 23 женщины. Возраст пациентов колебался от 23 до 67 лет. Основной причиной развития хронической болезни почек являлся ХГН — 23 пациента(46 %), поликистоз почек — 10 пациентов(20 %), хронический пиелонефрит — 6 пациентов (12 %), ХПН обусловленная АГ — 4 пациента (8 %), ХПН обусловленная СД — 3 пациента(8 %), ВАМС гидронефроз — 1 пациент (2 %). Как видно из данных таблицы в структуре терминальных ХБП преобладает хронический гломерулонефрит. Средний возраст пациентов составил 49,9±2,4, среднее время пребывания на диализе 26,1±4,2месяца, средняя длительность пребывания в листе ожидания 20,1±4,0 месяца, что указывает на необходимость развития трансплантологии с целью улучшения качества жизни трудоспособного населения. Среди более редких причин развития ХБН в нашем исследовании выделяют ВАМС с развитием гидронефроза почки и ХПН, нейрогенный мочевой пузырь.
|
Причины ХБН |
Количество,% от всех |
Длительность пребывания на диализе, мес |
Длительность пребывания влисте ожидания, мес |
Средний возраст, лет |
Вид ПЗТ ГД/ПД |
|
Хронический пиелонефрит |
6/12 |
35,5 |
23,3 |
55,5 |
6/0 |
|
Хронический гломерулонефрит |
23/46 |
22,6 |
20,2 |
46 |
22/1 |
|
Поликистоз |
10/20 |
29,4 |
24,7 |
54,4 |
10/0 |
|
АГ, нефросклероз |
4/8 |
11,5 |
4,8 |
51 |
4/0 |
|
Сахарный диабет |
3/6 |
31,7 |
27,7 |
43 |
3/0 |
|
Среднее значение |
23,8 |
19,35 |
48,6 |
Осложнения после трансплантации были выявлены у 32(64 %) пациентов, у 24 (48 %) пациентов исследуемой группы осложнения имели инфекционный характер. Для периоперационной антибиотикопрофилактики использовали меропенем. Индукцию иммуносупрессии проводили симулектом или АТГ (антитимоцитарный гаммаглобулин кроличий). В качестве послеоперационной иммуносупрессии применяли кортикостероиды, ингибиторы кальциневрина (циклоспорин, такролимус) и антиметаболиты (микофенолата мофитил). В предоперационном периоде с целью профилактики инфекционных осложнений в посттрансплантационном периоде санировали очаги инфекции. Проанализированы хирургические, урологические и инфекционные осложнения, а также функции трансплантированных почек в раннем послеоперационном периоде.
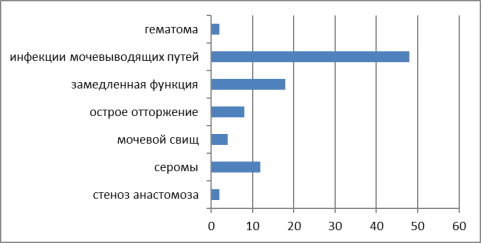
Рис. 1. Наиболее частые осложнения после трансплантации почки, %
С целью профилактики послеопрерационных осложнений при постановке в лист ожидания реципиенты были обследованы на наличие хронических очагов инфекций и при их выявлении проводилась санация. На микробиологическое исследование отправляли мокроту и мочу до трансплантации и мочу реципиентов почечного трансплантата. Инфекционные осложнения наблюдались в 24 (48 %) случаях, наиболее часто высеваемым возбудителем являлись Str. Faecium 12 (50 %), Streptococcus Faecium 8 (33 %) Pseudomonas Аeruginosa 4 (17 %), Klebsiella pneumonia 4 (17 %).
Наиболее часто высеваемые возбудители вмокроте пациентов до трансплантации ив моче реципиентов до ипосле трансплантации
|
Возбудитель |
Посев мокроты до |
Посев мочи до |
Посев мочи после |
|||
|
абс. |
% |
абс. |
% |
абс |
% |
|
|
Гр+ кокки |
3 |
17 |
2 |
18 |
||
|
Staphylococcus aureus |
4 |
22 |
||||
|
Стрептококк группы А |
2 |
11 |
||||
|
Сitrobacter freunai |
1 |
6 |
||||
|
Streptococcus pyogenes |
2 |
11 |
||||
|
Candida albicans |
6 |
33 |
||||
|
Pseudomonas aeruginosa |
2 |
11 |
1 |
9 |
4 |
17 |
|
Streptococcus faecium |
2 |
18 |
12 |
52 |
||
|
Streptococcus faecalic |
2 |
18 |
||||
|
Klebsiella pneumonia |
1 |
9 |
2 |
9 |
||
|
Staphylococcus epidermidis |
1 |
9 |
||||
|
Enterococcus faecalis |
4 |
17 |
||||
Оценивая полученные результаты следует отметить что у 1(9 % от всех пациентов с инфекционными осложнениями) реципиента было выявлено совпадение по выделенной до трансплантации и после трансплантации флоре.
Определена чувствительность 6 наиболее часто выделяемых при высокой степени бактериурии грамотрицательных и грамположительных микроорганизмов более чем к 20 антимикробным средствам — ампициллину, амоксициллину клавуланату, пиперациллину в сочетании с тазобактамом, цефазолину, цефотаксиму, цефтазидиму, цефоперазону в комбинации с сульбактамом, цефепиму, имипенему, меропенему, амикацину, нетилмицину, гентамицину, полимиксину, ципрофлоксацину, левофлоксацину, моксифлоксацину, оксациллину, ванкомицину, линезолиду, эритромицину, клиндамицину, кларитромицину, фузидину, рифампицину, а также к противогрибковым препаратам: амфотерицину, нистатину, кето- и итроконазолам, флуконазолу, клотримазолу, вариконазолу, флуцитозину.
Анализируя полученную флору было крайне важным изучить ее антибиотикорезистентность с целью поиска наиболее рациональных путей не только антибиотикотерапии но и антибиотикопрофилактики. Наиболее часто высеваемыми возбудителями у реципиентов почечного трансплантата являлись Pseudomonas aeruginosa, Streptococcuc faecium, Enterococcus faecalis, Klebsiella pneumoniae. В ходе проведенных бактериологических исследований было выявлено, что в посевах мочи после трансплантации Pseudomonas aeruginosa резистентна к амоксициллину, цефипиму, имепинему, меропинему, ципрофлоксацину, левофлоксацину, однако обладает высокой чувствительностью к колистину и средней к амикацину. Streptococcuc faecium во всех случаях обнаружения сохраняла свою чувствительность к ванкомицину, и обладала средней чувствительностью к гентамицину, линезалиду. К амикацину, офлоксацину, ципрофлоксацину а в некоторых случаях и к ванкомицину культура проявляла резистентность. Enterococcus faecalis в 100 % случаев сохраняли чувствительность к линезолиду, ванкомицину, тейкопланину, резистентность проявлялась к препаратам амикацин, левофлоксацин, норфлоксацин,офлоксацин. Klebsiella pneumoniae проявляла чувствительность к амикацину и ванкомицину, резистентность культура бактерий выработала к имипенему, меропенему,норфлоксацину, цефотаксиму, цефтриаксону, цефипиму.
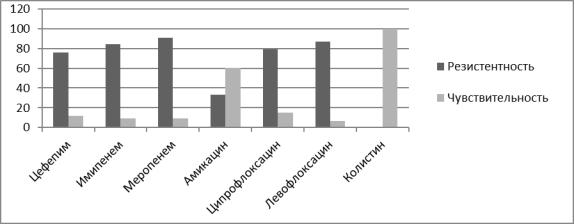
Рис. 2. Резистентность Pseudomonas aeruginosa к основным антибактериальным препаратам, %
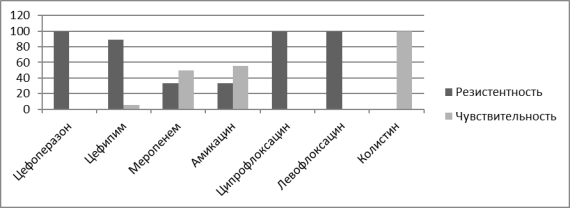
Рис. 3. Резистентность Klebsiella pneumoniae к основным антибактериальным препаратам, %
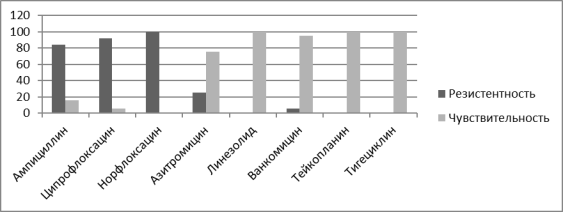
Рис. 4. Резистентность Enterococcus faecalis к основным антибактериальным препаратам, %
Частота, характер и тяжесть инфекционных осложнений во многом зависят от времени их возникновения. Большинство инфекционных осложнений приходится на ранний послеоперационный период и связано с наличием послеоперационной раны, инфекций мочевыводящих путей, пневмонии, необходимость в проведении иммуносупрессивной терапии. Чаще всего возбудителем инфекционного процесса в этот период становится характерная для этого учреждения внутрибольничная бактериальная и грибковая флора независимо от назначенной иммуносупрессивной терапии. В этом периоде так же агрессивно себя проявляют инфекции, полностью не излеченные вследствие нерациональной атибактериальной терапии. Серьезным осложнением может стать развитие суперинфекции, сепсиса, снижение функции трансплантата. Замедленная функция трансплантата в исследуемой группе являлась осложнением трансплантации в 18 %(9 человек). При выявлении значимой бактериурии антибактериальная терапия проводилась препаратами широко спектра действия, при получении данных о резистентности можно было ретроспективно оценить правильность выбора антибиотика или назначить терапию уже с учетом чувствительности микроорганизма. Наиболее часто использовался меропенем, он являлся препаратом выбора при проведении периоперационной и послеоперационной антибактериальной терапии. При проведении иммуносупрессивной терапии очень важным является сохранение баланса между сохранением противовирусной, антибактериальной и антигрибковой резистентностью организма и развитием острого отторжения трансплантата.
Выводы
Проведение исследований биологических сред (мочи и мокроты) до выполнения трансплантации с целью выявления очагов хронической инфекции снижает частоту развития инфекций в раннем послеоперационном периоде. А проведение микробиологических исследований мочи и раневого отделяемого после трансплантации и определение чувствительности флоры позволяет назначить пациенту более рациональную антибактериальную терапию, так как многие антибиотики широко спектра действия обладают выраженным нефротоксическим, что ставит под угрозу исход операции.
Наибольшая доля инфекционных осложнений приходится на инфекции мочевыводящих путей. В группу реципиентов с повышенным риском следует отнести тех, кто имеет урологические заболевания собственных почек или урологические осложнения трансплантированной почки.
При анализе бактериального спектра выявлено преобладание грампозитивной флоры с чувствительностью к ванкомицину, меропенему, линезолиду, что делает нерациональным применение препаратов эффективность, которых вызывает сомнение «незащищенные» пенициллины, тетрациклин, доксициклин, линкомицин, гентамицин.
Пролонгированное лечение антибактериальными препаратами приводит в большей степени к формированию полирезистентных микроорганизмов, повышает активность грибковой флоры, что на фоне необходимой для пациента иммуносупрессивной терапии усложняет лечение и оттягивает процесс выздоровления.
Своевременная антибиотикотерапия и применение рациональных схем иммуносупрессии позволили предотвратить летальные исходы у пациентов с гетеротопической трансплантацией трупной почки.
Литература:
- Infectious complications after kidney transplantation: current epidemiology and associated risk factors / G. J. Alangaden [et al.] // Clin Transplant. — 2006. — Vol. 20, — P. 401- 409.
- Развитие гнойно-септических осложнений на фоне иммуносупрессивной терапии у больных с аллотрансплантированной почкой / Е. П. Волынчик и др. // II Всероссийский съезд по трансплантологии. Москва, 17–19 октября. Вестник трансплантологии и искусственных органов. — 2003. — № 3. — С. 67.
- Готье, С. В. Инфекции в трансплантологии / С. В. Готье // Под редакцией С. В. Готье. М., 2010 г.
- Predictive factors of infection in the first year after kidney transplantation / P. Galindo Sacristan [et al.] // Transplant Proc. — 2013. — Vol.45. — № 10, — P. 3620–3623.
- De Souza R. M., Olsburgh J. Urinary tract infection in the renal transplant patient. Nat Clin Pract Nephrol 2008; 4: 5: 252–264.
- El Amari Е. В., Hadaya К., Buhler L. et al. Outcome of treated and untreated asymptomatic bacteriuria in renal tranaplant recipients. Nephrool Dial Transplant 2011; 26: 12: 4109–4114.
- Green H., Rahamimov R., Gafter U. et al. Antibiotic prophylaxis for urinary tract infections in renal transplant recipients a systematic review and meta-analysis. Transpl Infect Dis 2011; 13: 5: 441–447.
- Linares L., Cervera C., Cofan F. et al. Epidemiology and outcomes of multiple antibiotics-resistant bacterial infection in renal transplantation. Transplant Proc 2007; 39: 7: 2222–2224.
- Levofloxacin for BK virus prophylaxis following kidney transplantation: a randomized clinical trial / G. A. Knoll [et al.] // JAMA. — 2014. — № 26. — Vol. 312(20). — P. 2106–2114.







