Разработан эффективный метод синтеза некоторых производных тетрагидропиримидин-5-карбоксилатов на основе трёхкомпонентной конденсации различных альдегидов и β-дикетонов с тиокарбамидом в присутствии гексагидрата хлорида никеля(II). Антиоксидантные свойства синтезированных соединений исследованы в модельных реакциях кинетическим методом.
Ключевые слова: тиокарбамид, β-дикетон, антиоксидант, трёхкомпонентной конденсации, кинетическим метод
Антиоксидантные добавки используются для защиты смазочных и других материалов от окисления. В литературе последних лет встречается большое количество научно-исследовательских работ, характеризующих антиоксидантные свойства сераорганических соединений [1–7]. До сих пор в качестве объекта исследования использовались сульфиды, дитиофосфаты, ксантогенаты, различные серосодержащие гетероциклические соединения (фенотиазин, бензотиазол и др.). Антиоксидантные свойства серосодержащих пиримидинтионов впервые было изучено нами [8–10].
Принимая во внимание вышеизложенное, нами были синтезированы некоторые тетрагидропиримидинтионы и изучены их антиоксидантны свойства в реакциях окисления углеводородов. Также была исследована связь между строением вновьсинтезированных соединений и их антиоксидантными свойствами.
Схему реакции тетрагидропиримидин-5-карбоксилатов, проведенную в присутствии катализатора NiCl2.6H2O, можно представить следующим образом:
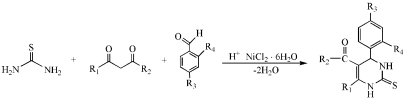 (1–3)
(1–3)
1. R1=CH3; R2=OCH3; R3=H; R4=H
2. R1=CH3; R2=OCH3; R3=H; R4=OH
3. R1=CH3; R2=OCH3; R3=H; R4=CH3
Поскольку изучение механизма антиоксидантного действия ингибиторов окисления в реальных в условиях окисления смазочных масел очень сложно, антиоксидантное действие синтезированных нами соединений исследовали в реакции окисления модельного углеводорода — кумола, механизм окисления которого довольно подробно изучено [11–12].
Изучение автоокисления кумола в присутсвии этих соединений показало, что они эффективно тормозят процесс автоокисления. На рис.1 изображены кинетические кривые окисления кумола с участием некоторых производных тиокарбамида (1–3) при температуре 110оС.
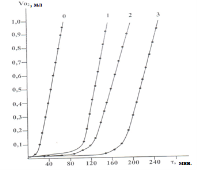
Рис. 1. Кинетические кривые автоокисления кумола в присутствии соединений (1–3), T=1100C, [InH] =0; [1–3]= 5·10–5 моль/л, VO2 — kоличество поглощенного кислорода (мл), τ — индукционный период (мин.)
С целью усановления механизма антиокислительного действия синтезированных соединений исследовали кинетику их реакции с кумилпероксидными радикалами и кумилгидропероксидом.
Для того, чтобы оценить способность тетрагидропиримидин-5-карбоксилатов (1–3) обрывать цепи окисления по реакции с кумилпероксидными радикалами, проводили инициированное азодиизобутиронитрилом [АИБН]окисление кумола при 600С, в присутвии этих ингибиторов. Во всех опытах концентрация инициатора была равна 2·10–2 моль.л, а концентрация ингибитора — 5.10–4 моль.л. Было установлено, что все изученные ингибиторы тормозят инициированное окисление кумола (рис.2).
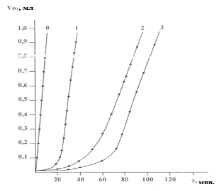
Рис. 2: Кинетические кривые инициированного окисления кумола в присутсвии иследуемых соединение (1–3), T=60ºC, [АИБН]=2·10–2 моль/л, [InH]=5·10–4 моль/л, VO2 — kоличество поглощеного кислорода (мл), τ- индукционный период (мин.)
По значению индукционного периода (τ) инициированного окисления кумола рассчитывали значение коэффициента стехиометрии — ƒ, равного числу цепей окисления, обрывающихся под воздействием одной молекулы ингибитора и продуктов его преобразования:
![]()
° [О2] ~ f(τ) зависимость
![]() - период индукции.
- период индукции.
Wi — скорость иницирования
[InH]0 — начальная концентрации ингибитора
Для определения значения к7- константы скорости взаимодействия ингибитора с кумилпероксидными радикалами, кинетические кривые инициированного окисления кумола трансформировали из корординат Δ [O2]-τ в координаты Δ [O2]-1-τ-1 и по тангенсу угла наклона прямой линии
tg![]() =
=![]()
![]()
находили
![]() =
= ![]()
![]()
где k2=1,51 моль-1.с-1, [RH]=7,17 моль-1 с-1 [8].
С целью изучения способности тетрагидропиримидин-5-карбоксилатов (1–3) разлагать кумилгидропероксид, исследовали реакцию кумилгидропероксида (KГП) с ингибиторами при 110°C в хлорбензоле (при такой температуре KГП термически стабилен). Исследования показали, что изученные ингибиторы эффективно разлагают кумилгидропероксид (рис. 3). При этом, одна молекула исследуемых ингибиторов способна разлагать несколько тысяч молекул кумилгидропероксида, то есть реакция носит каталитический характер.
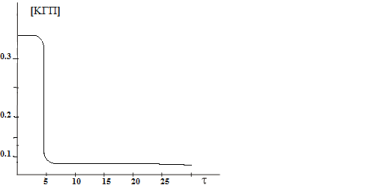
Рис. 3. Кинетическая кривая разложения кумилгидропероксида в присутсвии етил-4-(2-гидроксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидро пиримидин-5-карбоксилата (2), [KГП]=0,38 моль/л, [InH]=1.10–4 моль/л; τ- период индукции (мин.).
Как видно из рис.3, кинетические кривые разложения кумилгидропероксида в присутствии изученных с ингибиторов состоит из трёх частей — индукционный период, быстрое разложеие гидропероксида и уменьшение скорости разложения в связи с уменьшением концентрации КГП, что характерно для каталитических процессов. Можно предположить, что в начале ингибитор стехиометрически вступает в реакцию с гидропероксидом, в результате чего образовываются некоторые продукты превращения ингибитора, которые далее каталитически разлагают КГП. Таким образом, каталитическое разложение кумилгидропероксида происходит не под воздействием начальной молекулы ингибитора, а под воздействием продуктов его превращения. Кинетические параметры реакции синтезированных соединении с КГП рассчитывались для стадии каталитическо разложения (таблица).
В таблице приведены значения кинетических параметров реакции синтезированных соединений с кумилпероксидными радикалами и кумилгидропероксидом.
Таблица 1
Кинетические параметры реакции синтезированных соединений (1–3) скумилпероксидными радикалами икумилгидропероксидом
|
№ |
Т=60°С |
Т=110°С |
τ, мин. |
||
|
F |
k7, л/моль.с |
υ |
K, л/моль.с |
||
|
1 |
0.5 |
2.01 |
20000 |
11 |
100 |
|
2 |
1.58 |
2.6 |
25000 |
14.5 |
180 |
|
3 |
1.056 |
2.24 |
22000 |
13 |
120 |
|
Ионол |
2.00 |
2.10 |
- |
- |
150 |
Анализ приведенных в таплице кинетических параметров реакции синтезированных соединений с кумилпероксидным радикалами и кумилгидропероксидом показывает, что наиболее эффективным ингибитором окисления является соединение 2-етил-4-(2-гидроксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат (2). Указанный ингибитор по эффективности обрывать цепы окисления по реакции с кумилпероксидными радикалами находяти на уровне широко применямого на практике ингибитора окисления ионола. Но в отличне от ионала, этот ингибитор способен каталитически разлагать кумилгидропероксид. При этом, среди исследованных соединений этот ингибитор обладает наибольщим значением фактора каталитичности (ν) — 25000. Именно поэтому, по значению индукционного периода автоокисления кумола этот ингибитор превосходит ионол.
Экспериментальная часть
Реакцию трехкомпонентной конденсации проводоли при температуре 65–70°С, в течение 2–4 часов. Ход реакции контролировали методом тонкослойной хроматографии. В качестве элюента использовали смесь изопропилового спирта и гексана (соотношение 3:1). Присутствие пятна определяли парами йода.
Структура полученных соединений была подтверждена ИК и 1H, 13C ЯМР-спектроскопией.
Синтез производных тетрагидропиримидин-5-карбоксилатов
Синтез этил-6-метил-2-тиоксо-4-(н-толил)-1,2,3,4-тетрагидропиримидин-5-карбоксилата (1)
11,4 г. (0,15 моль) тиомочевины, 20 мл этилацетата и 21,2 г (0,2 моль) 4-метил-бензальдегида вносили в трёхгорлую колбу, снабженную механической мешалкой, термометром и капельной воронкой. Реакционную смесь перемешивали в течение 4-х часов при температуре 65°C. За ходом реакции следили посредством тонкослойной хроматографии. По завершении реакции, смесь держали в течение 24 часов при комнатной температуре, что ускоряло вынадение белых кристаллов. Кристаллы 6-метил-2-этил-4-(п-толил)-1,2,3,4-тетрагидропирими-дин-5-карбоксилата отфильтровывали, затем промывали в дихлорметане и перекристаллизо-вывали из этилового спирта. Получили 7,41 г. 6-метил-2-этил-4-(п-толил)-1,2,3,4-тетрагидропи-римидин-5-карбоксилата. Выход 65 %. Т.пл.=232°C. Rf=0.54 (элюент этанол:гексан = 5:2. 1H ЯМР-спектр (300 MHz, DMSO-d6) 5 1.35 (s, 3H, CH3), 6.8–7.1 (m, H, Ar), 7.4 (m, H, Ar), 9.35 (s, 1H, NH). 13C ЯМР-спектр (75 MHz, DMSO-d6) 24, 29, 39, 51, 83, 118, 122, 124, 128, 133, 142, 150, 180 м.д. (C=S), 204 м.д. (C=O)
Синтез этил-4-(2-гидроксифенил)-6-метил-2-тиоксо-1,2,3,4-тетра-гидропиримидин-5-карбоксилата (2)
Синтез проводили аналогичным способом. Выход 2.8 g. (65 %), Т.пл=220оС., Rf = 0.44. ИК ν, см-1: 1618, 1560, 1526 (Ar), 3112 (CH2=C), 785 (Ar-CH), 1722, 1701 (C(O)R), 1377, 1370 (CH3), 1651 (C=C), 3242 (NH), 1314 (C-N). 13C ЯМР-спектр (75 MHz, DMSO-d6) 5 24, 29, 37, 51, 86, 117, 122, 129, 132, 141, 151, 179 м.д. (C=S), 205 м.д. (C=O)
Синтез бензил-6-метил-2-тиоксо-4-(о-толил)-1,2,3,4-тетрагидро-пиримидин-5-карбок-силата (3)
Синтез проводили аналогичным способом. Выход 3.4 g. (75 %), Т.пл.222оС., Rf = 0.39. ИК-спектр ν, см-1: 1810–1951, 3000–3100 (Ar), 1493 (Ar C-H), 1614 (Ar C-C), 703 (CH), 1675, 1703 (C=O), 3257 (NH), 1236 (C=S).
1H ЯМР-спектр (ДМСО-d6 м.д. δ): 1.31 (t., 3H, CH3); 1.49 (s., 3H, CH3); 4.26 (k., 2H, OCH2); 4.67 (s.(d.), 1H, CH); 6.85 (d., 1H, NH); 7.02–7.35 (m., 9H, 2Ar); 9.49 (d., 1H, OH).
13C ЯМР-спектр (ДМСО-d6 м.д. δ): 14.99, 25.89, 62.35, 86.28, 116.85, 122.55, 125.01, 126.21, 126.22, 128.87, 128.88, 130.01, 133.24, 142.16, 151.96, 167.91, 179.05.
Заключение
Синтезированы некоторые производные тетрапиримидин-5-карбоксилата, обладающие высокими антиоксидантными свойствамь.
Установлено, что синтезированные соединения как ингибиторы окисления эффективно обрывают цепи окисления по реакции с пероксидными радикалами и каталитически разлагают гидропероксиды на молекулярные продукты.
Литература:
- Gerard Jenner. Effect of high pressure on Biginelli reactions. Steric hindrance and me chanistic considerations // Tetrahedron Lett., 2004, v. 45, p. 6195–6198.
- Ji-Tai Li, Jun-Fen Han, Jin-Hui Yang, Tong-Shuang Li. An efficient synthesis of 3,4-dihydropyrimidin-2-ones catalyzed by NH2SO3H under ultrasound irradiation // Ultrasonics So nochemistry, 2003, v. 10, p. 119–122.
- Limin Wang, Changtao Qian, He Tian, Yun. Lanthanide Triflate Catalyzed One-Pot Synthesis of Dihydropyrimidin-2(1H)-thiones by a Three-Component of 1,3-Dicarbonyl Compounds, Aldehydes, and Thiourea Using a Solvent-Free Biginelli Condensation // Synthetic Communications, 2003, v. 33, p. 1459–1468.
- Laue T., Plagens A. Namen und Schlagwort-Reaktionen der Organischen Chemic. Taubner, 2006, 94 P.
- Lu Jun, Yinjuan Bai, Zhenjun Wang et al. One-pot synthesis of 3,4-dihydropyrimidin-2(1H)-ones using lanthanum chloride as a catalyst // Tetrahedron Lett., 2000, v. 41, p. 9075–9078.
- Subhas D. Bose, Madapa Sudharshan, Sanjay W. Chavhan. New protocol for Biginelli reactiona practical synthesis of Monastrol / Dedicated to Dr. A. V. Rama Rao on his 70th birthday. ARKIVOC 2005, p. 228–236.
- Sasaki S, Mizuno M, Naemura K, Tobe Y. Synthesis and Anion-Selective Complexation of Cyclophane-Based Cyclic Thioureas // J. Org. Chem., 2000, v. 65 № 2, pp. 275–283.
- Sujayev, A., Garibov, E., Taslimi, P., et al. Synthesis of some tetrahydropyrimidine-5-carboxylates, determination of their metal chelating effects and inhibition profiles against acetylcholinesterase, butyrylcholinesterase and carbonic anhydrase. Journal of Enzyme Inhibition and Medicinal Chemistry · March 2016, V.31(6), p.1531–1539.
- Farzaliyev V., Sujayev, A., Kose, L., Garibov, E., et al. Synthesis of N-Alkyl (Aril)-Tetra Pyrimidine Thiones and Investigation of Their Human Carbonic Anhydrase I and II Inhibitory Effects. Journal of Enzyme Inhibition and Medicinal Chemistry, 2016, 31(6), 1192–1197.
- Farzaliyev V. M., Sujayev A. R., Garibov E. N., Synthesis and transformations of some tetrahydropyrimidine-5-carboxylates. ISJ Theoretical & Applied Science, (2016), 03 (35): p.101–106
- Эмануель Н. М., Денисов Е. Т., Майзус З. К., Федорова В. В. Ислные реакции окисление углеводоров в жидкой фазе. М.: Наука, 1967. 33 с.
- Денисов Е. Т. Константы скорости гомолитических жидкофазных реакций. М.: Наука, 1971. 712 с.







