Одним из главных направлений экономического развития Республики Узбекистан является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных импортзамещающих продуктов на базе местных сырьевых ресурсов. [1] К таким продуктам можно отнести сульфат натрия, потребность в котором постоянно растет.
Узбекистан располагает большими запасами сульфата натрия (мирабилита, тенардита, астраханита), обнаруженными в соляных отложениях Приаралья: месторождения Аккалы, Кушканатау и Тумрюк в Республике Каракалпакстан. Тумрюкское месторождение мирабилита является одним из основных сырьевых источников сульфата натрия, характеризующимся минимальным содержанием примесных солей галита, эпсомита и гипса.
Научная значимость получения сульфата натрия конверсионного способазаключается в том, что проведенные исследования явились научной основой для создания технологии получения глауберовой соли медицинского назначения, сульфата натрия и хлорида аммония из местного сырья — природного мирабилита Тумрюкского месторождения, а также процесса конверсии природного хлорида натрия сульфатом аммония. Научное значение имеют и результаты изучения растворимости и характера твердых фаз в четверной взаимной системе 2Na+, 2NH4+ // 2Cl-, SO42- — H2O и ее составляющей тройной системе 2NH4+ // 2Cl-, SO42- — H2O.
Получение товарного сульфата натрия из местного сырья целесообразно проводить по схеме, предусматривающей растворение соли, удаление нерастворимого остатка, кристаллизацию декагидрата сульфата натрия из осветленного раствора и выделение продукта из раствора, получаемого при плавлении декагидрата сульфата натрия, выпариванием. При этом важным является установление кинетических параметров выщелачивания природной соли.
Технологическая основа получения сульфата натрия конверсией хлорида натрия сульфатом аммония базируется на физико-химических свойствах четверной взаимной водной системы из хлоридов и сульфатов натрия и аммония и ее составляющих тройных систем.
В связи с этим для обоснования процесса конверсии хлорида натрия сульфатом аммония при повышенных температурах были изучены изотермическим методом при 100 °С тройная система (NH4)2SO4–NH4Cl–H2O и четверная система 2Na+, 2NH4+ // 2Cl-, SO42- — H2O.
Диаграмма растворимости тройной системы при 100 °С состоит из двух ветвей кристаллизации твердых фаз сульфата и хлорида аммония (рис. 1). Ветвь кристаллизации сульфата аммония больше, чем хлорида аммония.
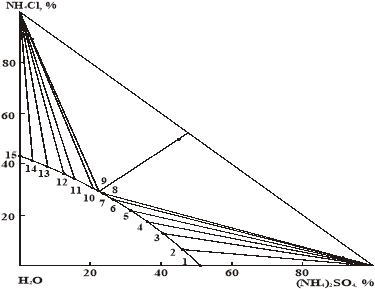
Рис. 1. Диаграмма растворимости системы сульфат аммония — хлорид аммония — вода при 100 °С
В изученной системе образования новых соединений не наблюдалось. Особенность изотермы состоит в том, что компоненты системы оказывают взаимное высаливающее действие друг на друга. Благодаря хорошей растворимости в данной системе хлорид аммония оказывает более значительное высаливающее действие на сульфат аммония, чем сульфат аммония на хлорид аммония.
Для выдачи практических рекомендаций по получению сульфата натрия и хлорида аммония изучен процесс конверсии хлорида натрия сульфатом аммония в растворе, содержащем 16,75 % Na2SO4, 1,49 % NaCl, 21,48 % NH4Cl и 60,28 % H2O. Исследование проводилось при температурах 60, 80 и 100 °С и продолжительности опытов 15–150 минут.
Определение порядка реакции хлорида натрия с сульфатом аммония показало, что она удовлетворительно описывается известным кинетическим уравнением первого порядка. Подтверждением этого является то, что константа скорости конверсии остается практически постоянной для каждой температуры.
Методом математической обработки экспериментальных данных найдены значения предэкспоненциального множителя k0 и кажущейся энергии активации (Е). Уравнение Аррениуса принимает вид: k=54120·е-10802,28/(R·T).
На основе этого уравнения рассчитаны константы скорости реакции конверсии хлорида натрия сульфатом аммония при различных температурах в интервале 40–110 °С через каждые 10 °С и температурный коэффициент скорости реакции.
Согласно полученным данным температурный коэффициент реакции при повышении температуры на 10 °С в интервале 40–110 °С повышается в 1,46–1,71 раза. Найденная кажущаяся энергия активации процесса конверсии хлорида натрия сульфатом аммония в указанном интервале температур составляет 45,23 кДж/моль.
Из результатов исследований следует, что для получения сульфата натрия и хлорида аммония конверсией хлорида натрия сульфатом аммония оптимальным является проведение процесса при температуре 100 °С и в течение времени не менее 150 мин. При этом практическая степень конверсии исходных компонентов составляет 99,1 %. Был изучен и процесс фильтрации пульпы, образующейся в результате конверсии хлорида натрия сульфатом аммония. Полученные экспериментальные данные по фильтруемости пульп с осадками сульфата натрия и хлорида аммония показали, что фильтруемость пульпы с осадком хлорида аммония незначительно выше, чем пульпы с осадком сульфата натрия.
Результаты исследований позволили разработать технологическую схему получения сульфата натрия и хлорида аммония конверсией хлорида натрия сульфатом аммония.
Предложенная технология отработана на созданной укрупненной лабораторной установке с использованием сульфата аммония, получаемого из серной кислоты и аммиака на Чирчикском ОАО «Электркимесаноат» и хлорида натрия, добываемого в Республике Каракалпакстан.
Литература:
- И. А. Каримов «Мировой финансово-экономический кризис, пути и меры его преодоления в условиях Узбекистана». — Ташкент: 2009. — 46 с.
- Х. Ч. Мирзакулов, Г. Х. Джураева. Производство сульфата натрия. — Ташкент, 2014. — 224 с.
- Патент РУз № IAP 04470. Способ получения сульфата натрия. С. М. Туробжонов, Х. Ч. Мирзакулов, Д. Д. Асомов, Г. Х. Жураева, С. В. Бардин и др. Опубл. бюл. № 2, 2012.







