В работе приведены расчет уравнения градировочного графика методом наименьших квадратов для нахождения количества металла и реагента при комплексообразовании, а также определены константы нестойкости характеризующие прочность связи Re: Au.
Ключевые слова: металлоион, комплекс, азореагент, аналитические параметры
Незначительное содержание благородных металлов обусловливает необходимость разработки оптических, физических и др. методик их определения, но они не отличаются высокими метрологическими характеристиками и аналитическими параметрами, поскольку малоселективны, неэкспрессны в выполнении, неточны, малодоступны и сложны. Поэтому необходимо разработать новые, более совершенные и современные методы определения золота, отвечающие всем существующим требованиям. Для достижения поставленной цели необходима разработка чувствительных, простых методов определения золота, являющихся актуальной задачей современной аналитической химии. Одним из существующих методов, удовлетворяющих этим требованиям, является сорбционная-спектрофотометрия с применением иммобилизованных органических реагентов, применение которых позволяет снизить нижние границы определяемых концентраций золота и улучшить метрологические характеристики разработанных методик.
Для нахождения количества металоиона при cорбционно-спектроскопических определениях используются график, связывающий измеряемую величину “у”, оптическую плотность “А” с искомым содержанием определяемого вещества “Хi”.
Прямолинейная зависимость выражается уравнением Y=а + вХi.
Градировочный график строили по следующей методике: В мерную колбу емкостью 25 мл приливали переменное количество (от 5 до 80 мк) золота, добавляли по 1,0 мл, 0,0005 М раствора реагента N-метиланабазин-α-азо-β-нафтол (МАН) и 10 мл буферного раствора, объем доводили до метки дистиллированной водой. Растворы перемешивали и измеряли спектры отражения.Результаты измерений и их математическая обработка приведены в таблице 1, и графически изображено в рисунках 1.
Таблица 1
Расчет параметров линейного градуировочного графика для комплекса МАН-Au на волокнах СМА-1(n=3, р=0,95)
|
№ |
Auмкг, Хi |
F (R), Yi |
Xi2 |
XiYi |
Yiр. |
|
1 |
5,0 |
0,756 |
25 |
3,78 |
0,7879 |
|
2 |
10,0 |
0,816 |
100 |
8,16 |
0,8404 |
|
3 |
20,0 |
0,930 |
400 |
18,6 |
0,9454 |
|
4 |
30,0 |
1,092 |
900 |
32,76 |
1,0504 |
|
5 |
40,0 |
1,152 |
1600 |
46,08 |
1,1554 |
|
6 |
50,0 |
1,237 |
2500 |
61,85 |
1,2604 |
|
7 |
60,0 |
1,343 |
3600 |
80,58 |
1,3654 |
|
8 |
70,0 |
1,515 |
4900 |
106,05 |
1,4704 |
|
9 |
80,0 |
1,619 |
6400 |
129,52 |
1,5754 |
|
|
365 |
10,46 |
20425 |
483,38 |
Исходя из этих данных вычисляли параметры а и b которые имели следующий вид: Y = а+bХi
При обработке полученных результатов применяли следующие формулы:
а=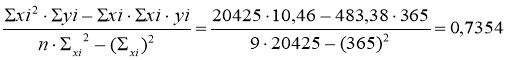
b=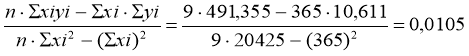
Y = а+bХi
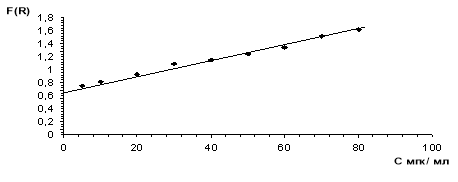
Рис. 1. Калибровочный график комплекса МАН-Au на волокне СМА-1
Как видно из таблицы 1 и рисунка 1, комплекс золота с реагентом МАН подчиняется закону Бера в пределах 5,0–80,0 мкг в 25,0 мл раствора, который даёт возможность количественно определять ионы.
Результаты расчета константы нестойкости приведены в табл.2.
Таблица 2
Расчет константы нестойкости комплекса
|
Собщ.*105M |
Сравн.*105M |
Аср |
Скомп.*106M |
Кнест.*106M |
|
0,65 |
0,0906 |
0,043 |
1,851 |
1,785 |
|
1,30 |
0,6069 |
0,065 |
2,798 |
7,898 |
|
2,60 |
1,6214 |
0,120 |
5,165 |
7,857 |
|
3,90 |
2,8680 |
0,180 |
7,745 |
9,970 |
|
5,20 |
3,9730 |
0,220 |
9,465 |
10,47 |
|
6,50 |
4,2690 |
0,250 |
10,74 |
6,796 |
|
7,80 |
6,6730 |
0,285 |
12,27 |
8,124 |
По данным таблицы 2 были рассчитаны приближенные значения константы нестойкости, характеризующие прочность связи золота с МАН.
Равновесие в системе может быть выражено следующими уравнениями: AuClm+nHR=AunRm+HCl.
Общую равновесную концентрацию реагента находили вычитанием концентраций комплекса из их общих концентраций: [R]=CR –n [AuR], концентрацию комплекса находили по формуле: [AuR]=CMe-Cкомплекса
Cреднее значение Кнест. = 8,598*10–6M, анологично рассчитанная константа нестойкости для МАН равно соответственно 1, 876*10–6M.
В результате нами были оптимизированы условия комплексообразования золота с азореагентом: образование комплекса во времени, рН среды, избыток реагента, условия подчинения закону Бугера-Ламберта-Бера. Показали интервал подчинения закону Бугера-Ламберта-Бера (5,0–80мкг/25мл). Сняты спектры светопоглощения комплексов и самого реагента, которые показали высокую чувствительность и контрастность (=100нм). На основе достигнутых результатов и выявленных закономерностей разработана сорбционно-спектроскопическая методика определения золота (III) с реагентом МАН с нижними границами определяемых содержаний исследованного металла на уровне n*10–4 n*10–7 % с Sr не более 0,33.
Работа выполнена при финансовой поддержке грантов А 12–53, ОТ-Ф7–48, АХ-Ф7–001, АХ-Ф7–005.
Литература:
- Золотов Ю. А., Иванов В. М., Амелин В. Г. Химические тест-методы анализа. // М., Наука- 2002.-152 с.
- Лурье Ю. Ю. Справочник по аналитической химии. // М., Химия 1971 С. 231–237
- Коростелев П. П. Приготовление растворов для химико-аналитических работ.// М., Наука- 1964.-152 с.







