Синтезированы новые комплексные соединения марганца(II) и рения(IV) с составом [MnCl2L(H2O)]H2O, [MnCl2L2]2H2O, [MnCl2L(H2O)]3Н2О, [KLH] [ReBr6], [KL2] ReBr6]. Показано, что состав полученных комплексов зависит от соотношения исходных компонентов. Состав и строение комплексов исследованы методами химического анализа, ИК-спектроскопии и термогравиметрии. Методом ИК-спектроскопии показано, что лиганды в состав комплексов марганца(II) входят в нейтральной форме и координируются с комплексообразователем через атом азота, а в случае синтеза рениевых комплексов лиганды протонируются и образуют комплексы ионного типа. Результаты термогравиметрических исследований показали, что конечным продуктом термического разложения всех соединений является окись марганца(III) и металлический рений соответственно.
Ключевые слова: карбамид, комплексные соединения, оксид марганца, металлический рений, аминных групп
В последние годы комплексные соединения переходных металлов с органическими донорными основаниями находят все более широкое применение в качестве катализаторов во многих органических синтезах, в производстве лекарственных препаратов, в качестве исходных продуктов для получения проводящих антикоррозионных металлических покрытий на различных подложках и др. Надо отметить, что среди координационных соединений особое место занимают комплексы полученные на основе биометаллов. Это связано с тем, что они играют важную роль во многих биохимических процессах и поэтому широко применяются в растениеводстве, животноводстве, и фармакологии [1,2]
С другой стороны, комплексные соединения многих переходных элементов в том числе марганца и рения могут обладать широким набором полезных свойств, для которых химия комплексных соединений еще не достаточно изучена [3–8].
В настоящей работе представлены методы синтеза и исследование свойств комплексов марганца(II) и рения(IV) с новыми лигандами полученными карбамидами
Экспериментальная часть
Состав и химическая структура полученных продуктов синтеза изучены физико-химическими методами анализа: элементный анализ (İCP-MS); рентгенофазовый анализ (дифрактометр (Германия) D2 Phaser фирмы Bruker); ИК-спектроскопия («Specord M-80» марки Carl Zeiss). Спектры реакционных растворов в ИК и УФ области сняты на спектрометре “Nicolet iS10” и спектрофотометре “Evolution 60S”, производителя Thermo Scientific Spectronic (США). Дифференциально-термогравиметрический анализ проводили на дериватографе (NETZSCH STA 449F3 STA449FSA-0622-M)
Синтез — [MnCl2L(H2O)] H2O
Навеску 0,8 г(0,005 моль)-MnCl2 2H2O растворяли в двухгорлой колбе с обратным холодильником в 30 мл этилового спирта при температуре 60оС и к полученному раствору при интенсивном перемешивании добавляли 0,3г (0,005 моль) лиганда L(в мольном соотношении 1:1) предварительно растворенного в 20 мл этилового спирта. Полученную смесь нагревали в течение 2-х часов, затем охлаждали до комнатной температуры, отфильтровали и ставили на кристаллизацию. Выпавшие бежевого цвета кристаллы отфильтровали, промывали несколько раз маточным раствором, затем 10–15 мл ацетоном и высушивали в эксикаторе над серной кислотой до установления постоянной массы.
Синтез- [MnCl2L2]2H2O
К бежевого цвета раствору, полученному растворением 0.8 г(0,05 моль) -MnCl2·2H2O в 20 мл этилового спирта при интенсивном перемешивании добавляли 0,6 г (0,01 моль) лиганда L растворенного в 30 мл этилового спирта (в мольном соотношении 1:2).Раствор нагревали в течение 2–2,5 часа при температуре 60оС. Далее процесс синтеза осуществляли по вышеописанной методике.
Синтез- [MnCl2L(H2O)] 3Н2О
Согласно вышеописанным методикам к 0,162 г (0,01 моль) -MnCl2 2H2O растворенного в 30 мл этилового спирта добавляли 0,6 г (0,01 моль) лиганда L (в мольном соотношении 1:1) предварительно растворенного в 20 мл этилового спирта. Полученную смесь нагревали в течение 2х часов, затем охлаждали до комнатной температуры, отфильтровали, промывали несколько раз маточным раствором, затем 10–15 мл ацетоном и высушивали в эксикаторе над серной кислотой до установления постоянной массы.
Синтез- [KLH] [ReBr6]
К коричневого цвета раствору 0.744 гр (0,01 моль) K2ReBr6 растворенного в 20 мл бромистоводородной кислоты добавляли 0,6гр(0,01моль) лиганда L. Полученную смесь нагревали в течение 2–2,5 часов, затем охлаждали до комнатной температуры, отфильтровывали, промывали несколько раз маточным раствором, затем 20 мл ацетоном. Полученные темно-коричневого цвета кристаллы высушивали в эксикаторе над серной кислотой до установления постоянной массы.
Синтез- [KL2] [ReBr6]
Согласно вышеописанной методике к 0.744 гр (0,01 моль) K2ReBr6 добавляли 0,12 гр(0,02моль) лиганда Lрастворенного в 30 мл бромистоводородной кислоты. Выпавшие коричневого цвета кристаллы отфильтровали, промывали несколько раз маточным раствором, затем 30 мл ацетоном и высушивали в эксикаторе над серной кислотой до установления постоянной массы. Хлорные аналоги рениевых комплексов синтезированы по вышеописанным методикам.
Данные элементного анализа полученных комплексов приведены в таблице 1.
Таблица 1
|
Kомплексы |
Найдено,% |
Вычислено,% |
||||
|
Mn(Re) |
Cl(Br) |
N |
Mn(Re) |
Cl(Br) |
N |
|
|
[MnL2(H2O)]·H2O |
22.29 |
- |
22.68 |
22.26 |
- |
22.67 |
|
[MnCl2L2]·2H2O |
19.4 |
10.89 |
19.90 |
19.5 |
10.9 |
19.89 |
|
[MnCl2L(H2O)]·3Н2О |
18.6 |
24.6 |
19.05 |
18.7 |
24.5 |
19.04 |
|
[KLH] [ReBr6] |
23.55 |
60.76 |
7.11 |
23.54 |
60.75 |
7.09 |
|
[KL2] [ReBr6] |
18.99 |
48.99 |
5.72 |
18.98 |
48.98 |
5.71 |
Обсуждение результатов
Как показано в экспериментальной части синтез комплексов проводится в нейтральных (для Mn) и в кислых средах (для Re) соответственно. В результате в зависимости от среды в случае марганца получаются комплексы нейтрального, а в случае рения ионного типа. Для установления строения и характера координации лиганда в полученных комплексах нами проведены ИК-спектральные исследования. Отметим, что ИК-спектры комплексов марганца существенно отличаются от спектра лиганда, в основном в области 400–600см-1 и 3100–3650 см-1. Кроме того, практически исчезает слабая широкая полоса с несколькими максимумами в области 1900–2000 см-1, которая характерна для аминных групп, участвующих в водородных связях. В спектрах комплексов в отличие от спектров лигандов появляется интенсивная широкая полоса в области 3400–3650 см-1, которую можно отнести к валентным колебаниям молекул воды. Кроме этого, в спектре лиганда наблюдается полоса средней интенсивности в области 2500–2660 см-1 показывающая на присутствие в их молекулах внутри или же межмолекулярных водородных связей.
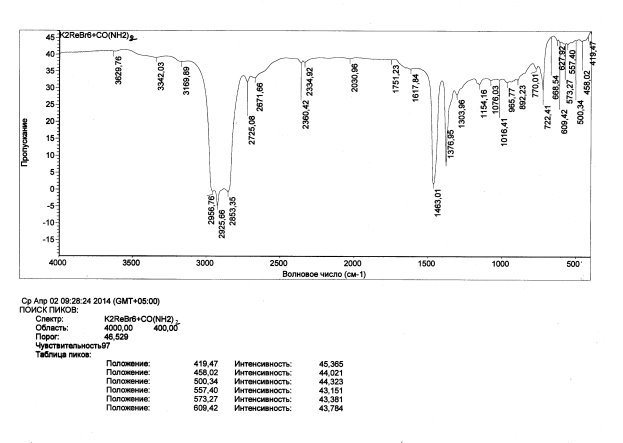
Рис. 1. ИК спектры: комплексов [KL2] [ReBr6]
Сопоставление спектров лиганда и полученных комплексов Re(IV) показали, что при комплексообразовании происходит малое изменение кроме высокочастотной области спектра(3169–3342см-1), которые характерны для валентных колебаний аминных групп. Так, узкая полоса при 3320 və 3180см-1 присутствующая в спектрах лигандов при комплексообразовании сдвигается в низкочастотную область спектра приблизительно на 50 см-1, что указывает на протонирование аминных групп в процессе комплексообразования. Для определения состава и термической устойчивости полученных комплексов нами проведены термогравиметрические исследования.
Отметим, что общий вид деривотограмм марганцевых и рениевых комплексов близки. Однако, путь термического разложения у них существенно отличается. Так, термораспад комплекса ([MnCl2L H2O]Н2О) (I) проходит в три этапа. На первом этапе разложения из комплекса удаляется молекула воды. Процесс удаления воды происходит в два этапа. Первый этап происходит при температурном интервале 80–130 оС, а второй этап при 130–170оС, что указывает на то, что одна молекула воды находится во внутренней, а другая во внешней сфере комплекса. Затем происходит поэтапное удаление лиганда. Вначале при температурном интервале 170–360оС удаляется 0,5 моль, затем при 360–580оС удаляется 0,5 моль лиганда одновременно с хлором.
Данные термического разложения остальных комплексов приведены в таблице 2.
Таблица 2
Данные термогравиметрического анализа комплексов
|
Соединения |
Области температур, Со |
Продукты разложения |
Убыль массы,% |
||
|
остаток |
возгонки |
Найдено |
Вычислено |
||
|
[MnCl2L(H2O)]·H2O |
80–130 130–170 |
[MnCl2L] |
H2O |
8,26 |
8,42 |
|
170–360 |
[MnCl2] |
L |
24.71 |
24.82 |
|
|
360–580 |
[Mn2O3] |
L+Cl |
42,12 |
42.31 |
|
|
[MnCl2L2]·2H2O |
90–110 110–160 |
[MnCl2L2] |
H2O |
5.71 |
5.14 |
|
160–300 |
[MnCl2] |
L |
37.41 |
37.86 |
|
|
300–550 |
[Mn2O3] |
Cl |
32,12 |
32.58 |
|
|
[MnCl2L(H2O)]·3Н2О |
85–120 120–140 |
[MnCl2L1] |
H2O |
17.14 |
17.43 |
|
140–420 |
[MnCl2] |
L |
63.51 |
63,99 |
|
|
420–610 |
[Mn2O3] |
Cl |
17.54 |
17.96 |
|
|
[KLH] [ReBr6] |
160–320 |
KBr+ [ReBr4L] |
[HBr] |
8.16 |
8.65 |
|
320–680 |
Re |
L+ Br2 |
50.45 |
51.59 |
|
|
[KL2] [ReBr6] |
155–330 |
KBr+ [ReBr4L2] |
[LBr] |
8.35 |
8.72 |
|
330–797 |
Re |
L+Br2 |
62.26 |
62.87 |
|
Отметим, что во всех случаях конечным продуктом термического разложения комплексов является окись марганца(III) и металлический рений.
Таким образом, согласно результатам используемых в работе физико-химических методов установлено, что состав и строение полученных комплексов в прямую зависит от соотношения исходных продуктов.
На рис. 2,3 представлен результат рентгенофазового анализа продукта синтеза. Интерпретация полученных данных также подтверждает образование комплекса [KL2] [ReBr6], [MnCl2L2]·2H2O
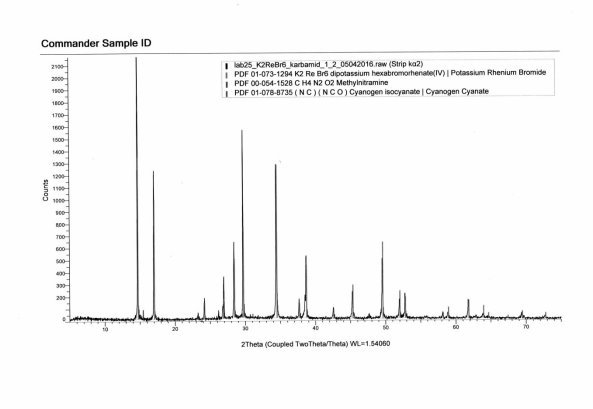
Рис.2. Дифрактограмма комплекса [KL2] [ReBr6]
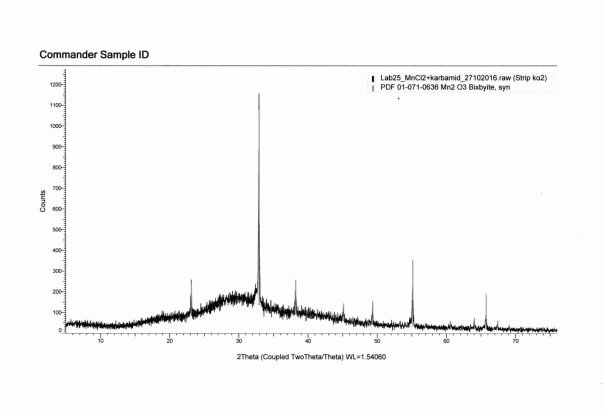 Рис. 3. Дифрактограмма комплекса [MnCl2L2]·2H2O
Рис. 3. Дифрактограмма комплекса [MnCl2L2]·2H2O
Выводы
Для определения состава и термической устойчивости исследуемых комплексов нами проведен ИК-спектральный, термогравиметрический и рентгенофазовый анализ. Результаты исследований показали, что во всех случаях конечным продуктом термического разложения комплексов является окись марганца (III) и металлический рений. Таким образом, согласно результатам используемых в работе физико-химических методов установлено, что состав и строение полученных комплексов в прямую зависит от соотношения исходных продуктов. Как показано в экспериментальной части синтез комплексов проводится в нейтральных (для Mn) и в кислых средах (для Re) соответственно. В результате в зависимости от среды в случае марганца получаются комплексы нейтрального, а в случае рения ионного типа
Литература:
- Каграманова Ш. И.,Кулиева.Э.А., Азизов. И. В. Влияние новосинтезированных комплексов цинка с аминокислотами на морфофизиологические показатели проростков пшеницы. //Академический журнал Западной Сибири № 5. Tom 10. 2014. c 94–95
- Kakhramanova Sh. İ., Guliyeva.E.A., Suleymanov G. Z., Azizov.I. V. Influence Newly Syntesized Manganese Complexes with Amino Asids on Morphophysiological Chracteristics Wheat Germ. American International Journal of Contemporary Research Vol.4, No. 12; December 2014.P.58–60
- Mahmudov K. T., Sutradhar M., Martins L., Silva F. C, Ribera A., Nunes V. M., Marchetti F., Pombeiroa A. L., Kakh- ramanova Sh. İ., MnII and CuII complexes with arylhydrazones of active methylene compounds as effective heteroge- neous catalysts for solvent and additive-free microwave-assisted peroxidative oxidation of alcohols. // RSC Advances An international journal to further the chemical sciences. The Royal Society of Chemistry. 2015. 5, P. 25979–25987.
- Каграманова Ш. И., Кулиева Э. А., Сулейманов Г. З., Керимова У. А., Аскерова Т. Я. Взаимодействие марганца (II) с валином и ß-аланином // Международная молодежная научно-практическая конференция студентов, аспирантов и молодых «Фундаментальные и прикладные исследования в области химии и экологии», (Курск 23 сентября — 26 сентября 2015). С. 29–31.
- В. И. Бабаева, У. А. Керимова, Н. С. Османов. Синтез и исследование комплексов рения(IV) с некоторыми аминокислотами. //Журн. Химия и химическая технология. 2011.т.54, вып.1, с.33–36
- Молодкин А. К., Есина Н. Я., Гнатик Е. Н. и др. Комплексные соединения Pt(IV) с цитозином и треонином //Журн. неорг. химии. 1998. т.43.№ 7.с.1160
- Керимова У. А., Османов Н. С., Худавердиев Р. А., Бабаева В. И., Комплексные соединения рения(IV) с лейцином, Журнал Химические проблемы, № 4, 2009, с.680–683.
- Керимова У. А., Османов Н. С., Ахмедов М. М., Худавердиев Р. А., Аббасов Я. А., Синтез и свойства комплексов рения(IV) с аминоуксусной кислотой. // Химические проблемы, № 2, 2008, с. 277.







