Ключевые слова: острый аппендицит, диагностическая шкала, клинико-соноскопическая диагностика, ультразвуковое исследование, Alvarado
Основным методом диагностики острого аппендицита (ОА) в настоящее время остается объективное исследование, дополняемое лабораторными данными. Немалую роль при диагностике ОА играет и консерватизм среди хирургов, восприятие ОА в качестве «простой» патологии, а аппендэктомии даже при неизмененном червеобразном отростке, как «безвредной» операции, которую «лучше выполнить, чем пропустить ОА».
Качество диагностики ОА находится в высокой зависимости от опыта врача и прочих внешних факторов. По данным литературы, доля «напрасных» аппендэктомий доходит до 40 % (в среднем 15 %). А частота осложнений после аппендэктомий при неизменном отростке парадоксально выше, чем после аппендэктомий при гистологически подтвержденном ОА, в 3 раза [38]. Таким образом, показанием к экстренному оперативному вмешательству справедливо считают наличие именно деструктивного ОА (ОДА) [1,11].
Одним из актуальных направлений улучшения качества диагностики ОДА является применение клинико-соноскопического подхода диагностики данной патологии.
Аспекты клинико-соноскопической диагностики ОА
Многолетняя клиническая практика показывает, что под понятием «острый аппендицит» в настоящее время объединяют различные формы воспаления червеобразного отростка (ЧО). Однако накопленный более чем за сто лет опыт лечения ОА показывает, что не все они требуют выполнения аппендэктомии [1,4,11].
Первая патоморфологическая классификация ОА была предложена McBurney в 1891 году [45]. В ней он выделил «катаральную» и «гнойную» формы ОА.
В отличие от «катаральной», патогистологическая картина «гнойной» формы характеризовалась повреждением слизистой оболочки и гнойно-бактериальной инфильтрацией стенки ЧО. Отдельно им были выделены патологические процессы с выходом воспалительного процесса за пределы стенки ЧО, периаппендикулярный абсцесс и облитерированные ЧО [45].
В последующих классификациях ОА термин «гнойные» формы ОА был заменен на «флегмонозный», «флегмонозно-язвенный» и «деструктивный флегмонозный». Было так же введено понятие острого гангренозного аппендицита [7,16,17].
Самым спорным аспектом этих классификаций являлось отражение в них «катаральной» формы ОА.
Кроме классификации McBurney термин «катаральный аппендицит» использовался также в классификациях В. П. Образцова [13], Э. Зонненбурга [3], Г. В. Шора [22], Н. Н. Еланского [2], и О. Е. Нифантьева [12] и др.
Ряд авторов считает, что следует отказаться от термина острый «катаральный аппендицит», так как, по их мнению, истинный катаральный аппендицит встречается очень редко [4].
Так, Н. С. Утешев [19] указывал, что «…никто и никогда не видел катарального воспаления слизистой ЧО».
В. П. Образцов [13], наряду с ранее известными морфологическими (в том числе и катаральной) формами ОА выделял такие формы ОА, как «колика ЧО», «простое воспаление», «прободной аппендицит» и «ихорозный аппендицит».
В. И. Колесов [7] ввел понятие «аппендикулярная колика», которая, по мнению автора, характеризуется появлением болей в правой подвздошной области, проходящих через несколько часов. Он указывал, что аппендикулярная колика как симптом ОА является следствием воспаления ЧО и не представляет из себя самостоятельное заболевание.
По его данным, патогистологические изменения ЧО при «простой форме» ОА либо отсутствуют, либо являются минимальными даже в более поздние сроки заболевания после 48 ч.
В. И. Колесов [7] утверждал, что при серийном исследовании в большинстве подобных случаев выявляются очаговые воспалительные изменения ЧО, которые некоторые морфологи относят к физиологической норме или артефактам [4,7].
Некоторые авторы считают, что «простой» ОА с яркой клиникой и отсутствием отчетливых анатомических изменений нужно рассматривать как особую функциональную форму ОА, которая может возникать при временных моторных и сосудистых нарушениях в ЧО [4].
П. Ф. Калитиевский [4] указывает, что при «поверхностном аппендиците» патогистологические изменения ЧО определяются как лейкоцитарная инфильтрация его слизистой оболочки с очагами Ашоффа. По его данным, содержание лейкоцитов в слизистой оболочке ЧО и в норме сильно варьирует, так же, как и в слизистой других отделов кишечника. При этом содержание лейкоцитов, как секреторная и пролиферативная активность эпителия слизистой оболочки, зависит от функционального состояния кишки.
По его мнению, в результате гипоксии тканей местного или общего характера, обусловленной операцией и анестезией, обязательно происходит повышенный приток лейкоцитов в слизистой оболочке и в других слоях стенки ЧО, сопровождающийся лейкоцитарными стазами и выходом лейкоцитов за пределы сосудистого русла.
Традиционно такие формы ОА как «катаральный», «простой», «поверхностный» аппендицит и аппендикулярную колику относят к «недеструктивным» формам ОА [7,17].
Относительно показаний к оперативному лечению, все авторы единодушно считают необходимой аппендэктомию при «деструктивном» ОА [1,11].
Относительно «недеструктивных» форм ОА мнение различных авторов расходится или окончательно ещё ими не определено.
Так, в иностранной литературе аппендэктомии при «простом» ОА и «аппендикулярной колике» обозначают как «напрасные» [38].
По данным Flum [38], частота осложнений после аппендэктомий при неизменном ЧО в 3 раза выше, чем после аппендэктомий при гистологически подтвержденном деструктивном ОА.
Гринберг А. А. в своей классификации ОА совсем не упоминает его недеструктивные формы [1].
По-разному трактуется и само определение «деструктивный» ОА.
По мнению одних авторов, в эту группу входят флегмонозная и гангренозная формы [16,17,19].
Другие авторы относят к ней только гангренозную форму [20].
Большинство выше упомянутых классификаций основывается на концепции последовательного стадийного течения ОА [59,72].
Другая часть авторов, придерживается точки зрения, что все формы ОА являются самостоятельными, а не переходными формами воспаления в ЧО [29].
Третья концепция рассматривает стадийное течение только при деструктивных формах ОА, а «простые» формы (недеструктивные) относит к самостоятельным заболеваниям [16,19].
В «Национальных клинических рекомендациях по диагностике и лечению ОА», принятых Российским обществом хирургов, приводится классификация ОА, учитывающая «катаральную» форму. При этом в разделе «Определение показаний к аппендэктомии во время лапароскопии» аппендэктомия рекомендуется только при выявлении признаков деструктивных (флегмонозный, гангренозный, перфоративный) форм ОА [11].
В других случаях аппендэктомия при «катаральной» форме рекомендуется только в случае уже выполненного доступа в правой подвздошной области и интраоперационного выявления данной формы и должна предваряться обязательной ревизией близлежащих органов для исключения другой патологии [11].
С момента первого описания ОА в 1839г. Bright и Addison основным методом его диагностики по-прежнему остается клинический, который основывается на сборе анамнеза и определении местных симптомов заболевания.
К настоящему времени описано более 100 симптомов ОА [1,17,19].
Наиболее часто упоминаются в литературе и используются в современной клинической практике симптомы Кохера, Ситковского, Бартомье-Михельсона, Ровзинга, Образцова, Воскресенского и Щеткина-Блюмберга [8,17].
Классической «типичной» клинической картиной ОА считается его симптоматика при наиболее часто встречающемся расположении ЧО в правой подвздошной области на собственной брыжеечке.
Значительное внимание уделяется диагностике ОА при «атипичном» расположении ЧО, под которым подразумевают изменение его локализации в брюшной полости (тазовая, подпечёночная, медиальная, ретроцекальная позиции) и отношение к брюшине (забрюшинное расположение) [8].
По многочисленным публикациям и практическому опыту известно, что указанные особенности расположения ЧО изменяют клиническую картину заболевания и являются факторами риска диагностики ОА [1,8,17,19].
Обращает на себя внимание вариабельность встречаемости «атипичных» локализаций аппендикса у различных авторов. Так, частота латерального расположения варьирует от 5,3 до 15 %, медиального — от 5,7 до 9,8 %, ретроцекального — от 7,82 % до 25 %, а тазового — от 9 до 73 % у женщин [8,17].
Атипичность клинического проявления ОА при «атипичном» расположении ЧО потребовала расширения объема диагностических мероприятий с использованием дополнительных симптомов.
Так для предполагаемого ретроцекального и ретроперитонеального расположения ЧО наиболее часто дополнительно используются симптомы Бартомье-Михельсона, Ровзинга, Ситковского, Коупа и Образцова. Для тазового расположения ЧО — симптомы Коупа и Промптова, пальцевое ректальное исследование [8].
До сих пор ряд авторов проводит параллель между особенностями клинической картины ОА и патогистологической формой ОА [17].
Однако, как указывал П. Ф. Калитиевский [4], ни клинические симптомы, ни их совокупность не позволяют уверенно поставить дооперационный диагноз патоморфологической формы ОА.
Это утверждение находит своё подтверждение во многих работах, посвященных клинико-морфологическим несоответствиям при ОА, что делает бесперспективной попытку клинической дифференциальной диагностики патоморфологических форм ОА.
Относительно низкая точность отдельных клинических симптомов ОА, высокая зависимость результатов их использования от личного опыта врача-диагноста в сочетании с неопределённостью тактики оперативного лечения при недеструктивных формах ОА приводит к тому, что клиническая диагностика ОА сопровождается высоким процентом лапаротомий с «напрасными» аппендэктомиями при недеструктивных формах ОА [1,29,38].
Несмотря на подробное описание клинической картины ОА различными авторами, необходимой конкретизации наиболее значимых симптомов заболевания и стандартизации объема клинического обследования нет, что периодически становится основанием для привлечения врачей к ответственности в случае диагностических ошибок при ОА.
В связи с этим рядом исследователей стала осуществляться попытка систематизации наиболее значимых клинических проявлений и стандартизации обследования пациентов при ОА.
Andersson R. [28] в проспективном исследовании, включившем 496 пациентов в возрасте от 10 до 86 лет с подозрением на ОА оценил диагностическую ценность 21 параметра, учитывавшегося при их клиническом обследовании.
На основании анализа историй болезни им было выявлено, что ОА более характерен для мужчин старше 40 лет и в течение 7–12 часов от начала заболевания сопровождается интенсивной постоянной болью, рвотой, миграцией болей в правую подвздошную область.
По его данным ОА был менее вероятен при локализации болей вне правой подвздошной области, не интенсивном болевом синдроме, отсутствии усиления болей в животе при движениях и кашле и при давности заболевания более 48 часов.
ОА был более вероятен при выраженном напряжении мышц передней брюшной стенки, при положительном симптоме Щеткина-Блюмберга, локализации боли непосредственно в точке McBurney.
Боль при пальцевом ректальном осмотре оказалась малоинформативным симптомом.
После многофакторного статистического анализа сочетания всех анамнестических и объективных признаков, авторами было показано, что наибольшей диагностической ценностью обладает комплекс объективных симптомов (площадь под ROC кривой — 0,87). Менее информативными были лабораторные показатели (площадь под ROC кривой — 0,85) и анамнестические данные (площадь под ROC кривой — 0,78).
Wagner J. [56] на основе мета-анализа, посвященного информативности клинических симптомов при ОА, позволил выделить, как наиболее важные симптомы, боль в правой подвздошной ямке, напряжение мышц передней брюшной стенки и миграцию боли из периумбиликальной области в правую подвздошную область.
Им отмечено, что ОА был менее вероятен при наличии в анамнезе подобной боли в прошлом, отсутствии боли в правой подвздошной области и отсутствии указанной миграции болей.
Диагноз ОА был также маловероятен при появлении рвоты, предшествующей возникновению болевого абдоминального синдрома.
Подобные исследования легли в основу создания диагностических шкал (ДШ) ОА, задачей которых была стандартизация клинической диагностики ОА и выработка алгоритма принятия решения.
На основе анализа структуры существующих ДШ ОА видно, что они составлены на основе клинических и инструментальных признаков ОА без осложнений, наличие которых в виде пальпируемого плотного инфильтрата или распространённого перитонита определяют однонаправленное решение хирурга на госпитализацию пациента и их лечение. Таким образом, они построены на определении вероятности ОА и отражают лишь часть его общих проявлений.
По своей структуре ДШ ОА представляют из себя перечень наиболее значимых, по мнению автора, косвенных признаков (симптомов) ОА с их бальной оценкой.
Результатом применения ДШ ОА является полученное количество баллов, которое само по себе не позволяет принять решение по диагностике ОА и тактике лечения пациента.
В связи с чем, автором ДШ ОА обязательно предлагается алгоритм её применения, на основе которого и происходит интерпретация полученного результата с принятием соответствующего решения.
ДШ ОА различаются как по учитывающимся в них признакам, так и по присваиваемым балльным оценкам и их интерпретации.
Одна из первых ДШ ОА была разработана Ira Teicher et al. в 1983г [53]. Применение ДШ ОА, по сведениям авторов, позволило предотвратить 38 % «напрасных» аппендэктомий. Тем не менее, их количество составило 14 %.
Частота «напрасных» аппендэктомий, при применении ДШ ОА Christian, составила 6,5 % (в контрольной группе — 17 %) [35]. Значимость данного исследования лимитируется небольшим количеством наблюдаемых случаев, которое составило 58 пациентов.
Применение ДШ ОА Ohmann C. сопровождалось 21 % «напрасных» аппендэктомий [47].
ДШ ОА Eskelinen была разработана на основе компьютерного алгоритма с применением метода логистической регрессии. Сумма баллов более 55 указывала на высокую вероятность наличия ОА [37].
H. Sitter et al. [39] показали, что увеличение балльного порога более 57 в ДШ ОА Eskelinen позволило уменьшить количество «напрасных» аппендэктомий с 26,6 до 17,8 %. Авторами были выделены группы высокой (>57 баллов), низкой (≤ 48 баллов) вероятности ОА и промежуточная (57–48 баллов) группы.
Van Way, Arnbjornsson также разработали собственные ДШ ОА на основе компьютерного алгоритма, однако они не получили распространения [30,55].
В 1986г. на основании ретроспективного исследования 305 пациентов Alvarado [26] предложил свой вариант ДШ ОА. Чувствительность ДШ составляла 89,7 %, а специфичность 76,3 %. В ДШ ОА были выделены 8 клинических и лабораторных диагностических признаков.
Кроме количества лейкоцитов в общем анализе крови, автор предложил учитывать показатели лейкоцитарной формулы. Сумма баллов от 7 и более предполагает высокую вероятность наличия ОА и является показанием к оперативному лечению. Сумма баллов менее 5 с высокой вероятностью позволяет исключить наличие ОА. Пациентам, получившим в процессе оценки 5–6 баллов, необходимо динамическое наблюдение или выполнение диагностической лапароскопии. Риск наличия ОА в этой группе обследуемых умеренный.
Также была описана модифицированная шкала Alvarado [49], в которой нейтрофильный лейкоцитарный сдвиг был заменен на группу «внешних признаков»: болезненность при кашле, положительный симптом Ровзинга, болезненность при ректальном исследовании. Наличие одного или нескольких данных признаков оценивается в 1 балл. Диапазоны оценки ДШ ОА были те же, что и у ДШ Alvarado.
В отдельных исследованиях показано небольшое преимущество модифицированной ДШ ОА перед оригинальной ДШ Alvarado [49].
Subotic et al. [52] показали более высокую специфичность шкалы Alvarado у мужчин в сравнении с женщинами, что объясняется ими высокой частотой острой гинекологической патологии у последних.
Систематизированный обзор R. Ohle [46] оценивал диагностическую точность этой ДШ ОА у разных групп (дети, мужчины, женщины). Сумма баллов менее 5 позволяла с высокой долей вероятности исключить ОА во всех группах (общая чувствительность 99 %). В подгруппе пациентов с суммой баллов 7 и более специфичность ДШ была относительно низкой (суммарно 81 %). Специфичность ДШ у мужчин была ниже, чем у женщин (57 % и 73 % соответственно). Автор сделали выводы, что ДШ Alvarado наиболее откалибрована для применения у мужчин. Она может использоваться с высокой точностью для исключения ОА при сумме баллов менее 5. Однако, сумма баллов 7 и более не является облигатным показанием к аппендэктомии и в этом случае необходима комплексная оценка пациента хирургом, дополнительное использование визуальных методов обследования.
Тем не менее, ДШ Alvarado наиболее часто приводится в руководствах по хирургии и нашла наибольшее практическое применение в сравнении с другими ДШ ОА. Это подтверждается включением ДШ Alvarado в «Национальные клинические рекомендации по диагностике и лечению острого аппендицита» Российского общества хирургов [11].
Лишь отдельные ДШ ОА учитывают только клинические и анамнестические данные.
Примером может служить диагностическая шкала Lintula [42], которая первоначально была разработана для применения в педиатрической практике.
В небольшом рандомизированном исследовании [43] была показана информативность шкалы Lintula и у взрослых, где чувствительность составила 87 %, специфичность — 59 % и точность — 74 %. При этом в случае динамического использования ДШ в процессе наблюдения чувствительность, специфичность и точность повышались до 87 %, 98 % и 92 % соответственно.
Турецкими исследователями [41] была показана высокая информативность ДШ Lintula у пациентов, старше 65 лет и был предложен модифицированный вариант этой ДШ.
Другие ДШ ОА помимо клинических и анамнестических признаков, учитывают ещё и лабораторные показатели. Чаще всего в них включались показатели общего анализа крови.
В шкале RIPASA [34] дополнительно учитывались показатели общего анализа мочи. Особенность этой ДШ заключалась в том, что разрабатывалась она специально для использования в азиатской популяции (Юго-Восточная Азия). Наряду с уже использовавшимися в других ДШ ОА диагностическими признаками, авторы учитывали симптом Ровзинга и иностранное гражданство пациента.
Иорданские исследователи [25] сравнили эффективность ДШ RIPASA, Alvarado и нестандартизованного клинического подхода в диагностике ОА у 600 пациентов. Доля необоснованных аппендэктомий при нестандартизованной клинической диагностике составила 17 %. При оценке ДШ ОА Alvarado и RIPASA было показано потенциальное уменьшение необоснованных аппендэктомий до 8 и 7,8 % соответственно. При этом ДШ RIPASA показала большую чувствительность и точность.
Были отмечены попытки включить в ДШ ОА дополнительные лабораторные показатели.
Так, в ДШ ОА AIRS (Appendicitis Inflammatory Response Score) [27] был включен учет уровня С-реактивного белка, что позволило лишь незначительно повысить точность ДШ в сравнении с ДШ Alvarado.
Предложенная С. С. Слесаренко и А. Ю. Лисуновым [18] ДШ ОА, по их данным позволяет выявить наличие деструкции ЧО в 95–96 % случаях. Однако в данной ДШ ОА широко используется применение лапароскопии. Разработка ДШ произведена при ретроспективном анализе, а сравнительные данные по её применению другими авторами отсутствуют.
А. С. Мухин и Р. Р. Касимов [6] также представляют хорошие результаты применения разработанной ими ДШ ОА, где точность составила 97,5 %, чувствительность — 95 % и специфичность — 100 %. Эта ДШ ОА также предполагает использование лапароскопии, УЗИ и измерение С-реактивного белка. Однако разработка ДШ была проведена частично при ретроспективном анализе с апробацией на минимальном количестве пациентов.
С. Ohman [48] на группе из 1254 пациентов выполнил проспективный анализ10 известных до 1995г. ДШ ОА, на основании которого он пришёл к заключению, что в ДШ ОА частота «негативных» аппендэктомий должна составлять ≤15 %, риск возможной перфорации — ≤35 %, частота нераспознанных перфораций — ≤15 % и частота неустановленного диагноза ОА — ≤5 %.
По ранее опубликованным в литературе данным, лишь ДШ ОА Alvarado отвечала всем четырем критериям, а ДШ ОА Lindberg, Fenyo, Christian соответствовали только по двум различным критериям.
При оценке данных ДШ ОА на выбранной для исследования группе пациентов, ни одна из них не соответствовала всем 4-м критериям. На этом основании им был сделан вывод о неэффективности применения ДШ при ОА
Опубликованный в 2013г. систематизированный обзор 14 ДШ ОА, в качестве наиболее широко применяемых и работоспособных выделил оригинальную и модифицированную ДШ ОА Alvarado, ДШ ОА Fenyo и Eskelinen. Было отмечено, что из представленных ДШ ОА, только шкала Eskelinen была разработана с помощью многофакторного статистического анализа, хорошо откалибрована и прошла апробацию на различных популяциях и при участии максимального количества пациентов [57].
Все вышеприведенные ДШ ОА не направлены на выделение деструктивных форм заболевания ОА.
Следует отметить, что роль и место ДШ ОА в диагностике ОА до настоящего времени так и не определены с точки зрения стандартизации диагностики ОА, что резко ограничивает их использование в практической медицине.
Так в «Национальных клинических рекомендациях по диагностике и лечению острого аппендицита» Российского общества хирургов [11] изложен рутинный подход к диагностике ОА, а понятие ДШ ОА отражено лишь как дополнительная возможность для хирурга по диагностике ОА с указанием устаревшей клинической ДШ ОА Alvarado.
При кажущемся сходстве разработанных ранее ДШ ОА, представляющих собой перечень отобранных авторами симптомов ОА с присвоенной им балльной оценкой, их создание было основано на различных методологических подходах.
До настоящего времени не были разработаны единые методологические требования к формированию ДШ ОА, позволяющие осуществлять их дальнейшее совершенствование и производить сравнительную оценку.
Несмотря на обилие литературы по диагностике и лечению ОА критерии «удовлетворительности» результатов применения ДШ ОА до настоящего времени не сформулированы.
В создание всех ДШ ОА были заложены устаревшие представления об ОА, в связи с чем авторами приводятся резко завышенные оценочные показатели их клинической эффективности за счет выполнения аппендэктомий при недеструктивных формах ОА, которые сами авторы ДШ ОА не считали «напрасными».
При этом широко используемый критерий оценки ДШ ОА в виде учета «напрасных» аппендэктомий никоим образом не отражает само понятие «оправданности» осуществления аппендэктомии на основе дооперационной диагностики ОА, т. к. окончательное решение о необходимости осуществления аппендэктомии принимается на выявленных интраоперационно макроскопических изменениях ЧО. А это не позволяет считать возможным его использование в качестве объективного критерия оценки ДШ.
Разнообразие предложенных ДШ ОА и постоянные попытки их совершенствования указывают на неудовлетворенность результатами при их применении, а учет всех форм ОА с высокими значениями недеструктивных форм ставит под сомнение высокие показатели чувствительности и специфичности в оригинальных исследованиях.
В 1986г. Puylaert впервые предложил и описал метод дозированной компрессии при ультразвуковой (УЗ) диагностике ОА.
ЧО лоцируется, как тубулярная, слепо заканчивающаяся неперистальтирующая структура.
Неизмененный ЧО по данным разных авторов при УЗИ брюшной полости лоцируется в 7–70 % случаев [9,40].
Выделяют следующие УЗ симптомы ОА: симптом «мишени», несжимаемость выявленного ЧО, увеличение максимального наружного диаметра ЧО более 6 мм, утолщение стенки ЧО более 2 мм, наличие копролитов в просвете ЧО и гиперваскуляризация стенки ЧО при цветной допплеровской ультрасонографии [9,14,15] (Рис. 1–4).
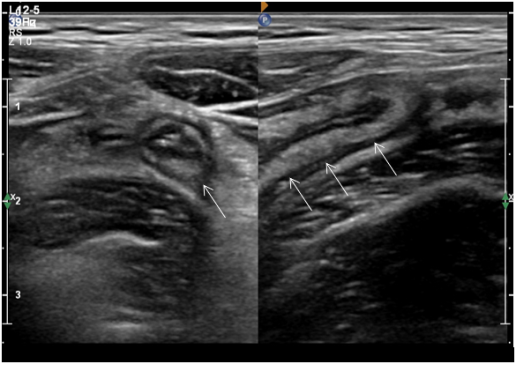
Рис. 1. несжимаемая аперистальтическая тубулярная слепозаканчивающаяся структура (аппендикс)
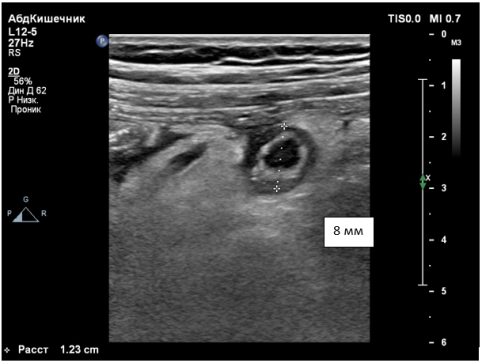
Рис. 2. симптом «мишени», увеличение диаметра ЧО
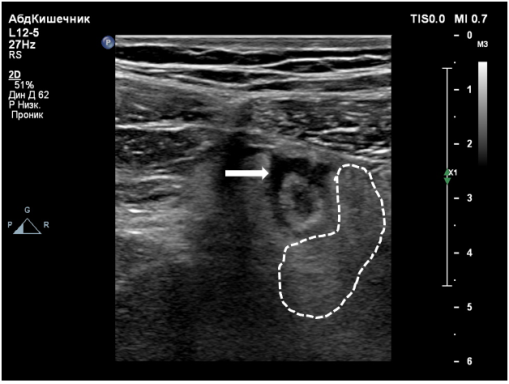
Рис. 3. утолщение периаппендикулярной клетчатки (пунктирная линия), свободная жидкость в брюшной полости (стрелка)
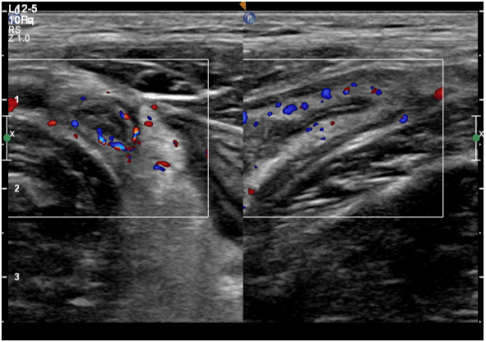
Рис. 4. усиление кровоснабжения стенки ЧО по данным ЦДК
Чувствительность УЗИ при ОА с учетом порогового значения диаметра ЧО 6 мм приближается к 100 %. Тем не менее, специфичность УЗИ при данном пороговом значении весьма низкая и составляет менее 70 % [9].
С целью повышения специфичности УЗИ при ОА отдельные исследователи предлагают в качестве порогового значения учитывать диаметр ЧО в 7 мм. При этом специфичность УЗИ возрастает до 84–88 %, а чувствительность уменьшается до 91,6–94 %.
В. Н. Пискунов [14] определил «серую зону» диаметра ЧО в 6,0–7,3 мм, в которой диаметр ЧО не был достаточен для самостоятельного критерия диагностики ОА. Им рекомендовано осуществлять УЗИ ЧО в цветовом допплеровском режиме.
Кроме представленных основных УЗ симптомов ОА ряд исследователей выделяют также косвенные УЗ признаки ОА, такие как свободная жидкость в правой подвздошной области, жидкость в просвете червеобразного отростка, утолщение периаппендикулярной клетчатки, признаки воспаления слепой кишки, увеличение мезентериальных лимфоузлов [9,14,15].
Yu S.H [59] выполнил большой мета-анализ, в который были включены различные Южнокорейские УЗ исследования брюшной полости с 1985 по 2003 годы. По его данным 22 статьи, включавшие обследование 2643 пациентов, удовлетворили критериям включения. Общая чувствительность и специфичность УЗИ при ОА составили 86,7 % и 90 % соответственно.
По данным Nicolas Kessler et al. [40], ЧО при ОА был визуализирован с помощью УЗИ в 96 %. Авторы утверждают, что неизменённый ЧО был визуализирован у 72 % пациентов с исключенным ОА. Они объясняют этот факт тем, что исследование проводилось опытными специалистами лучевой диагностики, а не УЗ-техниками или хирургами.
По данным систематизированного обзора Carroll P. J., Gibson D. [33], включавшего 8 исследований с обследованием 1268 пациентов, чувствительность и специфичность УЗИ при ОА составили 92 %и96 %соответственно,ибыли сопоставимы с таковыми показателями при УЗИ у пациентов с ЖКБ.
Это исследование представляет интерес тем, что УЗИ брюшной полости осуществляли не врачи ультразвуковой диагностики, а хирурги после специальной подготовки.
Среди отечественных исследователей Пискунов В. Н. и Завьялова Н. Г. [15] указывают, что чувствительность и специфичность УЗИ при ОА составила 80,7 % и 93,4 % соответственно и точность — 93,4 %.
Натрошвили А. Г. [10] оценил эффективность УЗИ в диагностике ОА с атипичной клинической картиной. Чувствительность, специфичность и точность составили 90,3 %, 97,3 % и 96,1 % соответственно. Ниже приведены данные по информативности УЗИ при ОА по данным различных авторов (Таблица 1).
Таблица 1
Результаты УЗИ ЧО при ОА по данным различных авторов
|
Автор |
Количество пациентов |
Чувствительность (%) |
Специфичность (%) |
|
Worrel J. A.,1990 |
200 |
68 |
98 |
|
Chesbrough R. M., 1993 |
236 |
90,1 |
89,3 |
|
Wade D. S., 1993 |
107 |
85,5 |
84,4 |
|
Orr R., 1995 |
3358 |
84,7 |
92,1 |
|
Натрошвили А. Г., 2003 |
246 |
90,3 |
97,3 |
|
Seung-Hum Yu, 2005 |
2643 |
86,7 |
90 |
|
Пискунов В. Н., 2009 |
275 |
80,7 |
93,4 |
В исследовании M. Bondi [32] был оценен подход, сочетающий трансабдоминальное и трансвагинальное УЗИ в сравнении с выполнением только трансабдоминальной ультрасонографии. Чувствительность и специфичность комбинированной методики были 97,3 и 91 % соответственно, точность диагностики по сравнению с трансабдоминальным УЗИ была на 15 % выше
Увеличивая стоимость лечения для отдельного пациента, УЗИ в целом уменьшает затраты на лечение этой категории больных.
Так, японскими исследователями [58] были проанализированы результаты лечения 200 пациентов, поступивших с подозрением на ОА. Всем пациентам наряду с клиническим и лабораторным обследованием выполнялось УЗИ. В результате применения УЗИ удалось избежать 12,5 % «напрасных» аппендэктомий, за счет чего итоговая экономия для больницы составила 40590 $ или 330$ на каждого пациента.
Таким образом, преимуществами УЗИ являются высокая специфичность исследования, низкая стоимость и отсутствие ионизирующего излучения.
УЗИ брюшной полости позволяет диагностировать другую острую патологию, симулирующую ОА, такую как почечную колика, острый холецистит, перекрут кисты яичника и др. При этом осуществление УЗИ при ОА затрудняет наличие у пациентов ожирения, метеоризм, атипичное расположение ЧО.
Однако общепризнанными недостатками УЗИ при ОА являются относительно низкая чувствительность и зависимость результатов исследования от личного опыта исследователя [9].
Использование клинико-соноскопического подхода призвано нивелировать недостатки клинической и соноскопической диагностики по отдельности.
УЗИ в качестве обязательного диагностического метода при подозрении на ОА рекомендовано в Нидерландах [31].
УЗИ рекомендовано в качестве оптимального метода диагностики ОА у детей и беременных женщин в рекомендациях American College of Radiology [50].
Использование УЗИ брюшной полости стало одним из направлений оптимизации ДШ ОА с созданием клинико-соноскопических ДШ ОА.
Так, Charles D.Douglas [36] провел рандомизированное проспективное исследование, в котором для диагностики ОА применялась ДШ Alvarado и УЗИ брюшной полости.
При сумме баллов по ДШ Alvarado в 9–10 баллов больным выполнялась аппендэктомия.
В случае оценки выявленных симптомов в 4–8 баллов, больным дополнительно выполнялось УЗИ ЧО.
В результате исследования им было доказано, что сочетание клинической ДШ ОА и УЗИ брюшной полости достоверно сократило время от момента поступления пациентов в стационар до операции с 10,2 ч в контрольной группе до 7 ч в группе пациентов с УЗИ брюшной полости.
При этом имевшее место сокращение количества необоснованных аппендэктомий 11 % в контрольной группе против 9 % в группе с УЗИ (p=0,59), перфораций ЧО и длительности пребывания в стационаре было недостоверным.
Натрошвили А. Г. и Шулутко А. М. [10] на основании ретроспективного анализа модифицировали ДШ Alvarado, включив в нее показатели УЗИ ЧО. Применение данной ДШ ОА позволило им уменьшить количество необоснованных аппендэктомий с 30,6 % в контрольной группе до 12,3 % в группе исследования.
Tzanakis N. E. [54] разработал ДШ ОА, включающую наряду с клиническими и лабораторными соноскопические показатели.
Это позволило им получить высокие показатели применения ДШ: чувствительность 95,4 %, специфичность 97,4 %, точность 96,5 %.
В нерандомизированном исследовании, выполненном Sigdel G. S. [51], ДШ ОА Tzanakis оказалась значительно менее информативной. Ее чувствительность и специфичность составили 91,48 % и 66,66 % соответственно.
Авторы связывают такие результаты с относительно низкой чувствительностью УЗИ ЧО (63,82 %), что значительно ниже полученных показателей в ранее опубликованных исследованиях.
Анализ клинической эффективности ранее предложенных ДШ ОА так же показывает, что она основана на устаревших представлениях об ОА и необоснованно расширенных показаниях к осуществлению лапаротомии и аппендэктомии.
Так в оригинальной статье Alvarado [26] у 108 из 227 (47,6 %) оперированных пациентов был установлен патогистологический диагноз простого ОА.
При разработке ДШ ОА Tzanakis в группе оценки разработанной ДШ ОА у 70 из 130 (53,8 %) оперированных пациентов так же был установлен патогистологический диагноз простого ОА [54].
Такие результаты применения ДШ ОА никоим образом не могут считаться приемлемыми в современных условиях диагностики и лечения ОА.
В 2014г. на основании оригинальных алгоритмов формирования и сравнения (структурный и функциональный анализ) ДШ ОА была создана оригинальная клинико-соноскопическая диагностическая шкала острого деструктивного аппендицита (КСШ ОДА) (Патент RU 2 587 649 C1) (Табл. 2).
Таблица 2
Оригинальная КСШ ОДА
|
№ |
Признак |
Оценка |
Баллы |
|
Клинические признаки |
|||
|
1 |
Симптом Кохера |
Положительный |
1,5 |
|
2 |
Тошнота и/или рвота |
Есть |
1 |
|
3 |
Симптом Щёткина-Блюмберга в правой подвздошной области |
Положительный |
1,5 |
|
4 |
Симптом Бартомье-Михельсона |
Положительный |
1,5 |
|
Лабораторные признаки |
|||
|
5 |
Лейкоцитоз ≥10*109/л |
Положительный |
1,5 |
|
УЗ признаки |
|||
|
6 |
Неизмененный ЧО и/или другая патология |
Выявлено |
-3 |
|
7 |
Увеличение диаметра ЧО > 7мм |
Выявлено |
2 |
|
8 |
Несжимаемость ЧО |
Выявлено |
1 |
|
9 |
Утолщение периаппендикулярной клетчатки |
Выявлено |
1 |
|
10 |
Копролит в просвете ЧО |
Выявлено |
1 |
|
Итого |
Max |
12 |
|
|
Min |
-3 |
||
Алгоритм использования этой КСШ ОДА носит этапный характер и проводится следующим образом [5].
При поступлении в стационар пациентов с подозрением на ОДА им проводится общеклиническое обследование с последующей оценкой клинических и лабораторных факторов КСШ ОДА.
Далее производится последовательное суммирование полученных клинических, лабораторных и ультразвуковых баллов выявленных положительных признаков КСШ ОДА.
Если при суммировании баллов положительных клинических и лабораторных признаков ОДА получается сумма в 6–7 баллов — устанавливается диагноз ОДА.
Проведение дополнительного УЗИ не требуется, так как даже выявление признаков другой острой патологии и/или ЧО без признаков воспаления, по данным УЗИ («минус» 3 балла), не повлияет на результат интерпретации КСШ (окончательная сумма баллов будет 3 и более, что указывает на наличие ОДА). Пациенту устанавливается диагноз ОДА.
При сумме баллов клинической и лабораторной части КС ДШ ОДА менее 6, проводится УЗИ брюшной полости с дополнительным учетом соноскопических признаков КС ДШ ОДА.
При получении общей балльной оценки ультразвуковых признаков ОДА <2,5 баллов — диагноз ОДА исключается.
При получении общей балльной оценки ультразвуковых признаков ОДА 3 балла и более — диагноз ОДА высоковероятен и показано выполнение аппендэктомии.
При присвоении общей балльной оценки ультразвуковых признаков ОДА в 2,5 балла диагноз ОДА возможен. Показано проведение лапароскопии.
Были получены следующие результаты оценки эффективности оригинальной КСШ ОДА: чувствительность — 94,1 %, специфичность — 73,8 %, точность — 79,6 %, размер «серой зоны» — 7,7 %, доля ОДА «серой зоны» от общего количества ОДА — 2 %, доля недиагностированных случаев ОДА — 3,9 %.
Сравнительный анализ КСШ ОДА и нестандартизованной клинико-соноскопической диагностики показал статистически значимую большую чувствительность КСШ ОДА (ƛ2 = 4,32; p <0,05), меньший размер «серой зоны» у КСШ ОДА (ƛ2 = 5,28; p<0,05) и меньшую долю случаев ОДА «серой зоны» от общего количества случаев ОДА (ƛ2 = 4,9; p <0,05).
Остальные показатели сравнения, такие как специфичность, точность, доля пропущенных случаев ОДА имели более высокие значения, но не показали статистически значимых различий при данных подходах. Тем не менее, отмечалась тенденция к более высокой специфичности и точности КС ДШ ОДА.
Авторами была проведена оценка показателей эффективности оригинальной КСШ ОДА в субпопуляциях с такими выделенными «факторами риска» клинической диагностики ОДА как возраст, ожирение, женский пол и атипичное расположение ЧО.
Применение оригинальной КСШ ОДА для выделенных субпопуляций не показало статистически значимых различий показателей эффективности с таковыми для универсальной популяции (p >0,05).
Чувствительность КСШ ОДА при типичном расположении ЧО составила 97 %, при атипичном — 94,1 % (ОШ 2,0; 95 % ДИ 0,12–34,1; p>0,05).
В результате сравнительного анализа оригинальной КСШ ОДА и ДШ ОА Alvarado было отмечено, что оригинальная КСШ ОДА показала статистически значимо большую чувствительность и меньшее количество недиагностированных случаев ОДА в сравнении с ДШ ОА Alvarado. Размер «серой зоны» оригинальной КС ДШ ОДА была статистически значимо меньше данного показателя ДШ ОА Alvarado (p<0,001). Встречаемость ОДА у пациентов в «серой зоне» не показала статистически значимых различий (p>0,05). Однако, доля ОДА «серой зоны» от общего количества ОДА при применении оригинальной КСШ ОДА статистически значимо было меньше (p<0,001). Специфичность и точность диагностики при сравниваемых подходах не показала статистически значимых различий (p>0,05) оригинальной КСШ ОДА с ДШ Alvarado.
В таблице 3 представлены данные по информативности и особенностям применения разработанных в настоящее время клинико-соноскопических ДШ ОА по данным их авторов.
Таблица 3
Показатели информативности иусловия применения клинико-соноскопических ДШ ОА (по данным авторов)
|
Шкала |
Методы Обследования |
Чувствительность,% |
Специфичность,% |
Точность,% |
Недеструктивный ОА,% |
|
Tzanakis 2005 |
- Клинический осмотр — Общий анализ крови — УЗИ |
95.4 |
97.4 |
96,5 |
53,8 |
|
Натрошвили, Шулутко 2010 |
- Клинический осмотр — Общий анализ крови — УЗИ |
87 |
96,7 |
91,3 |
Нет выделения форм ОА |
|
КСШ ОДА, 2014 |
- Клинический осмотр — Общий анализ крови — УЗИ |
94,1 |
73,8 |
79,6 |
Не учитывался. Направленность на диагностику ОДА |
Как видно, в ДШ Tzanakis при ее использовании заложено до 53,8 % недеструктивных форм от общего количества удаленных ОА. Авторами ДШ Натрошвили не проводилось выделение ОДА и недеструктивных форм, таким образом долю удаленных недеструктивных ЧО при использовании данной ДШ нельзя предугадать. Из представленных ДШ лишь КСШ ОДА имеет направленность только на диагностику ОДА, что является приоритетным для хирургов.
Заключение
Современная диагностика острого аппендицита должна быть направлена на выявление его деструктивных форм. Клинико-соноскопические диагностические шкалы острого деструктивного аппендицита являются научно обоснованными диагностическими стандартами острого аппендицита. Ранее предложенные клинические и клинико-соноскопические диагностические шкалы острого аппендицита не направлены на выявление его деструктивных форм, и высокие показатели клинической их эффективности обусловлены значительным количеством (до 53,8 %) учитываемых случаев недеструктивных форм острого аппендицита. Предложенная оригинальная КСШ ОДА направлена на диагностику деструктивных форм ОА и показала свою статистически значимую более высокую клиническую эффективность в сравнении с нестандартизованным клинико-соноскопическим методом диагностики ОА и ДШ Alvarado.
Литература:
- Гринберг, А. А. Неотложная абдоминальная хирургия: справочное пособие для врачей / А. А. Гринберг. — М.: Триада-Х, 2000. — 496 с.
- Еланский Н. Н. Нейрорефлекторная теория происхождения аппендицита / Н. Н. Еланский // Военно-медицинский журнал. — 1952. — № 27. — С. 8–13.
- Зонненбург, Э. Патология и терапия перитифлита: (appendicitis simplex et appendicitis perforativa): руководство для врачей и студентов / Э. Зонненбург; пер. с 3-го нем. изд. А. Г. Абрамовича. — Санкт-Петербург: типо-лит. И. А. Литвинова, 1899. — 130 с.
- Калитеевский, П. Ф. Болезни червеобразного отростка: монография / П. Ф. Калитеевский. — М.: Медицина, 1970. — 204 с.
- Каминский М. Н., Вавринчук С. А. Сравнительная оценка и оптимизация диагностических шкал острого аппендицита // Молодой ученый. — 2017. — № 42.
- Касимов, Р. Р. Интегральная диагностика острого аппендицита/ Р. Р. Касимов, А. С. Мухин // Современные технологии в медицине. — 2012. — № 4. — С. 112–114.
- Колесов, В. И. Клиника и лечение острого аппендицита: монография /В. И. Колесов. — Л.: Медицина, — 1972. — 290 с.
- Корита, В. Р. Острый аппендицит при атипичном расположении червеобразного отростка: монография / В. Р. Корита. — Хабаровск: Издательство ДВГМУ, 2005. — 220 с.
- Кулезнева, Ю. В. Ультразвуковое исследование в диагностике и лечении острого аппендицита: практическое руководство / Ю. В. Кулезнева, Р. Е. Израилов, З. А. Лемешко — Москва: ГЭОТАР-Медиа, 2014. — 72 с.
- Натрошвили, А. Г. Результаты применения модифицированной диагностической шкалы у больных острым аппендицитом / А. Г. Натрошвили, А. М. Шулутко // Хирургия. — 2010. — № 8. — С. 24–27.
- Национальные клинические рекомендации по диагностике и лечению острого аппендицита [Электронный ресурс] / А. В. Сажин, И. И. Затевахин, А. В. Федоров, О. Э. Луцевич, А. М. Шулутко, А. С. Ермолов, А. А. Гуляев, М. И. Прудков, К. В. Лядов // 2016. — Режим доступа: http://xn----9sbdbejx7bdduahou3a5d.xn--p1ai/stranica-pravlenija/unkr/urgentnaja-abdominalnaja-hirurgija/ostryi-apendicit.html.
- Нифантьев, О. Е. Острый аппендицит: монография / О. Е. Нифантьев. — Красноярск: Изд-во Красноярского ун-та, 1986. — 168 с.
- Образцов, В. П. Клинические формы воспаления червеобразного отростка / В. П. Образцов // Врач. — 1895. — № 20. — С. 549–553.
- Пискунов, В. Н. Возможности ультразвукового исследования в диагностике различных форм острого аппендицита и его осложнений: дис....канд. мед. наук: 14.01.13 / Пискунов Виталий Николаевич. — Томск, 2010. — 144 с.
- Пискунов, В. Н. Ультразвуковая диагностика острого аппендицита / В. Н. Пискунов, В. Д. Завадовская, Н. Г. Завьялова // Бюллетень сибирской медицины. — 2009. — № 4. — С. 140–149.
- Русанов А. А. Аппендицит: монография / А. А. Русанов. — Л.: Медицина, 1979. — 187 с.
- Савельев, В. С. Руководство по неотложной хирургии органов брюшной полости / В. С. Савельев, В. А. Петухов, Б. Д. Савчук; под общ. ред. В. С. Савельева. — М.: Изд. «Триада–Х», 2005. — 640 с.
- Слесаренко, С. С. Новые аспекты в диагностике и лечении острого аппендицита/ С. С. Слесаренко, А. Ю. Лисунов // Вестник экспериментальной и клинической хирургии. — 2008. — т. 1, № 1. — С. 37–44.
- Утешев, Н. С. Острый аппендицит: практическое руководство / Н. С. Утешев, Т. А. Малюгина, Т. Н. Богницкая, Г. В. Пахомова. — М.: Медицина, 1975. — 158с.
- Федоровский, А. А. О клиническом и патогистоло- гическом диагнозах острого аппендицита.—В кн.: Аппендицит / А. А. Федоровский, В. Н. Петрушев. — Киев, 1966. — С. 70–73.
- Шапкин, Ю. Г. Эффективность лапароскопии в диагностике острого аппендицита / Ю. Г. Шапкин, Ю. В. Чалык, И. И. Майсков // Эндоскопическая хирургия. — 2008. — № 1. - С. 15–18.
- Шор, Г. B. Острый аппендицит в патологоанатомическом отношении / Г. В. Шор // Вестник хирургии. — I935.- № 240. — С. 34–39.
- Addiss, D. The epidemiology of appendicitis and appendectomy in the United States / D. Addiss // Am. J. Epidemiol. — 1990. — Vol. 132, № 5. — P. 910–925.
- Alnjadat, I. Alvarado versus RIPASA score in diagnosing acute appendicitis / I. Alnjadat, B. Abdallah // Rawal Medical Journal. — 2013. — Vol.38, № 2. — P.147–151.
- Alvarado, A. A practical score for the early diagnosis of acute appendicitis / A. Alvarado // Ann. Emerg. Med. — 1986. -Vol. 15. — Р. 557–564.
- Andersson, M. The Appendicitis Inflammatory Response Score: A Tool for the Diagnosis of Acute Appendicitis that Outperforms the Alvarado Score / M. Andersson, R. Andersson // World J. Surg. — 2008. — Vol. 32.- Р. 1843–1849.
- Andersson, R. Diagnostic value of disease history, clinical presentation, and inflammatory parameters of appendicitis / R. Andersson, A. Hugander // World J. Surg. — 1999. — Vol. 23. — P. 133–140.
- Andersson, R. E. The Natural History and Traditional Management of Appendicitis Revisited: Spontaneous Resolution and Predominance of Prehospital Perforations Imply That a Correct Diagnosis is More Important Than an Early Diagnosis / R. E. Andersson // World. J. Surg. — 2007. Vol. 31. — P.86–92.
- Arnbjornsson, E. Scoring system for computer-aided diagnosis of acute appendicitis. The value of prospective versus retrospective studies / E. Arnbjornsson // Ann. Chir. Gynaecol. — 1985. — Vol. 74. — P. 159–166.
- Bakker, O. J. Richtlijn voor diagnostiek en behandeling van acute appendicitis beeldvorming vóór appendectomie aanbevolen / O. J. Bakker, P. M. Go, J. B. Puylaert // Ned Tijdschr Geneeskd. — 2010. — Vol. 154. — P. 1–4.
- Bondi, М. Improving the Diagnostic Accuracy of Ultrasonography in Suspected Acute Appendicitis by the Combined Transabdominal and Transvaginal Approach / М. Bondi, R. Miller // The American Surgeon. — 2012. — Vol.78. — Р.98–103.
- Carroll, P. J. Surgeon-performed ultrasound at the bedside for the detection of appendicitis and gallstones: systematic review and meta-analysis / P. J. Carroll, D. Gibson // Am. J. Surg. — 2013. — Vol. 205, № 1. — Р. 102–108.
- Chong, C. F. Development of the RIPASA score: a new appendicitis scoring system for the diagnosis of acute appendicitis / C. F. Chong // Singapore Med. J. — 2010. Vol. 51, № 3. — P. 220–225.
- Christian, F. A simple scoring system to reduce the negative appendectomy rate / F. Christian, G. P. Christian //Ann. R. Coll. Surg. Engl. — 1992. — Vol.74. — P. 281–285.
- Douglas, C. D. Randomised controlled trial of ultrasonography in diagnosis of acute appendicitis, incorporating the Alvarado score / C. D. Douglas, N. E. Macpherson // BMJ. — 2000. — Vol. 321. — P.1–7.
- Eskelinen M. A computer-based diagnostic score to aid in diagnosis of acute appendicitis / M. Eskelinen, J.Ikonen // Theor. Surg. — 1992. — № 7. — P. 86–90.
- Flum, D. R. The clinical and economic correlates of misdiagnosed appendicitis: nationwide analysis / D. R. Flum, T. Koepsell // Arch. Surg. — 2002. — Vol. 137. — P. 799–804.
- H. Sitter S., Hoffmann I. Diagnostic score in appendicitis. Validation of a diagnostic score (Eskelinen score) in patients in whom acute appendicitis is suspected / S. H. Sitter, I. Hoffmann // Langenbecks Arch. Surg. — 2004. -Vol. 389. — P. 213–218.
- Kessler, N. Appendicitis: Evaluation of Sensitivity, Specificity, and Predictive Values of US, Doppler US, and Laboratory Findings / N. Kessler // Radiology. -2004. — Vol. 230. — Р. 472–478.
- Konan, A. Scoring systems in the diagnosis of acute appendicitis in the elderly / A. Konan, M. Hayran, Y. Alper Kilic, D. Karakoc, V. Kaynaroğlu // Turkish Journal of Trauma & Emergency Surgery. — 2011. — Vol. 17, № 5. — P. 396–400.
- Lintula, H. A diagnostic score for children with suspected Appendicitis / H. Lintula, E. Pesonen // Langenbecks Arch. Surg. — 2005. — Vol. 390. — Р. 164–170.
- Lintula, H. Diagnostic score in acute appendicitis. Validation of a diagnostic score (Lintula score) for adults with suspected appendicitis / H. Lintula, H. Kokki // Langenbecks Arch. Surg. — 2010. — Vol. 395. — Р. 495–500.
- Luckmann, R. Incidence and case fatality rates for acute appendicitis in California. A population-based study of the effects of age / R. Luckmann // Am. J. Epidemiol. — 1989. — Vol. 129. — P.905–918.
- McBurney, C. The Indications for Early Laparotomy in Appendicitis / C. McBurney // Ann. Surg. — 1891. — Vol. 13, № 4. — P.233–254.
- Ohle, R. The Alvarado score for predicting acute appendicitis: a systematic review / R. Ohle et al. // BMC Medicine. — 2011. — № 9. P. 139.
- Ohmann, C. Diagnostic score for acute appendicitis / C. Ohmann, C. Franke, Q. Yang et al. // Chirurg. — 1995. — Vol. 66. — P. 135–141.
- Ohmann, C. Diagnostic scores for acute appendicitis. Abdominal Pain Study Group / C. Ohmann, Q. Yang, C. Franke // Eur. J. Surg. — 1995. — Vol. 161. — P. 273.
- Phophrom J., The Modified Alvarado Score Versus the Alvarado Score for the Diagnosis of Acute Appendicitis / J. Phophrom, T. Trivej // The THAI Journal of SURGERY. — 2005. — Vol. 26. — P.69–72.
- Rosen, M. P. Expert Panel on Gastrointestinal Imaging. ACR Appropriateness Criteria right lower quadrant pain — suspected appendicitis [Электронный ресурс] / M. P. Rosen, A. Ding, et al. // American College of Radiology. — 2010. — режим доступа: http://guideline.gov/content.aspx?f=rss&id=23816
- Sigdel, G. S. Tzanakis Score vs Alvarado Score in Accute Appendicitis / G. S. Sigdel // J. Nepal Med. Assoc. — 2010. — Vol. 49, № 178. — P. 96–99.
- Subotic, A. M. Evaluation of the Alvarado score in the diagnosis of acute appendicitis / A. M. Subotic, et al. // ACI. — Vol. LV. — P. 55–61.
- Teicher, I. Scoring system to aid in diagnoses of appendicitis / I. Teicher, B. Landa // Ann. Surg. — 1983. — Vol. 198. — Р. 753–759.
- Tzanakis, N. E. A New Approach to Accurate Diagnosis of Accute Appendicitis / N. E. Tzanakis, S. P. Efstathio // Word J. Surg. — 2005. — Vol.29. -P. 1151–1156.
- Van Way, C.W. 3rd A feasibility study of computer aided diagnosis in appendicitis / C. W. Van Way 3rd, J. R. Murphy, E. L. Dunn, et al. // Surg. Gynecol. Obstet. — 1982. Vol. 155. — P. 685–688.
- Wagner, J. Does this patient have appendicitis? / J. Wagner, W. McKinney, J. Carpenter // JAMA. — 1996. — Vol. 276. — P.1589.
- Wilasrusmee, C. Diagnostic Scores for Appendicitis: A Systematic Review of Scores’ Performance / C. Wilasrusmee, T. Anothaisintawee // British Journal of Medicine & Medical Research. — 2014. — Vol. 4, № 2. — P.711–730.
- Yasutomo, Fujii Ultrasonography Improves Diagnostic Accuracy of Acute Appendicitis and Provides Cost Savings to Hospitals in Japan / Fujii Yasutomo, Hata Jiro // J. Ultrasound Med. — 2000. — Vol. 19. — P. 409–414.
- Yu, S. H. Ultrasonography in the diagnosis of appendicitis: evaluation by meta-analysis / S. H. Yu, C. B. Kim // Korean. J. Radiol. — 2005. — Vol. 6, № 4. — Р. 267–277.







