Цель исследования: изучение состояния эндотелия сонной артерии у больных артериальной гипертонией в зависимости от течения заболевания. Обследовано 60 больных с артериальной гипертензией II-III степени, в возрасте 40–60 лет. Обследованные больные были рандомизированы на основе общепринятых критериев на 2 группы: I группу больных составили 31 больных с АГ II-III степени, II группу составили 29 больных с АГ II-III степени и с сахарным диабетом 2 типа. III группу составили 20 добровольцев — относительно здоровых лиц без АГ и СД. Было проведено дуплексное сканирование экстракраниального отдела сонных артерий (СА) на аппарате Philips- SD800 с помощью линейного датчика 7,5 Гц, с оценкой состояния сосудистой стенки, наличия атеросклеротического поражения, скорости кровотока в исследуемом сосудистом регионе. При АГ имеет место ремоделирование сосудов головного мозга, которое выражается в первую очередь в увеличении диаметра общей сонной и внутренней сонной артерий в сравнении с контрольной группой, толщины ТИМ сонных артерий, зависящие от степени повышения АД, наиболее выраженное у пациентов с СД.
Objective: To determine the characteristics of hemodynamic changes of the carotid artery in hypertensive patients depending on the disease. 60 patients with hypertension II-III degree, aged 40–60 years. Surveyed patients were randomized on the basis of generally accepted criteria to 2 groups: I group patients were 31 patients with hypertension degree II-III, II group consisted of 29 patients with hypertension II-III degree and type 2 diabetes. Group III consisted of 20 volunteers — relatively healthy individuals without hypertension and diabetes. duplex scanning of extracranial carotid arteries were held (CA) on Philips- SD800 device with a linear probe of 7.5 Hz, assessing the state of the vascular wall, the presence of atherosclerotic lesions, blood flow velocity in the investigated vascular region. When AH occurs cerebral vascular remodeling, which is expressed primarily in increasing the diameter of the common carotid and internal carotid arteries as compared to the control group, the thickness of IMT of carotid arteries, depending on the degree of increase in blood pressure, most pronounced in patients with diabetes.
В настоящее время артериальная гипертензия (АГ) является одним из важных факторов риска сердечно-сосудистых осложнений. На всех этапах своего становления, независимо от пола и возраста, АГ выступает мощным, но потенциально устранимым фактором риска, оказывающим существенное влияние на показатели заболеваемости и смертности при цереброваскулярных болезнях [1].
АГ является ведущей причиной развитияцереброваскулярной патологии, ежегодно в России возникает около 400 тыс. инсультов, что в четыре раза чаще, чем в США и странах Западной Европы [13]. Проблеме нарушения мозгового кровообращения при АГ посвящено значительное количество исследований. В основном это работы, характеризующие клиническую картину острых и хронических нарушений мозгового кровообращения. Однако, несмотря на накопленный научный материал в изучении патогенеза нарушений мозгового кровообращения при АГ многие вопросы остаются нерешенными. Прогрессирование АГ обусловливает увеличение цереброваскулярного и сердечно-сосудистого риска посредством усиления поражения органов-мишеней [3]. В настоящее время не получен ответ на вопрос, играют ли изменения структуры артериальной стенки первичную роль в возникновении АГ или же они являются ее следствием [15, 17]. В связи с этим целью исследованияявилосьизучения состояние эндотелиясонной артерии у больных артериальной гипертонией в зависимости от течения заболевания.
Материалы и методы исследования
Для реализации поставленной задачи было обследовано 60 больных с артериальной гипертензией II-III степени, в возрасте 40–60 лет. Обследование тематических больных проводили на базе городской клинической больницы № 7 г. Ташкента. Верификация диагноза осуществлялась на основании классификации ВОЗ/МОАГ/ВНОК (1999, 2004); ОНК-VI [5]. Все обследованные больные были рандомизированы на основе общепринятых критериев на 2 группы: I группу больных составили 31 больных с АГ II-III степени, II группу составили 29 больных с АГ II-III степени и с сахарным диабетом (СД) 2 типа. III группу составили 20 добровольцев — относительно здоровых лиц без АГ и СД.
Средний возраст больных в I группе составил 46,9±5,35 лет и 52,47±6,03 года у больных II группы. Длительность заболевания у больных I группы составило 4,05±2,15 лет и у больных II группы 6,71±4,6 лет. Давность сахарного диабета у больных 2 группы составила 2,9±1,72 лет. Группу сравнения составили 20 практически здоровых лиц обоего пола в возрасте от 32 до 54 лет (средний возраст 41,93,42 лет).
Обследованные больные находились на стационарном лечении в отделениях кардиологии городской клинической больницы № 7 г. Ташкента. Всем обследованным больным проводились общеклинические и лабораторно-инструментальные методы исследования. Всем больным ГБ и лицам контрольной группы было проведено дуплексное сканирование экстракраниального отдела сонных артерий (СА) на аппарате Philips- SD800 с помощью линейного датчика 7,5 Гц, с оценкой состояния сосудистой стенки, наличия атеросклеротического поражения, скорости кровотока в исследуемом сосудистом регионе. Исследование проводили после 5-минутной адаптации обследуемого. Позицию датчика не меняли на протяжении всего исследования.
Исследование проводили после 5-минутной адаптации обследуемого. Позицию датчика не меняли на протяжении всего исследования. Вычисляли следующие количественные (линейные и объемные) параметры кровотока в сонной артерии: пиковая систолическая скороcть кровотока (Vs); максимальная конечная диастолическая скорость кровотока (Vd); индекс цереброваскулярной реактивности (ICVR); индекс пульсации (Pi); индекс резистентности (Ri). Изучение морфоструктуры комплекса «интимы-медии» проводили согласно рекомендациям Международного консенсуса по толщине комплекса «интима-медия» [16,17]. Количественную оценку толщины интимо-медиального слоя (ТИМ) выполняли на дистальном участке общей сонной артерии (ОСА) в 1–1,5 см от бифуркации, вне зоны атеросклеротической бляшки по ее задней стенке, усредняя три максимальных измерения. Курсор устанавливался на границе «просвет артерия–интима сосуда» и на границе «медия-адвентиция». Изображение синхронизировали с диастолой. Наличие структурных изменений сонных артерий (СА) документировали на основании выявления начальных атеросклеротических изменений КИМ ОСА в виде его утолщения более 0,09 см и/или атеросклеротических бляшек/стенозов.
Статистическую обработку полученных результатов исследования проводили на персональном компьютере типа IBM PC/AT с использованием пакета стандартной электронной программы «biostatic for Windows, версия 6,0». Параметры описывались в виде М±δ. При распределении значений групповые сравнения количественных переменных проводили с использованием вариационного статистического критерия Стьюдента (t).
Результаты исследования
При анализе состояния кровотока в экстракраниальных артериях было выявлено, что кинетические характеристики потока крови у больных АГ неосложненного течения сопоставимы с показателями здоровых лиц. Суммарная объемная мозговая перфузия у больных АГ была статистически незначимо ниже, чем у здоровых лиц (рис. 1.). Анализ характеристик доплерографии наружных сонных артерий выявил, что скорость кровотока в систолу (VS) — жестко регулируемый показатель, который возрастал в зависимости от возрастания уровня АД, что подтверждает не адекватность механизмов ауторегуляции у пациентов 1 группы с АГ (способность поддерживать мозговой кровоток на постоянном уровне независимо от изменений системной гемодинамики). В частности, было установлено достоверно высокие цифры скорости систолического кровотока у больных 1 группы в отличии от данных КГ (р<0,05). Также установлено статистически недостоверное повышение скорости кровотока в диастолу (VD) и снижение индекса циркуляторного сопротивления (RI), который отражает возрастание периферического сопротивления кровотоку в 1 группе исследования (р>0,05).
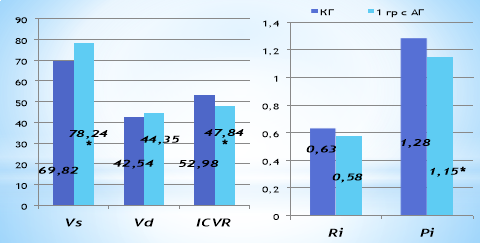
Рис. 1. Характеристика показателей функционального состояния кровотока сонных артерий у больных АГ и КГ. Примечание: * — р<0,05 по отношению к КГ
Индекс пульсации (PI), характеризующий упруго-эластические свойства артерий в 1 группе с АГ был статистически значимо изменен на 11,3 % в отличии от данных КГ(р<0,05). Индекс цереброваскулярной реактивности (ICVR), позволяющий судить о выраженности адаптационных реакций и степени компенсаторных возможностей гемодинамики головного мозга, был статистически значимо снижен на 10,7 % у больных АГ по сравнению с контрольной группой (р<0,05). Вероятно, данные изменения обусловлены тяжестью АГ, что при длительно существующем повышении АД приводит к изменению состояния сосудистой стенки артерий и формированию скрытых нарушений кровотока в магистральных артериях головы.
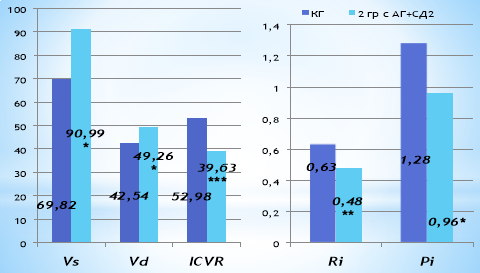
Рис. 2. Характеристика показателей функционального состояния кровотока сонных артерий у больных КГ и АГ+СД2. Примечание: * — р<0,05, ** — р<0,01, *** — р<0,001 по отношению к КГ
Анализ состояния кровотока в сонных артериях между контрольной группы и 2 группы было выявлено, что суммарная объемная мозговая перфузия у больных АГ и СД2 была статистически значимо ниже, чем у здоровых лиц (рис. 2.). Анализ характеристик доплерографии сонных артерий выявил, что скорость кровотока в систолу (VS) достоверно был выше на 30,3 % в группе больных с АГ и СД по отношению к данным контрольной группы, что также указывает на не адекватность механизмов ауторегуляции (р<0,05). Было установлено достоверно высокие цифры скорости диастолического кровотока на 16,7 % у больных 2 группы в отличии от данных КГ (р<0,05).
Выявлено статистически значимое снижение индекса циркуляторного сопротивления (RI) на 31,2 %, который отражает возрастание периферического сопротивления кровотоку во 2 группе исследования (р<0,01). Индекс пульсации (PI), характеризующий упруго-эластические свойства артерий во 2 группе был также статистически значимо изменен на 33,3 % по отношению к КГ (р<0,05). Индекс цереброваскулярной реактивности (ICVR), позволяющий судить о выраженности адаптационных реакций и степени компенсаторных возможностей гемодинамики головного мозга, был статистически значимо снижен на 34,8 % у больных АГ по сравнению с контрольной группой (р<0,01).
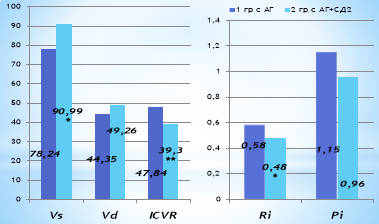
Рис. 3. Характеристика показателей функционального состояния кровотока сонных артерий у больных АГ и СД2. Примечание: * — р<0,05, ** — р<0,01 по отношению к 1 группе
Таким образом, высокие цифры АД, а также наличие СД приводят к возникновению гиперперфузии по основным артериям головного мозга, что в свою очередь способствует возникновению вазоспазма различной тяжести и, возможно, пролиферации гладкомышечного матрикса сосудистой стенки.
Анализ результатов оценки показателей кровотока экстракраниальных сосудов у больных АГ и СД, выявил также статистически значимые нарушения функционального состояния сонных артерий (рис. 3.). В частности, у больных с АГ и СД выявлено статистически достоверное возрастание скорости систолического кровотока на 16,3 % в отличии от пациентов с АГ без осложнений (р<0,05). У больных 1 группы также было выявлено достоверно низкие показатели индекса сопротивления — RI и индекса цереброваскулярной реактивности (ICVR) на 20,8 и 20,5 % соответственно (р<0,05).
В результате проведенного исследования морфофункциональных параметров сонных артерий, выявлены атеросклеротические изменения ОСА (утолщение ТИМ более 0,9 мм) у 24 (82,7 %) больных СД 2 и у 18 (58,4 %) пациентов с АГ без нарушения углеводного обмена.
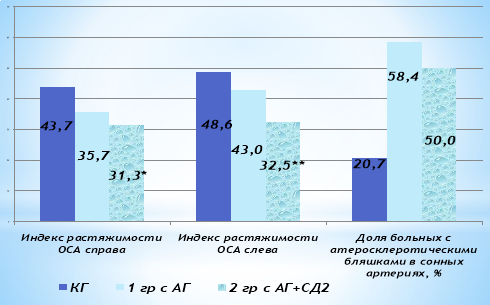
Рис. 4. Морфофункциональные показатели каротидных артерий у больных АГ и СД2. Примечание: * — р<0,05, ** — р<0,01 по отношению к КГ
Однако у больных СД2 достоверно чаще регистрировалось диффузное увеличение ТИМ≥1,3 мм — 44 (45,8 %) больных против 6 (20 %) человек из группы сравнения, что свидетельствует о более выраженном атеросклерозе ОСА при СД. Как представлено в рис. 4., межгрупповых различий медианных значений индекса растяжимости стенки ОСА у больных группы АГ и КГ не выявлено (р>0,05). Однако, было установлено существенное различие индекса растяжимости между данными КГ и 2-й группы исследования были существенно ниже, чем у больных КГ (р<0,05). Это является следствием того, что у больных АГ, ассоциированной с сахарным диабетом, в более ранние сроки, чем у больных АГ без нарушений углеводного обмена, нарушаются упругоэластичные свойства сосудистой стенки, что обусловливает сравнительно меньшую степень пассивного растяжения сосуда в ходе его ремоделирования у диабетических пациентов.
Анализ структурных параметров сонных артерий у пациентов с АГ выявил достоверное увеличение толщины комплекса интимы-медиа (ТИМ) ОСА у больных с АГ (1 группа) на 45,5 % справа и на 35,3 % слева в отличие от данных КГ (р<0,05). В группе больных с АГ+СД2 также отмечается достоверно значимые изменения ТИМ ОСА по сравнению с данными здоровых лиц (р<0,01).
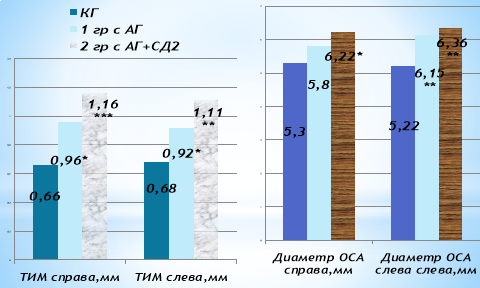
Рис. 5. Морфофункциональные показатели каротидных артерий. Примечание: * — р<0,05, ** — р<0,01 по отношению к КГ
В частности, подтверждением значимых атеросклеротических изменений ОСА служило и достоверное увеличение ТИМ у больных СД2 с АГ — 1,16±0,07мм, по сравнению с больными, имеющими только АГ 0,96±0,08мм (р<0,01) (рис. 5.). Увеличение толщины комплекса интимы-медиа общей сонной артерии также сопровождалось увеличением диаметра сосуда. Было установлено статистически значимое увеличение диаметра сонных артерий у больных с АГ слева на 19,7 % (р<0,01), а также у больных с АГ+СД на 19,2 % (р<0,05) справа (р<0,05) и слева на 21,8 % (р>0,01).
Таким образом, для АГ характерно выраженное снижение реактивности мозговых сосудов и функционального (перфузионного) резерва мозгового кровообращения уже на ранних стадиях развития заболевания, коллатеральный резерв мозгового кровообращения страдает в меньшей степени.
Обсуждение
Нарушение механизма ауторегуляции мозгового кровообращения при АГ проявляется наличием нехарактерной для здоровых коррелятивной связи между величиной артериального давления и скоростью кровотока в средней мозговой артерии [2,7]. Показатель состоятельности мозговой ауторегуляции наиболее чувствительно характеризует степень нарушения ауторегуляции мозгового кровообращения на различных стадиях развития гипертонической болезни. Формирование АГ тесно ассоциируется с прогрессирующим ремоделированием сердца и сосудов, а также ускорением развития системного атеросклероза. Результаты исследования позволили установить, что при АГ имеет место ремоделирование сосудов головного мозга, которое выражается в первую очередь в увеличении диаметра общей сонной артерии (ОСА) и внутренней сонной артерии (ВСА) и толщины интима-медиа (ТИМ) ОСА в сравнении с контрольной группой (р<0,05).
У больных СД2 в сочетании c АГ атеросклеротические изменения ОСА более выражены по сравнению с пациентами, имеющими только АГ. Для оценки характера ремоделирования артерий крупного калибра и состояния механических свойств сосудистой стенки мы изучили у больных группы АГ+СД значения ТИМ и индекса растяжимости ОСА в сравнении с таковыми у сопоставимых по клиническим данным больных группы АГ.
Известно, что СД является важным фактором риска развития ишемического инсульта среди цереброваскулярных заболеваний [16]. Различные изменения сосудистой системы головного мозга у пациентов с СД могут быть причинами развития острой и хронической ишемии головного мозга. Нарушение механизма ауторегуляции мозгового кровообращения при АГ проявляется наличием нехарактерной для здоровых коррелятивной связи между величиной артериального давления и скоростью кровотока в средней мозговой артерии. Показатель состоятельности мозговой ауторегуляции наиболее чувствительно характеризует степень нарушения ауторегуляции мозгового кровообращения на различных стадиях развития гипертонической болезни.
Таким образом, выявлено, что для больных артериальной гипертонией, характерно выраженное снижение реактивности мозговых сосудов и функционального (перфузионного) резерва мозгового кровообращения уже на ранних стадиях развития заболевания, коллатеральный резерв мозгового кровообращения страдает в меньшей степени. У пациентов АГ с наличием СД2 выявляется более выраженное повышение скорости кровотока в диастолу и снижение индекса пульсации и индекса цереброваскулярной реактивности, что свидетельствует о нарушениях тонуса и реактивности сосудов мозга и должно трактоваться как снижение адаптационно-компенсаторных возможностей мозговых артерий. При АГ имеет место ремоделирование сосудов головного мозга, которое выражается в первую очередь в увеличении диаметра общей сонной и внутренней сонной артерий в сравнении с контрольной группой, толщины ТИМ сонных артерий, зависящие от степени повышения АД, наиболее выраженное у пациентов с транзиторной ишемической атакой.
ВЫВОДЫ
- При АГ имеет место ремоделирование сосудов головного мозга, которое выражается в первую очередь в увеличении диаметра общей сонной и внутренней сонной артерий в сравнении с контрольной группой, толщины ТИМ сонных артерий, зависящие от степени повышения АД.
- Для больных артериальной гипертонией характерно снижение реактивности мозговых сосудов и функционального (перфузионного) резерва мозгового кровообращения.
- У пациентов АГ с СД выявляется более выраженное повышение скорости кровотока в диастолу и снижение индекса пульсации и индекса цереброваскулярной реактивности, что свидетельствует о нарушениях тонуса и реактивности сосудов мозга и должно трактоваться как снижение адаптационно-компенсаторных возможностей мозговых артерий.
Литература:
- Агеев Ф. Т., Фомин И. В., Мареев В. Ю., Беленков Ю. Н. Распространенность артериальной гипертонии в Европейской части Российской Федерации. Данные исследования ЭПОХА, 2003// Кардиология. 2004. — № 11. — С. 50–53.
- Алмазов В. А., Алмазов В. А., Арабидзе Г. Г. Профилактика, диагностика и лечение первичной артериальной гипертонии в Российской Федерации // Клинич. фармакология и терапия. 2000. — Т.9, № 3. — С. 5–30.
- Багмет А. Д. Ремоделирование сосудов в норме и при патологии // Кардиология. 2002. — № 3. — С. 40–43.
- Барсуков А. В., Горячева А. А. Клиническое значение признака кинетики кровообращения у пациентов с артериальной гипертензией // Кардиоваскулярная терапия и профилактика. 2005. — Т.4, № 2. — С. 25–34.
- Бритов А. Н., Быстрова М. М. Новые рекомендации Объединенного национального комитета по предупреждению, диагностике и лечению артериальной гипертонии (США): от JNC VI к JNC VII. // Кардиология. -2003.-№ 11.-С. 93–97.
- Верещагин Н. В., Суслина З. А., Максимова М. Ю. Артериальная гипертония и цереброваскулярная патология: современный взгляд на проблему // Кардиология. 2004. — № 3. — С. 4–8.
- Камчатнов П. Р. Дисциркуляторная энцефалопатия некоторые вопросы клиники и терапии // Рус. мед. журн.: РМЖ — 2004. — Т. 12, № 24. — С. 1414–1418.
- Кобалава Ж. Д., Котовская Ю. В., Хирманов В. Н. Артериальное давление в исследовательской и клинической практике / под ред. B. C. Моисеева, Р. С. Карпова. М.: Реафарм. — 2004. — 384 с.
- Кобалава Ж. Д., Котовская Ю. В., Виллевальде С. В. Рекомендации по артериальной гипертонии 2007: текст, контекст и размышления // Кардиология. 2008. — № 2. — С. 72–87.
- Лелюк В. Г., Лелюк С. Э. Ультразвуковая ангиология. Изд. 2-е. -М.: Реальное время, 2003. — 343 с.
- Ультразвуковая доплеровская диагностика в клинике / под ред. Ю. М. Никитина, А. И. Труханова. Москва-Иваново: МИК, 2004. — 491 с.
- Чазова И. Е., Ратова Л. Г., Атауллаханова Д. М. Лечение пациента с артериальной гипертензией и гипертрофией левого желудочка // Consilium medicum. 2006. Прил. 1. — С. 3–6.
- Baumbach G. L., Ghoneim S. Vascular remodeling in hypertension // Scanning Microsc. 1993. — Vol. 7. — P. 137–142.
- Guidelines for the Management of Arterial Hypertension // J. Hypertension. 2007. — Vol. 25. — P.l 105–1187.
- Hojer-Pedersen, E. Effect of acetazolamide on cerebral blood flow in subacute and chronic cerebrovascular disease // Stroke. 1987. — Vol. 18. -P. 887–891.
- 198. Human cerebral venous on flow pathway depends on posture and cerebral venous pressure / J. Oisols, Van S. S. Liesbont, K. Van Kusden et al. // J. Physiol. 2004. — Vol. 560, № 1.-P. 317–327.
- Standing up to the challenge of standing a siphon does not support cerebral blood flow in humans // Am. J. Physiol. Regul. Indegr. Сотр. Physiol. — 2004 Vol. 287. — P. 911–914.







