В настоящей работе охарактеризованы разработанные и апробированные молекулярно-генетические методы анализа полиморфизма микросателлитного локуса FC2054 у собак. Подобраны методы выделения ДНК, оптимальные праймеры для амплификации, определены параметры ПЦР-анализа и электрофореза, позволяющие получать ампликоны различной длины для локуса FC2054.
Ключевые слова: локус, полиморфизм, ампликон
Введение.
Современные собаки произошли от одомашненных волков и филогенетические данные свидетельствуют о том, что предки собак жили в Восточной Азии около 15 000 лет назад. Через генетический дрейф, вызванный тем, что основатели небольших популяций скрещивались с другими псовыми, образовался широкий фенотипический ряд и, таким образом генетическое разнообразие собак, включающее в себя все известные на сегодняшний день, породы. Собаководство во всем мире осуществляется под эгидой кинологических организаций, в чьи функции входит стандартизация пород собак и обеспечение единства критериев развития и экспертизы породы в разных странах. Каждая из названных кинологических организаций имеет собственный список пород собак, а также собственную классификацию пород [1].
При разведении значительного числа пород собак большое внимание кинологами уделяется чистоте породы. В настоящее время для анализа чистоты пород широко используются традиционные методы, такие как анализ родословных и экстерьерных признаков. Точность такого определения зависит от опыта кинолога и возраста собаки. Из-за этих факторов шанс ошибочного определения породы был достаточно велик [2].
Наряду с классическими методами для идентификации пород собак в последнее время успешно применяются молекулярно-генетические методы.Вкачестве генетических маркеров используются полиморфные последовательности нуклеотидов ДНК, которые позволяют тестировать генетический полиморфизм на уровне генотипа. К таким последовательностям относится микросателлитный локус FC2054 [2, 3].
Целью нашей работы было разработать молекулярно-генетический анализ полиморфизма микросателлитного локуса FC2054 у собак.
Характеристика локусаFH2054.
Для исследования мы выбрали локус FH2054, так как он входит в панель локусов для определения пород собак и имеет достаточно большое число аллелей — 12, количество нуклеотидов в повторе — четыре, размер повтора 90–184 н.п.
Исходя из данных, полученых в GenBank мы описали последовательность нуклеотидов, которая включает тандемный повтор:
1 tcatgttccg cagtgctcta ctcatactac ctcagctgtg atcacataaa atgtggtggg
61tctgtgtccg gaaggctcag ctgggttcat tttcactcat tgtcagtgtt atgaagcact
121tgcttgcctt actcattgca gttagggttg taataaaagc agaaactttg gagctattat
181cggaataagt aacgtcaatc ccatctatct atctatctat ctatctatct atctatcta
241tctatctatctatctatctatcatctatctatctatcatctactatctatctatctatct
301atctatctatctatctatctatctatctatctatctatcttacgactca aacaaacttg
361aaagggaaac tcagcatcta ccacttattg gcagtaaaag ttaggaaag tatttaaccc
Как видно из последовательности нуклеотидов, мотив этого повтора ATCT.
Взятие образцов для исследования
Буккальный эпителий.Животное не следует кормить за два часа до проведения процедуры взятия биоматериала, желательна изоляция от других животных. Стерильную ватную палочку взять за конец, на котором отсутствует ватное покрытие. В течение 10 секунд возвратно-поступательными движениями, вращая ватную палочку, собрать клетки эпителия внутренней стороны щеки, при этом стараясь избегать попадания на палочку большого количества слюны. Ватные палочки оставить до полного высыхания при комнатной температуре (1,5–2 часа), после чего поместить в стерильный пакет с замком (зип-пакет) [4].
Волос. Стерильным пинцетом переносят волос на предметный столик микроскопа для оценки наличия эпителиальных клеток влагалища и волосяной сумки, обращая внимание на присутствие на волосе биологических жидкостей. Волос омывают от поверхностной грязи и возможных контаминантов.
Выделение ДНК.
Выделение ДНК мы осуществляли с использованием СТАВ и ионообменной смолы Chelex 100.
Выделение с использованием ионно-обменной смолы Chelex. Основная процедура выделения включает в себя инкубацию образца с протеиназой К и Chelex 100. Очистку от протеинов и ингибиторов ПЦР проводили путем кипячения образца в присутствии Chelex 100. В качестве образца использовали буккальный эпителий и фрагмент корневой зоны длиной 5–10 мм. Над стерильной 1,5 мл пробиркой, отрезали луковицу волоса с 2–3 мм стержня и вносили 200 мкл 5 % взвеси ионообменной смолы Chelex 100. Далее добавляли 2 мкл протеиназы К (10 мг/мл) и осторожно перемешивали. Инкубировали при температуре +56°C, 8 часов, после чего перемешивали в вортексе в течение 5–10 секунд и центрифугировали на микроцентрифуге 20 секунд при 15000 xg. Пробирку с лизатом инкубировали на кипящей водяной бане в течение 8 минут, после чего перемешивали на вортексе в течение 10 секунд и центрифугируют на микроцентрифуге 3 минуты при 15000 xg. Для постановки реакции ПЦР используют супернатант. Остатки супернатанта хранят при температуре 2–8°C или при –20°C (длительное хранение) [3, 4].
Выделение СТАВ–методом. Образец ткани помещали в центрифужные пробирки, содержащие 500 мкл экстрагирующего буфера (2 % р-р СТАВ; 0,1 М р-р Трис; 1,4 р-р NaCl; 20 мМ р-р трилона Б) и проводили гомогенизацию материала в течение 5 минут. Содержимое пробирок перемешивалось на вихревом смесителе (600 мин-1) в течение 10 сек. Далее пробирки помещались в твердотельный термостат и инкубировать в течение 5 мин при Т = 65°C. После в каждую пробирку добавлялось 400 мкл хлороформа (объемное соотношение 1:1).
Содержимое перемешивалось на горизонтальном шейкере в течение 10 мин. и центрифугировалось при 13000xg в течение 10 мин. По 300 мкл супернатанта переносили в новые пробирки, добавляли 210 мкл изопропилового спирта и перемешивали содержимое на вихревом смесителе. Далее пробирки центрифугировали при 13000xg в течение 10 мин. Супернатант сливался, полученный осадок ДНК промывался 1000 мкл 70 % этанола, охлажденным до температуры Т=–10°C. Содержимое пробирок центрифугировать при 5000xg в течение 5 минут. Процедуру промывки повторялись дважды. После последней промывки супернатант сливался, пробирки размещались в штативе с открытыми крышками. Высушенный осадок растворялся в 50 мкл бидистиллированной и деионизированной воды.
Мы провели выделение ДНК двумя вышеописанными способами. Оценку качества и количества экстрагированной ДНК проводили на основании измерения оптической плотности раствора ДНК в области белкового и нуклеинового спектров поглощения.
Результаты оценки чистоты и концентрации ДНК, выделенной из буккального эпителия и волоса с использованием ионно-обменной смолы Chelex и СТАВ-методом приведены в таблице 1.
Таблица 1
Чистота иконцентрация ДНК, выделенной из биологического материала различными методами
|
Метод выделения |
Биологический материал |
|
|
буккальный эпителий |
волос |
|
|
Выход ДНК/Чистота из 1 мг образца |
||
|
Ионообменная смола Chelex |
17,61±1,3/ 1,68±0,07 |
21,37±4,5/ 1,87±0,04 |
|
СТАВ |
45,65±0,06/ 1,54±0,06 |
49,72±5,6/ 1,54±0,08 |
Как видно из таблицы 1, при использовании СТАВ-метода и по чистоте, и по выходу ДНК результаты были примерно одинаковыми для обоих использованных биологических образцов.
Характеризуя выход полученной ДНК необходимо отметить, что наибольшее количество ДНК было получено из обоих биологических образцов при использовании СТАВ-метода.
Анализ чистоты полученной ДНК показал, что наилучшие результаты характерны также для СТАБ метода (буккальный эпителий — 1,54±0,06; волос — 1,54±0,08).
Таким образом, наиболее оптимальным методом по чистоте и концентрации выделенной ДНК является СТАВ-метод, а наиболее подходящим биологическим материалом — буккальный эпителий, так как выделение из него ДНК требует меньше временных и материальных затрат, чем из волоса.
Оптимальные параметры проведения ПЦР иэлектрофореза.
Для анализа полиморфизма мискросателлитного локуса FHC2054 у собак нами была проведена амплификация полученной ДНК с использованием праймеров. Для данного локуса были подобраны и заказаны праймеры следующего состава:
GCCTTATTCATTGCAGTTAGGG — прямой праймер;
ATGCTGAGTTTGAACTTTCCC — обратный праймер.
Для исследования были выбраны 2 породы собак (бассет хаунд и чихуахуа) и один метис овчарки.
Полимеразную цепную реакцию проводили на амплификаторе Терцик в объеме 25 мкл. Были установлены оптимальные термопрофили со следующими значениями: 950С — 11 мин; (940С — 30 с, 560С — 30 с, 720С — 60 с) x 30 циклов; 720С — 10 мин.
Ампликоны выявляли с помощью электрофореза в горизонтальной камере SE-1 Helicon в 2 % агарозном геле с последующей окраской бромистым этидием. Электрофорез проводили в течение 45–60 минут. Ампликоны визуализировали облучением полученных гелевых пластин ультрафиолетом на специальных установках. Полученные электрофоретические спектры представлены на рисунке 1.
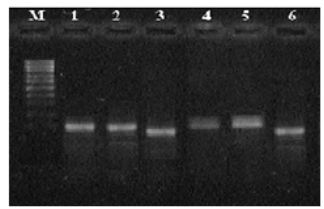
Рис. 1. Результат электрофореза ампликонов в агарозном геле: образцы 1,2 — ампликоны метиса; 3 — бассет хаунд 1; 4.5 — бассет хаунд 2; 6 — чихуахуа; М — маркер молекулярных масс
Как видно из рисунка 1, для представителей разных пород собак характерны ампликоны различной длины: метис — 100 н.п., бассет хаунд — 90, 110 н.п., чихуахуа — 90 н.п.
Таким образом, в результате молекулярно-генетического анализа локуса FC2054 у трех пород собак нами было выявлено три различных аллеля, характеризующих полиморфизм исследованного локуса.
Литература:
- Зорин, В. Л. Породы собак. Энциклопедия. — М.: Институт кормов для домашних животных, 2006. — 62 с.
- Williams J. G. [et al] DNA polymorphisms amplified by arbitrary primers are useful as genetic markers // Nucleic Acids Research. 1990. Vol. № 18 (22). P. 6531–6535.
- Altet L., Francino O., Sánchez A. Microsatellite polymorphism in closely related dogs // J. Hered. 2001. Vol 3. P. 276–279.
- Методические рекомендации по проведению генетического тестирования животных-компаньонов на основе полимеразной цепной реакции / В. А. Лемеш [и др.]. — Минск: Право и экономика. 2014. 62 с.







