Вопрос о модернизации процесса изомеризации, или получения неароматических высокооктановых компонентов бензина – изоалканов, особенно актуален в настоящее время. Одним из направлений модернизации является подбор альтернативных каталитических систем, активных при низких, более благоприятных для процесса температурах [1]. В качестве таких систем можно использовать ионные жидкости – соли органических кислот, состоящие из гетероорганического катиона и неорганического аниона, способные сохранять жидкое состояние при температурах ниже 300 0С [1-4].
Целью работы является обоснование целесообразности применения ионных жидкостей в качестве катализаторов в нефтяной промышленности. Для ее достижения были поставлены следующие задачи: синтез ионных жидкостей, исследование их физико-химических свойств и проведение реакции изомеризации н-гексана в присутствии ионной жидкости.
Для синтеза триметиламин гидрохлорида – хлорида алюминия было взято 2,320 г триметиламин гидрохлорида и, поскольку при анализе литературы было установлено, что ионные жидкости проявляют свои сверхкислотные свойства при мольном соотношении органической соли к неорганическому галогениду 1:2 [5], 6,487 г хлористого алюминия, а для синтеза триэтиламин гидрохлорида – хлорида алюминия 3,000 г триэтиламина гидрохлорида и 5,818 г безводного хлорида алюминия.
Синтез ионных жидкостей происходил по механизму кватернизации N-алкилгалогенпроизводного с галогенидами металла [6, 7] в бюксе без доступа влаги. Реакция взаимодействия веществ протекала с высокой скоростью, с выделением тепла. Наблюдалось образование прозрачной жидкости уже в первые секунды реакции. Для достижения однородной консистенции полученной смеси ее перемешивали с помощью магнитной мешалки в течение часа.
В результате было получено 8,807 г ТМАГХ-AlCl3 и 8,818 г ТЭАГХ-AlCl3.
C3H9N∙HCl + AlCl3 → C3H9NAlCl4¯ + H+
C6H15N∙HCl + AlCl3 → C6H15NAlCl4¯ + H+
Для выявления наиболее подходящей для использования в качестве катализатора ионной жидкости были изучены их физико-химические свойства и определена термическая устойчивость.
Плотности ионных жидкостей, измеренные пикнометрическим методом, равны соответственно 1,436 г/см3 и 1,251 г/см3 для триметиламин гидрохлорида – хлорида алюминия и триэтиламин гидрохлорида – хлорида алюминия.
Вязкость ионных жидкостей, измеренная методом капиллярной вискозиметрии равна 162,4713 мПа·с для триметиламин гидрохлорида – хлорида алюминия и 105,1761 мПа·с для триэтиламин гидрохлорида – хлорида алюминия.
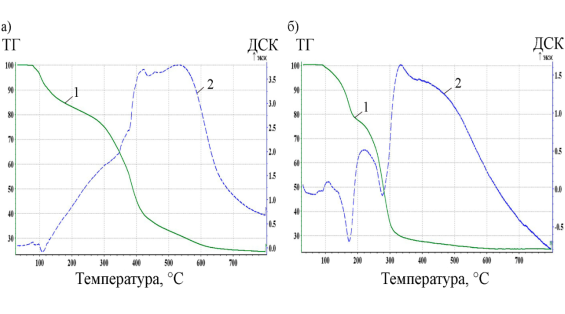
Рис. 1. Кривые термогравиметрического анализа (1) и дифференциальной сканирующей калориметрии (2): а) ТМАГХ-AlCl3 б) ТЭАГХ-AlCl3
Анализ термической устойчивости проводили с помощью дифференциального сканирующего калориметра STA 409 PC Luxx фирмы Netzsch с карбид кремниевой печью. Измерение термической устойчивости осуществляли в керамических тиглях, продувка воздухом в рабочей камере составляла 50мл/мин, скорость нагрева составляла 10 К/мин, нагрев проводили до 700°С.
Обе ионные жидкости следует использовать при температурах до 100 0С, но ТМАГХ-AlCl3 при перегреве показал большую термическую устойчивость, то есть его каталитическая активность будет снижаться медленнее при повышении температуры (рис. 1). Поэтому именно эту ионную жидкость использовали в качестве катализатора процесса изомеризации.
Каталитическую изомеризацию н-гексана проводили в реакторе периодического действия из нержавеющей стали марки 12Х18Н10Т, представляющем собой цилиндрический сосуд с закручивающейся крышкой. Реактор перед проведением эксперимента прокаливали в сушильном шкафу, затем охлаждали и продували азотом для минимизации воздействия атмосферной влаги на каталитическую систему. В реактор загружали свежеприготовленную каталитическую систему, представляющую собой ионную жидкость ТМАГХ-AlCl3 (8,807 г) и субстрат в виде н-гексана в объеме 15 мл. Реактор еще раз продували азотом, затем герметично закрывали и для равномерного прогревания по всему объему опускали в масляную баню. Контроль температуры осуществляли с помощью термопары с регулятором температуры. Изомеризацию проводили при трех разных температурах: 60 °С, 80 °С и 100 °С и времени процесса 3 часа. По окончании заданного времени реактор охдаждали, после чего проводили отбор жидкой фазы. Процесс изомеризации осуществлялся при постоянном перемешивании катализатора и субстрата с помощью якоря магнитной мешалки.
Анализ продуктов реакции осуществляли с помощью газового хроматографа Shimadzu GC-2010 Plus. Анализ изомеризата, полученного в результате проведения процесса, проводили по ГОСТ Р 52714-2007 «Бензины автомобильные. Определение индивидуального и группового углеводородного состава методом капиллярной газовой хроматографии» [8].
По результатам проведенного эксперимента можно судить о том, что максимальные конверсия н-гексана (табл.2) и выход разветвленных алканов с высокими октановыми числами достигаются при температуре 80 °С. При изомеризации образца при 100 °С, выход изомеров значительно снизился, что говорит о начале распада каталитической системы (табл. 1).
Таблица 1
Сводная таблица хроматографического анализа изомеризата
|
Название компонента |
Выход веществ, % масс |
|||
|
н-гексан |
60°С |
80°С |
100°С |
|
|
Изобутан |
- |
11,2 |
14,2 |
4,6 |
|
н-Бутан |
- |
1,5 |
1,8 |
1,29 |
|
Изопентан |
- |
7,7 |
13,4 |
3,4 |
|
н-Пентан |
- |
1,3 |
2,27 |
0,6 |
|
2,2-диметилбутан |
- |
2,1 |
2,9 |
0,6 |
|
Циклопентан |
- |
1,2 |
2,6 |
0,7 |
|
2-метилпентан |
- |
3,5 |
7,7 |
1,9 |
|
3-метилпентан |
- |
1,8 |
3,9 |
1,0 |
|
н-Гексан |
99,26588 |
67,2 |
46,6 |
81,8 |
|
2,2-диметилпентан |
- |
0,2 |
0,25 |
0,1 |
|
2,4-диметилпентан |
- |
0,3 |
0,8 |
0,1 |
|
2,2,3-триметилбутан |
- |
0,1 |
0,3 |
0,1 |
|
3,3-диметилпентан |
- |
0,1 |
0,3 |
0,03 |
Таблица 2
Результаты каталитического действия ИЖ
|
Температура реакции, °С |
Конверсия, % масс. |
Выход изоалканов, % |
|
|
i-C4 |
i-C5 |
||
|
60 |
32,8 |
11,2 |
7,7 |
|
80 |
53,3 |
14,2 |
13,4 |
|
100 |
18,2 |
4,6 |
3,4 |
Выводы:
- На основании проведенных экспериментальных исследований подтверждена целесообразность применения ионных жидкостей в качестве катализаторов процесса изомеризации легких бензиновых фракций. следует отметить основные преимущества ионных жидкостей по сравнению с используемыми в настоящее время катализаторами: экологичность, возможность многократного использования; относительно низкая стоимость по сравнению с катализаторами на основе благородных металлов, высокая энергоэффективность и экономичность, которая обусловлена низкими температурами проведения процесса и, следовательно, низкими затратами на электроэнергию.
- Экспериментально исследована и измерена плотность ионных жидкостей, равная 1,436 г/см3 для ТМАГХ-AlCl3 и 1,251 г/см3 для ТЭАГХ-AlCl3.
- Измерена вязкость ионных жидкостей, равная 162,4713 мПа·с для ТМАГХ-AlCl3 и 105,1761 мПа·с для ТЭАГХ-AlCl3.
- По результатам термического анализа была выявлена наиболее подходящая для использования в качестве катализатора ионная жидкость – ТМАГХ-AlCl3
-
Изучено каталитическое действие ионной жидкости на примере изомеризации н-гексана. При проведении испытаний было показано, что каталитические системы на базе ионной жидкостьи ТМАГХ-AlCl3 доводят конверсию н-гексана до 53,34 % при температуре 80
 .
.
Литература:
- Маликов, И. В. Каталитическая изомеризация углеводородов в присутствии носителей, модифицированных ионными жидкостями: автореф. дис. на соискание ученой степени канд. тех. наук: Маликов Илья Владимирович. – Уфа, 2015. – 100 с.
- Ибрагимов, А. А. Изомеризация легких алканов в присутствии ионной жидкости/ А. А. Ибрагимов, Э. Р. Газизова, Л. А. Панчихина // Башкирский химический журнал. – У., 2013. – Том 20. № 1 – 6 с.
- Асланов, Л. А. Ионные жидкости в ряду растворителей / Л. А. Асланов, М. А. Захаров, Н. Л. Абрамычева. – М.: Изд-во МГУ, 2005. – 272 с.
- Ягфарова, А. Ф. Изомеризация на ионных жидкостях/ А. Р. Габдрахманова, Л. Р. Минибаева, И. Н. Мусин // Вестник Казан. технол. ун-та. – 2012. – С. 192-196.
- Ибрагимов, А. А. Разработка технологии изомеризации алканов С5-С6 в присутствии хлоралюминатной ионной жидкости: автореф. дис. на сискание ученой степени канд.тех. наук: Ибрагимов Азамат Айдарович. – Уфа., 2013. – 100 с.
- Бурмистр, М. В. Современное состояние и основные тенденции развития перспективных ионных жидкостей. Вып. 1/ М. В. Бурмистр, О.С. Свердликовская, О. М. Бурмистр, О. А. Феденко. – 2012. – 100 с.
- Кустов, Л. М. Ионные жидкости- прорыв в новое измерение? / Л. М. Кустов // Химия и жизнь. – 2007. – №11. – С. 1-12.
- ГОСТ Р 52714-2007. Бензины автомобильные. Определение индивидуального и группового углеводородного состава методом капиллярной газовой хроматографии. – Введ. 2008-01-01. ‒ М.: Стандартинформ, 2007. ‒ 23 с.







