Цереброваскулярные заболевания являются частой причиной развития острого нарушения мозгового кровообращения. Кроме того, инсульт — основная причина стойкой инвалидизации, так как более 52 % этих больных нуждаются в посторонней помощи и уходе. Риск повторных ишемических событий у пациентов после ишемического инсульта (ИИ) развивается не менее чем у 25 % пациентов, выживших после первичного нарушения мозгового кровообращения. По некоторым данным, вероятность повторного ИИ в 15 раз превышает вероятность развития первичного ИИ среди лиц того же пола и возраста. При этом максимальный риск отмечается в 1-й год после перенесенного инсульта (1). Поэтому уже с первых часов ИИ необходимо начинать мероприятия, направленные на вторичную профилактику повторных ОНМК. Как известно, к вторичной профилактике инсультов относится коррекция образа жизни с целью воздействия на корригируемые факторы риска сосудистых событий и медикаментозная терапия имеющихся сердечно-сосудистых заболеваний.
Как известно, причины острых и хронических нарушений мозгового кровообращения едины. Основными этиологическими факторами являются атеросклероз и артериальная гипертензия, а чаще всего их сочетание. Исключительно важна также роль факторов, способствующих повышению свертывающих свойства крови и увеличению агрегации её форменных элементов. Так же, на развитие инсульта влияет и аномалия сосудов: головного мозга, шеи, плечевого пояса, аорты, которые практически не проявляются до развития в этих сосудах атеросклеротического, гипертонического или приобретенного патологического процесса (4).
Актуальность данной научной работы заключается в качестве разработки обязательных мероприятий проведения вторичной профилактики повторных ОНМК и проведение медикаментозной терапии с коррекцией имеющихся неврологических расстройств.
Целью данного исследования явилось проведение клинико-инструментального мониторинга в восстановительном периоде ишемического инсульта и разработка тактики коррекции нарушений с дальнейшей оценкой эффективности проводимого лечения под контролем показателей церебральной гемодинамики.
Данная научная работа проводилась на базе ЛКЦТ им. С. Ниязова в отделении неврологии и интенсивной терапии. Под нашим наблюдением находилось 110 больных перенесших ИИ в возрасте 50 и выше лет, среди них 60 женщин и 50 мужчин (таб.1). Основной процент (42 больных) пришелся на возрастную группу (60–69 лет) относительно трудоспособного возраста.
Таблица 1
|
Возраст пол |
50–59 лет |
60–69 лет |
70-79 лет |
80 и более |
|
мужской |
7 |
18 |
20 |
5 |
|
женский |
12 |
24 |
21 |
3 |
|
процент |
17,3 |
38,1 |
37,3 |
7,3 |
В процессе лечения нами было выявлено, следующее течение инсульта:
- Благоприятное регредиентное с полным восстановлением утраченных функций; регредиентное с четким регрессом неврологического дефицита в сочетании с остаточными явлениями (48 больных);
- Ремиттиррующее с эпизодами ухудшения состояния, обусловленного как повторными расстройствами мозгового кровообращения, так и сопутствующими соматическими заболеваниями (54 больных);
- Прогрессирующее (проградиентное) с неуклонным нарастанием симптоматики, нередко с летальным исходом (8 больных). В графике № 1 изображены варианты течения инсульта.
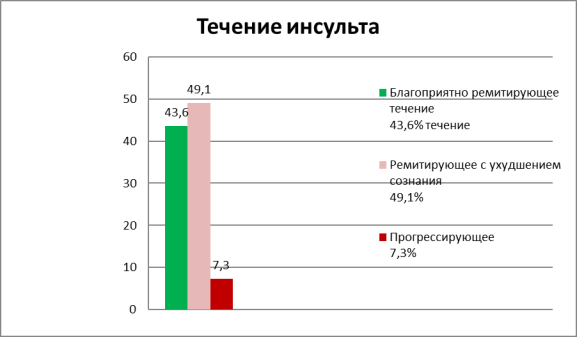
Рис. 1.
К основным этиологическим факторам приведших к развитию инфаркта мозга явились: атеросклероз (21), артериальная гипертензия (34), сахарный диабет (16), болезни сердца (9), нарушение сердечного ритма (6) и сочетание нескольких факторов (44). Практически у всех этих больных регистрировалось появление гипертензивных кризов с клиническими симптомами поражения мозга: головокружение, головная боль, мелькание мушек перед глазами, иногда тошнота.
Согласно концепции патогенетической разнородности ИИ данное неврологическое заболевание не является самостоятельным заболеванием, но представляет собой осложнение других сердечно-сосудистых заболеваний. И так зная, что ишемический инсульт представляет собой гетерогенный синдром, мы всех больных согласно Международной классификации TOAST разделили на: макрососудистые (атеротромботический и кардиоэмболический), микрососудистые (лакунарные), недифференцированные (сочетание двух и более факторов) и редкие (в результате травмы, воспаления и расслоение артерий) формы. (рис. 2)
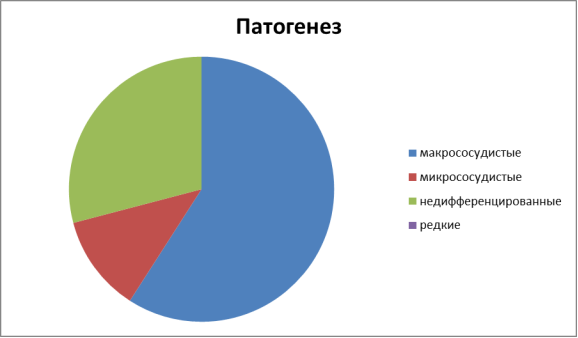
Рис. 2.
Кроме того, пациенты были разделены на две группы: первую (основную) составили 88 больных, которые на фоне гипотензивной терапии принимали индивидуально подобранную терапию Нитоп в дозе 90 мг и Ноофен в дозе 500 мг в сутки (с целью предотвращения фатальных поражений органа-мишени-мозговой ткани, улучшения локального кровотока в сосудах и нормализации взаимодействия между системами нейротрансмиттеров); вторую (группу сравнения) составили 22 больных, которые принимали только антигипертензивную терапию и метаболики. Обе группы были сопоставимы по возрасту, полу и тяжести заболевания. Этиологическую терапию всем больным назначали индивидуально, в соответствии с клиническим течением заболевания и данными объективного обследования. Всем больным из назначения были исключены антагонисты кальция, так как Нитоп (нимодипин) является производным 1,4-дигидропиридин. Антиастеническое средство (Ноофен) обладает ноотропным и вегетостабилизирующим эффектом, восстанавливая и активируя взаимодействие между системами нейротрансмиттеров.
Учитывая, что перенесенный инсульт свидетельствует о наличии у пациента декомпенсации сердечно-сосудистого заболевания. Мы в период наблюдения за больными проводили врачебный осмотр (мониторинг неврологического и соматического статуса), стандартное клиническое обследование (с определением показателей: гемостаза, глюкозы крови и липидного спектра). В соответствии международным стандартам при постановке диагноза ОНМК проводилось КТ/МРТ головного мозга, а также инструментальное обследование (ЭКГ, Эхо КГ, допплерография).
В основной группе все пациенты хорошо переносили прием Нитопа и Ноофена длительно, побочных реакций не выявлено, оснований для отмены препаратов не возникло. В обеих группах при наблюдении выявлено улучшение самочувствия больных: снизилась частота головных болей в среднем на 80,5 %, головокружение-68,8 % и ощущение шума в голове-64 %. Большинство больных отметили уменьшение утомляемости, улучшение сна и памяти. По субъективной оценке состояние пациентов в обеих группах изменилось сходным образом, можно отметить недостоверную тенденцию к более выраженному снижению частоты симптомов (головные боли, головокружение, шум в голове) в основной группе-85;72 и 64 % по сравнению с 79;67и 62 % соответственно. В неврологическом статусе, только в основной группе, отмечалось уменьшение выраженности атаксии, интенционного тремора при выполнении координаторных проб, а также пирамидных нарушений.
В исследовании было выявлено преобладание снижения систолического артериального давления (САД) и диастолического артериального давления (ДАД) в основной группе (16,8 и 16,9 % в первой; 12,1 и 10,5 % во второй группе). По данным электрокардиографии (ЭКГ) влияние на глобальную сократимость левого желудочка (ЛЖ) была удовлетворительной. Однако, продольная систолическая функция по данным тканевой допплерографии в обеих группах достоверно не изменялась. В основной группе при сравнении с исходными данными эхокардиографии (ЭхоКГ) отмечали достоверное увеличение ранней диастолической скорости движения митрального кольца (еꞌ), а также положительную динамику комбинированных показателей соотношения скорости раннего трансмитрального потока и раннедиастолической скорости митрального кольца (Е/(еꞌ). Соотношения скорости раннего трансмитрального потока и скорости распространения диастолического потока в ЛЖ по данным цветного картирования в М-режиме (E\Vp), являющиеся наиболее чувствительными, не зависимыми от преднагрузки показателями улучшения диастолической функции ЛЖ и снижение давления его наполнения. В то же время существенной динамики описанных показателей в сравнительной группе не отмечалось.
Но по данным допплерографии средней мозговой артерии у больных основной группы наблюдалась четкая тенденция к нормализации пиковой систолической скорости потока по сравнению с исходными данными. У большинства больных первой группы до приема подобранной терапии пиковая скорость потока средней мозговой артерии была повышенной, а после приема этот показатель практически нормализовался ((1,17±0,05) по сравнению с (1,25±0,057) м/с, Р ˂ 0,0001), в то время как подобной динамики в группе сравнения не отмечено (соответственно (1,27± 0.08) и (1,25± 0,067) м/с, Р˃ 0,05).
К концу лечения, только в основной группе, целевого ОХ˂4,5 ммоль/л достигли 52,2 % пациентов, целевого уровня ЛПНП˂2,5 ммоль/л — 54,3 %, снижение содержания ТГ ˂1,7 ммоль/л имело место у 53,3 % пациентов. Кроме того, на фоне приема розувастатина отмечался достоверный рост уровня ЛПВП и снижение содержания ТГ в среднем по группе. Повышение уровня АЛТ зарегистрировано было в 2,4 % случаев, повышение КФК-в 0,2 % случаев и 0- пациентов с жалобами на боли в мышцах.
Таким образом, подобранная нами терапия соответствует 2 направлениям базовой терапии и нормализации перфузии мозга путём воздействия на разные уровни сердечно-сосудистой системы и влияние на тромбоцитарное звено гемостаза. А также, базовая этиопатогенетическая терапия подразумевает: снижает нарушение в функции гипоталамо-гипофизарного комплекса и тем самым регулируется активность головного мозга.
Литература:
- Захаров В. В., Ковтун А. Ю. Терапия восстановительного периода ишемического инсульта.
- Богданов А. Н., Бажухин Д. В. Классификация и диагностика изменений церебральной гемодинамики при сосудистых заболеваниях головного мозга.-2000г.
- Бокерия Л. А., Бузиашвили Ю. И., Шумилина М. В. Нарушение церебрального венозного кровотока у больных с сердечно-сосудистой патологией.- М.: НЦССХ, 2003.-161 с.
- Варакин Ю. А. Эпидемиологические аспекты профилактики нарушений мозгового кровообращения. Атмосфера. Нервные болезни. 2005. № 2.стр 4–10.







