В настоящее время инфекционный эндокардит (ИЭ) представляет собой серьезную медико-социальную проблему. Рост заболеваемости ИЭ отмечается во всем мире, в том числе в социально благополучных странах. Так, в США число больных ИЭ за последние десятилетия возросла вдвое. Во Франции частота заболеваемости составляет 2,4 случая на 100 000 жителей. Ежегодная заболеваемость ИЭ в России составляет 3,8 случая на 100 000 населения [11,12,13]. ИЭ в настоящее время характеризуется увеличением числа первичных форм заболевания, изменением этиологии и клинической картины, возрастанием числа атипичных вариантов, появлением новых форм течения ИЭ с тяжелыми осложнениями. Немаловажную роль в увеличении числа больных ИЭ играет широкое использование инвазивной медицинской техники. Увеличение заболеваемости прямо коррелирует с нарастающей частотой иммунодефицитных состояний, сопровождающихся резким снижением способности организма противостоять бактериальной или вирусной агрессии и, как следствие — к высокой летальности [2, 8].
Роль иммунной системы в прогнозе и исходе ИЭ безусловно велика. В этой связи остро встает вопрос о своевременной диагностике иммунодефицитного состояния и его коррекции посредством иммуномодулирующей терапии. Однако вопросы иммунологии, иммунодиагностики и иммунокоррекции у больных с иммунодефицитами, в том числе ИЭ изучены недостаточно и продолжают широко обсуждаться в современной литературе [5,17].
Таким образом, существующие проблемы, связанные с особенностями современного течения ИЭ, малоизученные вопросы нарушения иммунологической реактивности и иммунокоррекции у больных, определят актуальность моделирования ЭК на экспериментальных животных.
Экспериментальное моделирование эндокардита совершенно необходимо уже по той причине, что практически отсутствует предиктор развития патологии, так необходимого для ранней диагностики патологии сердца и в том числе ИЭ. Именно экспериментальные модели эндокардита позволят решить по крайней мере два главных вопроса — кинетику диффузии антибиотиков в пораженный миокард и степень эффективности лечения [1,3,8]. Чаще всего модель инфекционного эндокардита воспроизводится на мышах CD1 путем внутривенного введения определенной дозы Staphylococcus aureus через час после нанесения травмы аортального клапана посредством катетера, введенного через левую каротидную артерию. И [7, 10]. Не менее известна модель эндокардита на мышах BALB/c, вызванная путем внутрибрюшинного введения Staphylococcus aureus. В результате развивается хроническая персистирующая бактериальная инфекция по типу хрониосепсиса, которая приводит к развитию характерных изменений в эндокарде. Эта модель ИЭ мышах перспективна в контексте поиска предикторов и изучения возможности иммунотерапии эндокардита [1,4,6,9].
Нами разработана модель аутоагрессивного эндокардита на мышах BALB/c, удобная и легко воспроизводимая (в настоящее патентуется Патентным ведомством Туркменистана).
Целью настоящего исследования являлось определение степени сенсибилизации лейкоцитов крови к кардиальному антигену при экспериментальном аутоагрессивном эндокардите у мышей BALB/c и возможность использования теста в качестве предиктора поражения эндокарда
Материалы иметоды. В экспериментах использовано 25 мышей линии BALB/c самцов массой не менее 20 грамм, которые были получены из питомника Техноцентра АНТ. Животных содержали на обычном рационе питания вивария. Было выделено две группы животных. В первую группу (контрольную) вошло 10 и во вторую (опытную) 15 животных. На животных второй группы моделировали экспериментальный аутоагрессивный эндокардит (модель в настоящее время патентуется Государственным патентным ведомством Туркменистана).
Растворимый кардиальный антиген (РКАГ) получали методом водно-солевой экстракции с учетом рекомендаций [16]. Для этого из 3-х сердец сингенных мышей готовили гомогенат при помощи гомогенизатора Поттера. Гомогенат заливали фосфатно-солевым буфером (рН 7,2) из расчета 1:5, трехкратно замораживали- оттаивали. После третьего оттаивания гомогенат центрифугировали в течение 40 минут при 3000 об/мин. Супернатант отсасывали, дозировали по белку [16], разливали в ликвоты по 1,0 мл, хранили при -20° С. Полученный антиген размораживали однократно в день проведения исследования.
Животных обеих групп ежедневно осматривали, обращая внимание на подвижность, полировку шерсти, аппетит, массу тела. На 7, 14 и 21 сутки от начала эксперимента определяли степень сенсибилизации лейкоцитов к кардиальному антигену (КАГ) в реакции торможения миграции лейкоцитов в нашей модификации [14,15]. Результаты выражали в виде индекса миграции лейкоцитов (ИМЛ).
На 14 и 21 сутки по 2 мыши как из контрольной, так и опытной группы забивали под эфирным наркозом путем дислокации шейных позвонков, извлекали сердце для морфологического исследования. После традиционной проводки через спирты, готовили парафиновые блоки, нарезали и готовили препараты. Препараты окрашивали гематоксилин-эозином и микроскопиро-вали.
Полученные при исследовании результаты математически обработаны при помощи математической программы SPSS.
Результаты исследования иих обсуждение.
Животные находились в эксперименте 25 суток. Мышей обеих групп ежедневно осматривали. При осмотре животные обеих групп в течение первых трех суток — мыши подвижные, с хорошим аппетитом, шерсть блестящая.
Но с 3 суток у животных экспериментальной группы уже несколько тускнела полировка шерсти, хотя аппетит и двигательная активность сохранялись на прежнем уровне.
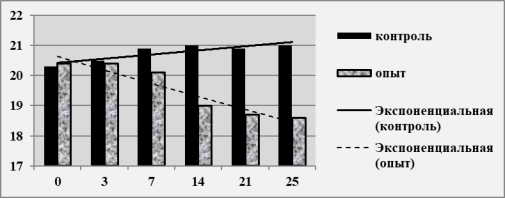
Рис. 1. Масса тела мышей BALB/c в зависимости от длительности эксперимента
Заметные внешние изменения начинались с 9 суток и к 14 суткам полировка шерсти тусклая, аппетит, двигательная активность и масса тела животных значительно снижены. К 21 суткам 7 животных из экспериментальной группы погибли (46,6 %) при явлениях нарастающей слабости, резкого снижения активности, массы тела и аппетита. На 25 сутки погибли 11 животных (73,3 %). В течение всего времени наблюдения (25 суток) в контрольной группе гибели мышей не было.
Первые морфологические признаки воспаления появляются в париетальном эндокарде желудочков сердца. Он становится утолщённым за счет воспаления. На 7 сутки морфологические изменения в эндокарде, указывающие на развитие тяжелого поражения ткани сердца — максимальны. Появляются лейкоцитарные васкулиты с примесью эозинофилов, инфильтраты периваскулярной ткани, клапанов сердца, очаги мукоидного и фибриноидное набухания. На 14–21 сутки развиваются выраженные альтеративно-деструктивные повреждения мио- и эндокарда. По краю створок клапанов, чаще на предсердной поверхности, развиваются пристеночные тромботические наложения, в соединительной ткани редко, но можно обнаружить диффузные лимфоидно-макрофагальные инфильтраты. К этому периоду погибает около половины животных (46,6 %). Другими словами, клиническая и морфологическая картина мио- и эндокарда позволяет говорить о существенных изменения в тканях сердца экспериментальных животных.
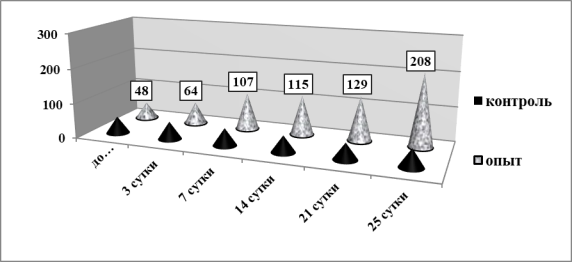
Рис. 2. Значения ИМЛ в присутствии кардиального антигена в динамике наблюдения
Иммунологические исследования показали, что у мышей контрольной группы величина ИМЛ в присутствии КАГ составляет 49,7±3,8, то есть наблюдается эффект торможения миграции. Это нормальная реакция иммунной системы животных на антиген. У животных экспериментальной группы на 3 сутки от начала эксперимента одновременно с внешними изменениями прогрессивно увеличивается значение ИМЛ (p<0,05) (рис.2). По мере нарастания внешних и морфологических изменений в мио- и эндо-карде мышей величина показателя прогрессивно увеличивается. На 21 сутки ИМЛ уже составляет 129,7±9,2 (p<0,001) и к 25 суткам превышает исходный уровень в 4,3 раза.
Ранее нами была показана возможность иммунологической диагностики патологии миокарда по величине ИМЛ в присутствии кардиального антигена (10). Эндокардит, тем более аутоиммунный, является не только серьезной патологией сердца, но и всего организма. На наш взгляд, величина ИМЛ в присутствии цельного кардиального антигена, использованного в настоящем исследовании, четко отражает тяжесть аутоиммунного поражения тканей сердца — мио- и эндокарда, развивающего в результате его длительной атаки сенсибилизированными к кардиальному антигену лейкоцитами и специфическими противокардиальными иммуноглобулинами.
В целом результаты исследования позволяют допустить, не только возможность моделирования аутоагрессивного эндокардита у мышей BALB/c при помощи цельного кеногенного кардиального антигена, но и возможность использования величины ИМЛ в качестве информативного предиктора патологии эндокарда у млекопитающих и в том числе — у человека.
Выводы.
- Длительное введение мышам линии BALB/c растворимого ксеноген-ного кардиального антигена позволяет получить модель ауто-иммунного мио- и эндокардита.
- Величину индекса миграции лейкоцитов (ИМЛ) в присутствии кардиального антигена можно рассматривать в качестве предиктора аутоиммунного эндокардита в пре- и послеоперационном периоде у больных с недостаточностью клапанного аппарата сердца, а также у больных с хрониосепсисом.
Литература:
- Bruno Fantin, Claude Carbon In vivo antibiotic synergism: contribution of animal models // Antimicr. Agents and chemother — 1992, vol 36, № 5, p.907–212.
- Carbon C Animal models of endocarditis. //Int J Biomed Comput. — 1994 Jun; 36 (1–2):59–67.
- Definition, clinical profile, microbiological spectrum, and prognostic factors of early-onset prosthetic valve endocarditis /J. Lopez, A. Revilla, I. Vilacosta et al. // Eur. Heart J.- 2007.- Vol. 28.- P. 760 765.
- Elise R. Breed and Bryce A. Binstadt Autoimmune Valvular Carditis // Curr. Allergy Asthma Rep., 2015, Jan; 15(1): 491. doi: 10.1007/s11882–014–0491-z
- Gibson G. W., Kreuser S. C., Riley J. M., Rosebury-Smith W. S., Courtney C. L., Juneau P. L., Hollembaek J. M., Zhu T., Huband M. D., Brammer D. W., Brieland J. K., Sulavik M. C. Development of a mouse model of induced Staphylococcus aureus infective endocarditis.// Comp Med., 2007, Dec; 57(6), 563–9.
- Hill E. E., Herijgers P., Claus P. et al. Infective endocarditis: changing epidemiology and predictors of 6-month mortality: a prospective cohort study /. // Eur. Heart J., 2007.- Vol. 28.-P. 196–203.
- Hirofumi Zempo, Jun-ichi Suzuki, Masahito Ogawa, Ryo Watanabe, Yuko Tada, Chisato Takamura, Mitsuaki Isobe. Chlorogenic Acid Suppresses a Cell Adhesion Molecule in Experimental Autoimmune Myocarditis in Mice// J. Immunology, Endocrine & Metabolic Agents in Medicinal Chemistry.- 2013.- Volume 13.- Issue 3.-P.,
- Kim H. K., Missiakas D., Schneewind O. Mouse models for infectious diseases caused by Staphylococcus aureus. //J. Immunol. Methods.,2014,- Aug.- 410.-P. 88–99. doi: 10.1016/j.jim.2014.04.007. Epub 2014 Apr 24
- Muller A. M., Fischer A., Katus H. A., Kaya Z. Mouse models of autoimmune diseases — autoimmune myocarditis.// Curr Pharm Des. -2015.- 21(18).- P.2498–512.
- Neumann D. A., Lane J. R., Wulff S. M., Allen G. S., LaFond-Walker A., Herskowitz A. and Rose N. R. In vivo deposition of myosin-specific autoantibodies in the hearts of mice with experimental autoimmune myocarditis.//J. Immunol.- June 15, 1992.- 148 (12).- P. 3806–3813.
- Буткевич О. М. Опыт наблюдения больных инфекционным эндокардитом в течение 1965–2005 гг. / О. М. Буткевич, Т. Л. Виноградова // Терапевтический архив. 2006.- № 4.- С. 61–64.
- Кабанова Т. Г. Первичный инфекционный эндокардит: особенности диагностики и лечения //Автореф. Дис. Канд. Мед. Наук Москва-2007
- Кисляк С. В. Современный инфекционный эндокардит: клинико-морфологические особенности в эволюционном аспекте и взаимосвязь с антифосфолипидным синдромом // Автореферат дисс. к.м.н. — Екатеринбург, 2009.
- Плескановская С. А., Гельдыева O., Тойлиев С. О возможности доклинической диагностики болезней миокарда.//Труды 6-го междунар.конгресса кардиологов туркоязычных стран. Ашхабад. Туркменистан, 8–9 нояб., 2008 г.
- Плескановская С. А. Клеточный и гуморальный иммунный ответ при кожном лейшманиозе (экспериментальные исследования и наблюдения на больных). Автореферат дисс. к.м.н. — Москва, 1982.
- Фримель Г. Иммунологические методы. М:Наука,1987.
- Цинкернагель Р. Основы иммунологии.- М:Мир.- 2008.







