ИЭ регистрируется во всех странах мира, независимо от климато-географической зоны. За последние десятилетия заболеваемость ИЭ увеличилась в 3–4 раза [9,10,11], рост наблюдается даже в экономически развитых странах. В США и странах Западной Европы заболеваемость ИЭ колеблется от 25 до 93 на 1 млн. населения [2,11], в России — 46,3 [15]. Не вызывает сомнения, что значительное превосходство хирургического лечения больных ИЭ в сравнении с консервативным [6]. Инфекционный эндокардит (ИЭ) — тяжелое инфекционное системное заболевание с поражением клапанов сердца и/или пристеночного эндокарда, которое сопровождается бактериемией, тромбоэмболическим синдромом, поражением внутренних органов иммунокомплексной природы и без лечения неизбежно приводит к смерти [6,7,8]. Однако предметом дискуссии остаются сроки хирургического вмешательства, их соотношения с антибактериальной терапией. Кроме того, активная хирургическая тактика лечения ИЭ, получившая широкое распространение в последнее время, имеет серьезные недостатки. В частности не учитываются риск протезного эндокардита и самого оперативного вмешательства на фоне текущего активного воспалительного процесса [8,15]. Остаются открытыми вопросы коррекции вторичных иммунодефицитных состояний, сопутствующих или предшествующих ИЭ. Они продолжают широко обсуждаться в современной литературе. В связи с этим изучение функциональной активности иммунной системы, возможно более раннее определение степени ее дефицитности у больных ИЭ, коррекция выявленных поломок становятся все более актуальной проблемой современной медицины и кардиохирургии в частности [1, 3,14,15,17,18,19].
Экспериментальная иммунология дала в руки клиницистов значительный методический потенциал, позволяющий установить уровень «поломки» иммунной системы при самой различной патологии. Определение популяционного и субпопуляционного состава лимфоцитов крови человека незаменимо при оценке тяжести состояния больного, определении прогноза и исхода любого заболевания.
Известно, что важнейшими проявлениями нарушения функций иммунной системы человека является дисбаланс основных субпопуляций лимфоцитов Чаще всего это дисбаланс лимфоцитов фенотипов CD3+, CD19+ и CD45+, который описан при иммунодефицитных состояниях (ИДС) самой различной этиологии [17], в том числе при инфекционном эндокардите [1,2,5].
Целью настоящего исследования являлось определение субпопуляционного состава циркулирующих лимфоцитов у больных ИЭ, необходимое для выявления патогенетической роли каждой из субпопуляций, и выбора на этой основе тактики иммуномодулирующей терапии в до- и послеоперационном периоде.
Материалы иметоды. Наиболее принятыми и информативными в клинической иммунологии считаются лимфоциты следующих субпопуляций — CD3+ (зрелые Т-лимфоциты), CD19+ (молодые В-лимфоциты), CD4+ (65 % из них Т-хелперы), CD8+- (цитотоксические Т-лимфоциты /супрессоры), CD16+ или NK- клетки (натуральные киллеры), CD56+ — (T-NK- Т-киллеры) и CD45+ (активированные Т-клетки) [12,8,19]. Все перечисленные субпопуляции лимфоцитов идентифицированы в венозной крови 45 больных ИЭ и 60 практически здоровых лиц. Одновременно вычисляли иммунорегуляторный индекс (IRI).
Численность субпопуляций лимфоцитов в крови обследуемых лиц определяли методом проточной цитофлюорометрии на проточном цитофлю-ориметре Beckman (USA) с использованием моноклональных антител. Больных ИЭ обследовали при поступлении (до операции) и по окончании курса лечения. Практически здоровые лица обследованы однократно. Результаты исследования математически обработаны при помощи программы SPSS statistics (USA). Помимо общепринятых математических характеристик проведен парный корреляционный анализ данных.
Результаты исследования иих обсуждение. Исследования показали, что у больных ИЭ при поступлении существенно изменена численность основных популяций лимфоцитов (Табл. 1).
Таблица 1
Субпопуляционный состав лимфоцитов периферической крови убольных ИЭ
|
№п/п |
Субпопуляции лимфоцитов |
Здоровые (n=60) |
Больные ИЭ до лечения (n=30) |
Больные ИЭ после лечения (n=25) |
|
1. |
CD3+/CD19- |
73,6±2,3 |
55,3±6,44* |
67,5 ±8,0 |
|
2. |
CD3-/CD19+ |
13,78±2,18 |
15,2±1,7 |
12,6 ±2,6 |
|
3. |
CD45+/CD14- |
99,1±0,29 |
86,1±1,1** |
95,7 ±3,1 |
|
4. |
CD3+/CD4+ |
38,68±1,36 |
42,4±0,85* |
43,0 ±3,8 |
|
5. |
CD3+/CD8+ |
27,6±2,7 |
22,5±1,3* |
26,9 ±2,6 |
|
6. |
CD3-/CD16+ CD56+ (NK) |
9,16±0,95 |
11,7±0,8* |
9,5± 1,1 |
|
7. |
CD3+/CD16+ CD56+ (TNK) |
4,56±0,69 |
2,1±0,12** |
3,2 ±0,5* |
|
8. |
CD4+ / CD8+ (IRI) |
1,46±0,1 |
1,6±0,09* |
1,59 ±0,08 |
Примечание: *- p<0,05; ** — p<0,01
В частности, снижены относительная численность лимфоцитов следу-ющих фенотипов — CD3+, CD45+, CD3+/CD8+,TNK, но повышен иммуноре-гуляторный индекс — IRI (p<0,05, 0,01, 0,05, 0,01 и 0,05 против практически здоровых лиц соответственно) (Рис.1,2).
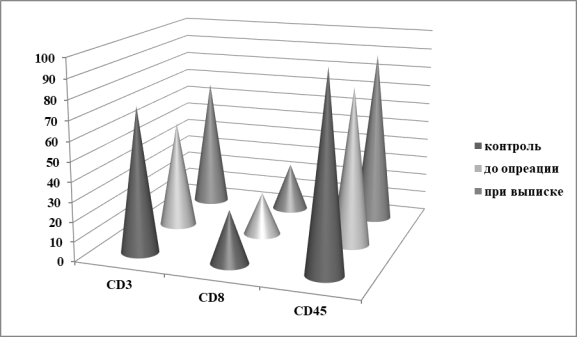
Рис. 1. Динамика численности CD3+, CD45+, CD3+/CD8+ -субпопуляций лимфоцитов у больных ИЭ.
Максимальная степень снижения относительного числа лимфоцитов (в 2,2 раза) приходится на Т-киллеры (TNK) -лимфоциты фенотипа CD3+/CD16+ CD56+) (рис.2).
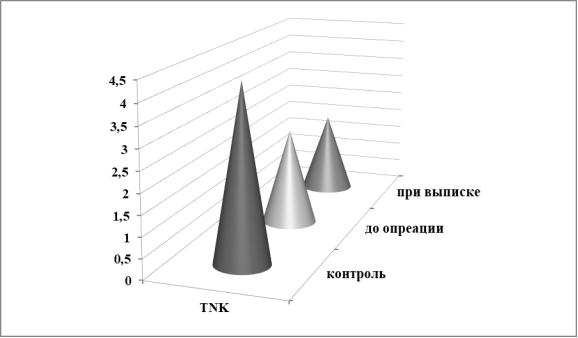
Рис. 2. Динамика численности TNK-субпопуляции лимфоцитов у больных ИЭ.
После операции и курса восстановительного лечения наблюдается четкая тенденция к нормализации численности всех изученных субпопуляций в периферической крови больных ИЭ. Но остается достоверно низким относительное число ТNK-лимфоцитов (табл.1).
Таким образом, при ИЭ наиболее выраженное изменение относительного числа лимфоцитов касается натуральных (NK) и Т-киллеров (T-NK).
Достаточно информативно в плане определения динамики численности лимфоцитов с хелперной и супрессорной активностью является вычисление величины иммунорегуляторного индекса (IRI). На диаграмме (рис.3) видно, что IRI у больных ИЭ при поступлении значительно повышен, затем он снижается, но при выписке на фоне достаточно выраженной клинической реабилитации не достигает уровня контроля.
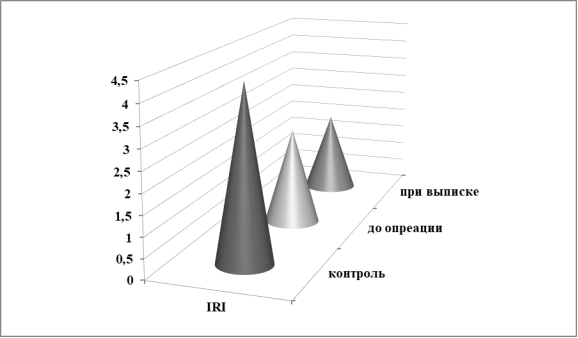
Рис. 3. Величина IRI у больных ИЭ до и после хирургического лечения.
Данные о величине иммунорегуляторного индекса (IRI) указывают на существенную патогенетическую роль лимфоцитов-хелперов при ИЭ.
Таким образом, идентификация субпопуляций лимфоцитов у больных ИЭ позволила выявить существенный дисбаланс численности лимфоцитов и, особенно, с киллерной активностью. Поскольку все виды киллерных клеток (NK, T-NK) осуществляют противовирусную защиту можно допустить, что в развитии патологического процесса в тканях сердца вирусы играют практически ведущую роль. В этой связи нам кажется чрезвычайно перспективным включение в схему предоперационной подготовки и послеоперационного ведения больных с ИЭ противовирусных и иммуностимулирующих препаратов.
Выводы
- У больных ИЭ имеется выраженное расстройство субпопуляционного состава циркулирующих лимфоцитов, касающееся, в основном, клеток с хелперной активностью и киллеров — как натуральных, так и тимусзависимых.
- Характер иммунологических сдвигов на уровне субпопуляций лимфоцитов свидетельствует о развитии значительного иммунодефицита у больных ИЭ и необходимости включения в схему предоперационной подготовки и послеоперационого ведения больных с ИЭ противовирусных и иммуностимулирующих препаратов.
Литература:
- Garnier J. L. Touraine J. L. Colon S. Immunology of infective endocarditis// European Heart Journal, Volume 5, Issue suppl_C, 1 October 1984, Pages 3–9, https://doi.org/10.1093/eurheartj/5.suppl_C.3
- Lopez J., A. Revilla, I. Vilacosta et al. Definition, clinical profile, micro-biological spectrum, and prognostic factors of early-onset prosthetic valve endocarditis // Eur. Heart J.- 2007.- Vol. 28.- P. 760 765.
- Phair J.P.Clarke J. Immunology of infective endocarditis //Progress in cardiovascular diseases, 1979, 3(22), p.137–144.
- Satoko Nakano, Emi Ikebe, Yoshiyuki Tsukamoto, at all. Commensal Microbiota Contributes to Chronic Endocarditis in TAX1BP1 Deficient Mice//Published online 2013 Sep 27. (doi: 10.1371/journal.).
- Wilma C. Neves Forte, Aline C. Mario, Adilson da Costa, Luciana S. Henriques, Carla L. Gonzales, Roberto A. Franken Immunologic Evaluation in Infective Endocarditis Arq. Bras. Cardiol. vol.76 n.1 São Paulo Jan. 2001
- Бокерия Л. А. Некоторые аспекты кардиохирургии у больных пожилого возраста: особенности, прогноз, качество жизни / Л. А. Бокерия, С. Ф. Никонов, И. Е. Олофинская // Грудная и сердечно-сосудистая хирургия. 2002. № 2. С. 46–51
- Бокерия Л. А., Гудкова Р. Г. Болезни и врождённые аномалии системы кровообращения // Сердечно-сосудистая хирургия. М.: Изд-во НЦ ССХ им. А. Н. Бакулева РАМН, 2007. С. 52–54
- Буткевич О. М. Опыт наблюдения больных инфекционным эндокардитом в течение 1965–2005 гг. / О. М. Буткевич, Т. Л. Виноградова // Терапевт-ический архив. 2006.- № 4.- С. 61–64.
- Горлова И. А. Отдалённые результаты хирургического лечения инфекцион-ного эндокардита // Автореф. дис. канд. мед. наук, Санкт-Петербург — 2012
- Кабанова Т. Г. Первичный Инфекционный эндокардит: особенности диагностики и лечения //Автореф. Дис. Канд. Мед. Наук Москва-2007;
- Кисляк С. В. Современный инфекционный эндокардит: клинико-морфологические особенности в эволюционном аспекте и взаимосвязь с антифосфолипидным синдромом //Автореферат диссертации на соискание ученой степени кандидата медицинских наук, Екатеринбург, 2009, 28 с.).
- Лебедев К. А., Понякина И. Д. Интерпретация клинического анализа крови с определением субпопуляции лимфоцитов при воспалении. // Аллергология и иммунология. Т. 3. № 1. 2002. — C. 50–60.
- Плескановская С. А. Клеточный и гуморальный иммунный ответ при кожном лейшманиозе (экспериментальные исследования и наблюдения на больных).Автореферат дисс. к.м.н. — Москва 1982.
- Плескановская С. А., Гельдыева О. Ш., Тойлиев С. О возможности доклинической диагностики болезней миокарда. //Труды 6-го между-народного конгресса кардиологов туркоязычных стран. Ашхабад. Туркменистан, 8–9 нояб., 2008 г.
- Трунов А. Н., Трунова Л. А. Принципы иммунореабилитации при инфекционно-воспалительных заболеваниях, вызываемых условно-патогенной микрофлорой. / International J.Immunorehabilitation. 2 (№ 1). 2000. — C. 186–195.
- Фримель Г. Иммунологические методы, М:Нука,1987.
- Хайдарова Д. Ж. Клинико-иммунологическая характеристика ревматических и неревматических (диспластических) пороков сердца в пред- и послеоперационных периодах. / Автореф. дис. канд. Наук. — М., 1991.
- Хаитов Р. М., Пинегин Б. И. Основные принципы иммуномодулирующей терапии. // Аллергия, астма и клиническая иммунология. № 1. 2000. — C. 9–16.
- Хаитов Р. М., Пинегин Б. И. Современные представления о защите организма от инфекций. // Иммунология. № 1. 2000. — C. 61–64.







