Ключевые слова: аспирин, вода, кинетические параметры, модельные уравнения кинетики, область реагирования.
Аспирин (ацетилсалициловая кислота) является типичным представителем группы нестероидных противовоспалительных препаратов и в различных лекарственных формах широко применяется в медицинской практике, как эффективное противовоспалительное, анальгетическое, антиагрегатное средство [1]. Он также широко применяется при лечении сердечно-сосудистых заболеваний. Однако, недостатком аспирина является то, что он чаще всего вызывает раздражение желудка и двенадцатиперстной кишки, вызывает эрозивно-язвенные поражения ЖКТ (желудочно-кишечного тракта). Такое негативное действие аспирина определяется несколькими причинами, среди которых следует отметить плохую растворимость аспирина в воде [2]. Поэтому повышение гидрофильности и снижение токсичности аспирина является актуальной задачей современной формации.
Технология изготовления таблеток аспирина, а также вспомогательных веществ, входящих в ее состав, во многом способствуeт растворению и снижению риска повреждающего действия его на слизистую оболочку желудка.
Целью данной работы является изучение кинетических закономерностей растворения в воде аспирина разных производителей. Определение лимитирующей стадии процесса, нахождение адекватного формально кинетического описания и определение основных кинетических параметров реакции: констант скорости и энергии активации.
По существу, процесс растворения аспирина в воде является гетерогенным процессом и происходит на границе раздела фаз твердое тело-жидкость. Следовательно, общая скорость растворения складывается из скоростей двух последовательных стадий:
1. физико-химическое взаимодействие аспирина с водой; 2-диффузия продуктов с поверхности лекарственного вещества в раствор. Общая скорость процесса зависит от соотношения скоростей этих стадий и ограничивается скоростью наиболее медленно протекающей стадии, которая и определяет режим (кинетический и диффузионный) процесса растворения. В работе нами были использован аспирин Российского производства фирмы «Фармстандарт».
Исследование кинетики лекарственного вещества проводилось гравиметрически, при температурах 20, 25, 30 и 400С. В качестве растворителя использовалась дистиллированная вода (РH = 6,2–6,8). Степень растворения рассчитывали как отношение растворившегося аспирина к его взятой общей массе (0,6г). Кинетические данные дают возможность уточнить механизм реакции, выявить корреляционные зависимости между реакционной способностью молекул и их строением.
Результаты экспериментальных данных приведены в табл. 1.
Таблица 1
Зависимость степени растворения аспирина вводе от времени при различных температурах ирасчет константы скорости процесса.
|
t0C |
Время, с |
Степень растворения, |
1-(1- |
Конст. скорости растворения, K 10–4 |
lnk |
|
20 |
300 600 2400 3600 |
0,012 0,017 0,070 0,110 |
3,10 6,15 2,50 3,60 |
–7,42 |
6,01 |
|
25 |
300 600 2400 3600 |
0,03 0,06 0,15 0,19 |
5,35 10,7 41,6 64,2 |
–6,84 |
1,07 |
|
30 |
300 600 2400 3600 |
0,030 0,058 0,220 0,310 |
9,9 19,8 79,2 118,8 |
–622 |
1,98 |
|
40 |
300 600 2400 3600 |
0,53 0,64 0,70 0,82 |
36,5 73,1 292,2 438,2 |
–4,92 |
7,30 |
Математическая обработка этих данных была проведена по трем уравнениям: Гистлинга, «Сокращающейся» сферы и Яндера [3].
Уравнение Гистлинга используется для описания скорости процесса во внешнедиффузионной области:
1 – (1 -) 2/3 =K![]() (1)
(1)
Где: - степень растворения, К- константа скорости, ![]() — время.
— время.
Уравнение «Сокращающейся» сферы применимо для описания процесса, скорость которого зависит как от диффузии реагентов к поверхности реагирования, так и от скорости реакции на поверхности раздела фаз:
1 — (1 -) 1/3 =K![]() (2)
(2)
А для описания скорости реакций, в ходе которых образуются достаточно плотные пленки продуктов, замедляющих поступление жидкого реагента к реакционной поверхности реагирования (диффузионная область), используют уравнение Яндера:
[1 — (1 -) 1/3]2 = K![]() (3)
(3)
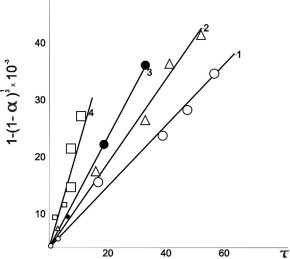
Рис. 1. Линеаризация кинетических данных процесса растворения аспирина в воде в координатах уравнения сокращающейся сферы
Для того, чтобы определить какое из вышеперечисленных уравнений болеет точно описывает экспериментальные данные, необходимо подставить степень растворения в несколько уравнений и построив графики, убедиться какой из них соответствует прямой линии.
Как видно из рис. 1 опытные данные удовлетворительно линеаризуются в координатах 1 — (1 -) 1/3- ![]() Следовательно именно уравнение «Сокращающейся» сферы наиболее точно описывает кинетику процесса растворения аспирина в воде.
Следовательно именно уравнение «Сокращающейся» сферы наиболее точно описывает кинетику процесса растворения аспирина в воде.
По наклону этих прямых для каждой температуры рассчитывали константу скорости процесса (рис.2), и строили температурную зависимость константу скорости реакции растворения в аррениусовских координатах lnK-1/T. По тангенсу угла наклона этой прямой определяли значения основных кинетических параметров процесса: энергию активации (12,5 кДж/моль, что соответствует внешне — диффузионной области реагирования) и предэкспоненциальный множитель (К0 = 0,03 мин-1).
Подставляя полученные значения константы скорости и энергии активации в исходное уравнение, получаем выражение:
1 — (1 -) 1/3 = 0,03 exp(-12500/RT)![]() (4)
(4)
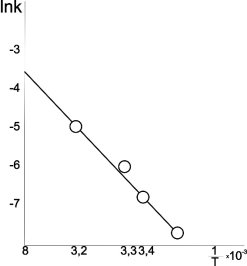
Рис. 2. Зависимость логарифма константы скорости реакции растворения аспирина в воде от обратной температуры С
А зависимость степени растворения от времени и температуры для данного процесса выглядит следующим образом:
= 1 — [1–0,03 exp(-12500/RT)
Таблица 2
Сравнение расчетных иэкспериментальных данных реакции растворения аспирина вводе
|
|
Степень растворения аспирина () |
|||||
|
20оC |
30оC |
40оC |
||||
|
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
|
|
5 20 40 60 |
0,012 0,050 0,070 0,110 |
0,016 0,053 0,081 0,090 |
0,03 0,11 0,22 0,31 |
0,028 0,092 0,280 |
0,53 0,64 0,73 0,82 |
0,46 0,58 0,66 0,70 |
Из таблицы 2 видно, что результаты расчета по уравнению (5) удовлетворительно согласуются с экспериментальными данными.
Литература:
- Алехин Е. К. Аспирин: Новая жизнь старого лекарства // Соросовский Образовательный журнал, No 7, 1999. с. 85–90.
- Рафальский В. В., Лосенкова С. О., Крикова А. В., Максименкова К. И., Багликов А. Н. Сравнительная оценка кишечнорастворимых таблеток ацетилсалициловой кислоты разных производителей по тесту ''Растворение''. Российский кардиологический журнал, No 6 (86) 2010. с. 51–55.
- Барре П. Кинетика гетерогенных процессов М:Мир. 1976. 399.с.







