В данной работе проводится исследование различных методик синтеза K3 [Mn(C2O4)3]х3H2O, анализ полученных образцов на примеси и их очистка. Приводятся данные по синтезу соединений марганца: K2 [Mn(C2O4)2(OH)2], (NH4)6 [MnMo9O32]х6H2O, Na3MnO4х0,25NaOHх12H2O, K2MnO4, K7 [MnV13O32]х18Н2О, MnS, AgMnO4, [Mn(Gly)2Cl2].
Ключевые слова: синтез, марганец, манганаты.
Соединения марганца в различных степенях окисления находят множество применений в современном мире. Манганаты используются как промежуточные продукты в неорганическом синтезе и как окислительные агенты в органическом синтезе. Комплексы трех- и четырехвалентного марганца играют, по-видимому, важную роль в фотосинтезе, где выделение кислорода зависит от наличия марганца [1]. Другое применение они находят в детергентах и чистящих средствах, в частности в композициях для твердых поверхностей, содержащих пероксидные соединения. Склонные к фотолизу оксалатные комплексы марганца служат отличным объектом исследований, связанных с изучением фотохимических процессов [2]. Манганат (VII) серебра используется в противогазах. Поскольку гетерополисоединения обладают уникальными структурой и физико-химическими свойствами, они используются в качестве гомогенных и гетерогенных катализаторов и модельных структур в координационной химии, а также представляют интерес с точки зрения рентгеноструктурного анализа. Комплексы марганца с аминокислотами и белками были обнаружены в различных биохимических системах.
Материалы иметоды
Для синтеза целевых соединений были использованы реактивы квалификации не ниже «Ч». Для определения чистоты и выхода целевых соединений использовались титриметрический метод и спектрофотометрия в диапазоне 400–800 нм на спектрофотометрах ЛОМО СФ-46 и КФК-3. В случае триоксалатоманганата (III) калия было использовано иодометрическое определение марганца (III) и перманганатометрическое определение оксалат-ионов по методике [3]. Для определения чистоты манганата (VI) калия и 9-молибдоманганата аммония была использована спектрофотомерия. Для водных растворов обоих веществ были сняты спектры поглощения, а для манганата (VI) также произведено измерение поглощения при λ(max). Также был снят спектр поглощения охлажденного водного раствора K3 [Mn(C2O4)3]х3H2O.
Обсуждение результатов
Триоксалатоманганат (III) калия. Синтез K3 [Mn(C2O4)3]х3H2O произведен по наиболее часто применяемой для этого методике [4]. Целевой продукт получен с выходом 52 %. Были проведены эксперименты с добавлением для осаждения K3 [Mn(C2O4)3]х3H2O следующих спиртов: этанола, пропан-1-ола, пропан-2-ола и бутан-1-ола. Обнаружено, что при использовании этилового спирта осаждается целевой продукт с малым количеством примеси белого цвета, с пропиловым и изопропиловым спиртами — и то, и другое, а с н-бутанолом в осадок выпадает исключительно белая примесь. На основе данных экспериментов была разработана методика для отделения K3 [Mn(C2O4)3]х3H2O от белой примеси, предположительно представлявшей из себя оксалат калия (в пользу этого свидетельствуют результаты качественного и титриметрического определения состава смеси).
Суть методики заключается в следующем: необходимо взвесить полученную в ходе синтеза смесь, добавить воду в расчете 2–2,5 мл на каждые 0,1 г последней. Добавить бутанол в расчете 5 мл на каждые 0,1 г полученной смеси, тщательно перемешать стеклянной палочкой до выпадения белого осадка и расслоения жидкой фазы. Затем количественно перенести красную (нижнюю) жидкую фазу в другую емкость и добавить к ней в соотношении примерно 1:1 по объему этанол. В случае выпадения белого осадка — отфильтровать его, и оставить раствор на 2 часа в охлаждаемой емкости, затем выделить полученный фиолетово-красный осадок. При более долгом стоянии раствора на холоде целевой продукт формирует мелкие игольчатые кристаллы.
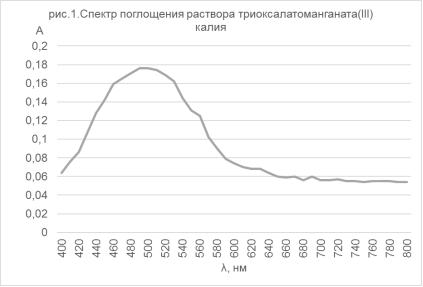
Для раствора продукта, полученного по методике [4], был снят vis-спектр (рис.1), на котором виден характерный максимум при 515 нм [7], что также подтверждает наличие ионов [Mn(C2O4)3]3- в растворе.
Синтез K3 [Mn(C2O4)3]х3H2O также был произведен по иной методике [5] с выходом 49 %. Произведены эксперименты с добавлением вышеупомянутых спиртов для осаждения целевого продукта, результаты оказались такими же, как и в случае растворов, полученных при синтезе по первой методике.
Для получения триоксалатоманганата (III) калия без примеси оксалата калия была использована методика [6], оксид-гидроксид марганца (III) для которой был получен по методике [4] с выходом в 89 %.
В ходе исследования установлено, что порядок прибавления к р-ру сульфата марганца пероксида водорода и р-ра аммиака не имеет значения. В самом деле, раствор остается прозрачным после добавления H2O2, а затем при добавлении аммиака раствор превращается в коричневую суспензию MnOOH. При обращении порядка смешивания данных реагентов первоначально наблюдается выпадение телесно-розового осадка Mn(OH)2 в виде творожистой взвеси крошечных частиц, который затем при добавлении пероксида водорода превращается в суспензию MnOOH.
Целевой продукт выделен с выходом 60 %, титриметрическое определение оксалат-ионов и марганца (III) дало соотношение n(C2О42-)/n(Mn(III)) = 2,98, что указывает на достаточно высокую степень чистоты полученного продукта.
Структура комплекса исследуется в работе [17].
Диоксалатодигидроксоманганат (IV) калия. Синтез K2 [Mn(C2O4)2(OH)2] осуществлялся по методике [8], которая позволяет получить продукт в виде двухводного кристаллогидрата. Было отмечено, что продукт выделяется с примесью, предположительно, триоксалатоманганатом (III) калия. Более того при использовании менее эффективной охлаждающей смеси (ледяная баня вместо сухого льда) количество данной примеси значительно увеличивалось. Перекристаллизация по методике [4] помогла избавиться от большей части примесей.
Вместе с тем, синтез K2 [Mn(C2O4)2(OH)2] производился по методике [8], позволившей получить безводный продукт, отличавшийся (в полном соответствии с [8]) большей стабильностью, нежели кристаллогидрат, но выделить его без примеси KMnO4 не удалось. Было высказано предположение, что появлению данной примеси способствует использование для инициирования осаждения целевого продукта раствора KOH в этаноле.
9-молибдоманганат (IV) аммония. (NH4)6 [MnMo9O32]х6Н2О получен по методике [9] с заменой гептамолибдата аммония на (NH4)2MoO4 с сохранением соотношения Mo:Mn. Синтез с этими же исходными реагентами был выполнен с последующей отгонкой воды при нагревании при пониженном давлении. Это снизило выход целевого продукта, после отделения которого при стоянии маточного раствора в течении нескольких часов при комнатной температуре из него выпадал желтый осадок, предположительно 12-молибдоманганат (IV) аммония [10].
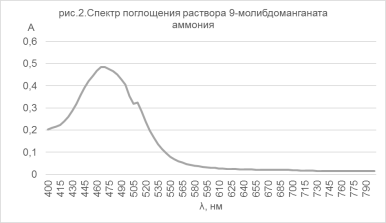
Получен спектр раствора данного соединения (рис.2), вполне согласующийся с [11].
Структура комплекса исследуется в работе [18].
Манганат (V) натрия. Na3MnO4х 0,25NaOHх12H2O был синтезирован по методике [4]. Проводились эксперименты с изменением условий проведения синтеза. Было выяснено, что наиболее оптимальна температура 295–296 К. Сульфит также добавлялся в виде водного раствора (12,5 мл) с сохранением суммарного объема системы и количеств веществ неизменными, но к большому увеличению выхода это не привело. Отмечено, что в открытой колбе после добавления сульфита как в растворенном виде, так и в виде порошка, происходит переход окраски раствора перманганата в темно-синюю (вероятнее всего, по причине образования смешанного манганата (VI)/(VII) [12]), затем в присущую манганату (VI) изумрудно-зеленую без дальнейшего образования манганата (V). При закрытии колбы после добавления сульфита наблюдается постепенное образование продукта.
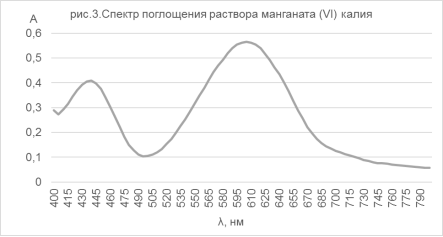
Манганат (VI) калия. Синтез K2MnO4 был произведен по методике [4] с выходом 94 %. Чистота целевого продукта проверена по vis-спектру (рис.3), который соответствует приведенному в [13].
13-ванадоманганат (IV) калия. Синтез соединения осуществлялся по двум методикам.При использовании первой [9] сделано интересное наблюдение: с каждой каплей азотной кислоты раствор становился все более оранжевым. В качестве эксперимента вместо использования ротационного испарителя упаривание раствора производилось при нагревании в сосуде под пониженным давлением. В одном из экспериментов раствор был вместо 60–800С нагрет до кипения, и желтое вещество было обнаружено на дне колбы. Нами было высказано предположение, что это вещество — V2O5. В отличие от работы [16], где указывается, что выпавшая смесь вскоре растворялась вновь, окрашивая раствор в оранжевый цвет, в данном случае выпавший оксид ванадия (V) оставался на дне и не претерпевал никаких изменений — реакция не шла дальше.
При использовании другой методики [16] был сделан вывод, что несмотря на бо́льшую сложность в исполнении первой методики, она более точно и полно описывает порядок действий при синтезе, поэтому именно эту методику мы рекомендуем использовать как основную для синтеза K7 [MnV13O32]х18Н2О.
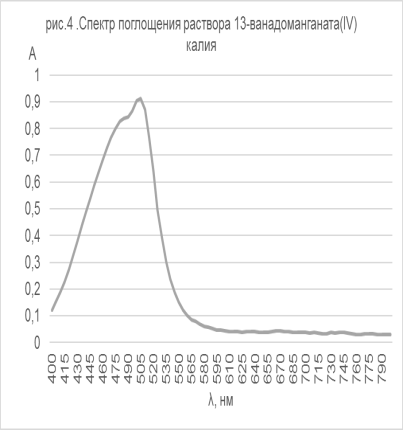
Для раствора 13-ванадоманганата, полученного по методике [9], впервые, по нашим данным, был снят vis-спектр (рис.4).
Сульфид марганца (II). По методике [4]был осуществлен синтез α-модификации MnS. Сероводород генерировался параллельно по реакции парафина с ромбической серой в небольшой термостойкой пробирке с газоотводной трубкой по методике [14]. В ходе реакции продукт из бледно-розового переходил в коричневато-зеленый, в полном соответствии с методикой. Для сушки продукт был помещен в эксикатор над КОН, где приобрел фиолетово-коричневый цвет. Это свидетельствует о потере продукта на данном этапе, вероятнее всего, по причине его окисления до MnO2.
Манганат (VII) серебра (I). Синтез данного соединения был осуществлен по методике [4]. Ввиду небольшой растворимости вещества в воде (0,9 г / 100 мл при 25℃) был осажден очень темный, практически черный продукт в виде блестящих игольчатых кристаллов, легко отделимых от белой примеси KNO3.
Комплекс марганца (II) сглицином. Данное соединение было синтезировано при использовании методики [15]. В ходе проведения опыта было предложено удвоить количества реагентов при сохранении объема растворителя и сократить время ожидания, несмотря на потерю возможности выделения крупных кристаллов, необходимых для кристаллографических исследований. Полученный продукт был высушен и представлял из себя чисто-белый порошок, склонный к образованию комочков.
Выводы
В работе нами были рассмотрены методы синтеза некоторых видов комплексных соединений марганца: ацидокомплексы, фиксирующие марганец в нестандартной степени окисления, а также перспективные сегодня гетерополисоединения Mn и Mo, Mn и V. Вместе с тем синтезы были не только проведены, но и исследованы на недостатки. Для проведения синтеза триоксалатоманганата (III) калия нами рекомендована методика [6], а для 13-ванадоманганата (IV) калия — [9].
Благодарности
Авторы хотели бы выразить благодарность за помощь в проведении работ Выприцкой А., Золенко М., Белонович В., Александровой Н., Сазонову П., Шкурецкому К., Ковалевскому Р., а также Химическому Центру при ПФМЛ № 239 за предоставление лаборатории.
Литература:
- A. R. Memon, M.Yatazawa. // Journal of plant nutrition. — 1984. — № 7(6). — С. 961–974.
- S. G. Ionescu, T. Oncescu. // Journal of Photochemistry. — 1982. — № 20. — С. 299–304.
- A. Sirota. The competition problems from the International Chemistry Olympiads, Volume 2. — Bratislava, Slovakia: IUVENTA, 2009. — 733 с.
- Г.Брауэр. Рук-во по неорг. синтезу в шести томах, том 5. — М.: МИР, 1985. — 360 с.
- H.Hecht. Präparative anorganische Chemie. — Berlin-Göttingen-Heidelberg: Springer-Verlag, 1951. — 217 с.
- Manabendra N. Bhattacharjee, Mihir K. Chaudhuri, and Ranendra N. Dutta Purkayastha. Direct Synt. of Potassium Tris(oxalato)manganate(III) and First Synt. of Alkali-Metal and Ammonium Trifluoro(oxalato)manganates(III) // Inorg. Chem. — 1985. — № 24. — С. 447–449.
- Ranendra N. Dutta Purkayastha. PhD Diss. (Chem). — Shillong: The North-Eastern Hill University, 1987.
- G. H. Cartledge,W. P. Ericks. An Oxalato Complex of Quadrivalent Manganese // J. Am. Chem. Soc. — 1936. — № 58. — С. 2069–2072.
- Г.Брауэр. Рук-во по неорг. синтезу в шести томах, том 6. — М.: МИР, 1986. — 360 с.
- Третьяков Ю. Д. Неорг. химия в 3 т., том 3, книга 1. — М.: Академия, 2008. — 350 с.
- L. C. W.Baker, T. J. R.Weakley. The stabilities of the 9-molybdomanganate(IV) and 9-molybdonickelate(IV) ions // J. of Inorg. and Nuclear Chem. — 1966. — № 28.— С. 2069–2072.
- M. B. Hursthouse, K. C. Quillin, D. R. Rosseinsky. Single-crystal Mixed-valent Tripotassium Manganate(VI)/(VII) // J. Chem. Soc. Faraday Trans. — 1992. — № 88. — С. 3071–3077.
- G. Den Boef, H. J. van der Beek, Th. Braaf. // Recueil des Travaux Chimiques des Pays-Bas. — 1958. — № 77. — С. 1064–1070.
- Гроссе Э., Вайсмантель X. Химия для любознательных. Основы химии и занимательные опыты. — 2-е русское изд. — Издательство «Химия», 1985. — 336 с.
- R. Mrozek, Z. Rzączyńska, M. Sikorska-Iwan, and T. Głowiak. // Journal of Chemical Crystallography. — 1999. — Vol. 29, No. 7. — С. 803–808.
- C. M. Flynn, Jr., and Michael T. Pope. 1: 13 Heteropolyvanadates of Manganese(IV) and Nickel(IV) // Journal of the American Chemical Society. — 1970. — 92:1. — С. 85–90.
- K. NAGAI, H. ICHIDA, Y. SASAKI. The Structure of Heptapotassium Tridecavanadomanganate (IV) Octadecahydrate, K7 [MnV13O38]×18H2O // Chem. letters. — 1986. — С. 1267–1270.
- S. Holguin Quinones, G. Z. Kaziev, A. V. Oreshkina, A. de Ita, V. E. Zavodnik, and T. Yu. Glazunova. Synthesis, Thermal Analysis, IR Spectra, and Crystal Structure of Ammonium 9-Molybdomanganate // Russian journal of coordination chemistry. — 2007. — № 6. — С. 412–416.







