Подготовка обучающихся к ЕГЭ — сложный и многогранный процесс, его компоненты: мотивация, психологическая готовность к экзамену и формирование высокого уровня предметных результатов образования за счет использования системно-деятельностного подхода. Сущность системно-деятельностного подхода проявляется в формировании личности воспитанника и продвижении его в развитии не тогда, когда он воспринимает знания в готовом виде, а в процессе его собственной деятельности, направленной на «открытие нового знания». Для предмета химии «открытие нового знания» в процессе его собственной деятельности — это, прежде всего практическая деятельность — постановка цели, проведение эксперимента и формулирование выводов. В специфике ЕГЭ задача № 34 оказалась «твердым орешком». При изучении темы «Металлы» обучающиеся осваивают теоретические вопросы электролиза расплавов и растворов, при этом тестовые вопросы на электролиз не вызывают затруднений, а задача на электролиз раствора для многих обучающихся оказалась сложной. Какой прием применить, чтобы обучающиеся поняли решение задачи не в результате объяснения учителя, а в процессе собственной деятельности? Когда теория пройдена и усвоена, можно приступить к решению задачи практическим способом. Такой подход можно использовать в классах с углубленным изучением предмета, на элективных курсах, при подготовке к ЕГЭ по химии.
Цель работы состоит в применении поэтапного подхода к решению задачи при помощи эксперимента, обучающиеся отрабатывают умения приготовления растворов, закрепляют знания об электролизе, повторяют закон Фарадея, получают навыки решения задач повышенной сложности.
Для этого можно использовать технологию работы в группах. Класс делят на 5 групп. Каждой из них выдается в начале занятия одна и та же задача. Для начала ее выполнения каждую группу обеспечивают необходимым оборудованием и реактивами для проведения опыта.
Оборудование иреактивы: U-образная трубка с одним патрубком, графитовые электроды; прибор питания постоянным напряжением 6 В, мультиметр, электронные весы; лучина; 2 пипетки; безводный сульфат меди(II); 20 %-ный гидроксид натрия, дистиллированная вода.
Задача
Для проведения электролиза (на инертных электродах) взяли 25 г 16 %-ного раствора сульфата меди(II). После того как на аноде выделилось 56 мл (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 4,92 г. Вычислите массу 20 %-ого раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
Учитель и обучающиеся составляют план решения, для чего разбивают условие задачи на 3 составные части.
1часть: Для проведения электролиза (на инертных электродах) взяли 25 г 16 %-ного раствора сульфата меди(II). После того как на аноде выделилось 56 мл (н.у.) газа, процесс остановили.
2 часть: Из полученного раствора отобрали порцию массой 4,92 г
3 часть: Вычислите массу 20 %-ого раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
Приступаем крешению 1 части задачи:
1 этап — теоретическая часть.
Обучающиеся обсуждают происходящий процесс — электролиз расплава или раствора. Какой металл образует соль — активный, средней активности или малоактивный. Какой анион в составе соли — бескислородный или кислородсодержащий. В зависимости от этого предполагают процессы, происходящие на катоде и аноде. Записывают уравнение реакции электролиза для предложенной задачи. Делают предварительные расчеты для приготовления раствора соли из условия задачи. По закону Фарадея рассчитывают силу тока, при заданном времени протекания процесса.
Рассуждения обучающихся: сульфат меди образован катионами меди, которая находится в ряду активности после водорода. Кислотный остаток от кислородсодержащей кислоты. Значит, продуктами электролиза будут являться свободный металл медь, кислота и кислород. Уравнение реакции электролиза:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑
Рассчитаем массу исходного безводного сульфата меди(II) и массу воды для приготовления раствора.
ω = m (исх. CuSO4): mр-ра; m (исх. CuSO4) = ω ∙ mр-ра
m (.исх CuSO4) = 0,16 ∙ 25 г = 4 г
m (H2O) = 25 г — 4 г = 21 г
n (.исх CuSO4) = 4 г: 160г/моль = 0,025 моль
Рассчитаем силу тока, для того чтобы на аноде выделилось 56 мл кислорода. Пусть время, за которое нам надо окончить процесс электролиза 5 минут (300 секунд). Используем закон Фарадея:
m =MЭ∙I ∙τ/F; I = V∙F/VЭ∙τ, где VЭ — эквивалентный объем газа.
Эквивалентный объем кислорода VЭ при нормальных условиях равен
VЭ = 22,4 ∙8/32 = 5,6 л/моль
I = 0,056 ∙ 96500/5,6 ∙ 300 = 3,22 А
Рассчитаем количество вещества выделяющегося кислорода:
n(O2) = 0,056 л: 22,4 л/моль = 0,0025 моль
2 этап — практическая часть.
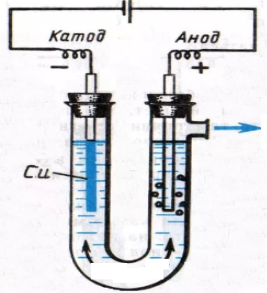
Обучающиеся готовят заданную массу раствора соли определенной концентрации, и подвергают ее электролизу в течение 5 минут. Определение газообразного вещества осуществляют с помощью зажженной лучины.
3 этап работы — анализ проведенного эксперимента.
Обучающиеся делают вывод о причинах уменьшения массы раствора.
На основании этого вывода продолжают теоретические расчеты.
По известному количеству вещества кислорода можно посчитать количество вещества безводного сульфата меди, вступившего в реакцию (используя уравнение реакции):
n (прореаг. CuSO4) = 2 ∙ n (O2) = 2 ∙ 0,0025 моль = 0,005 моль
Можно рассчитать количество вещества безводного сульфата меди, оставшегося в растворе после реакции:
n (ост. CuSO4) = n (.исх CuSO4) — n (прореаг. CuSO4) = 0,025 моль — 0,005 моль = 0,02 моль
В водном растворе после электролиза содержится серная кислота. Количество вещества серной кислоты тоже рассчитываем по уравнению реакции:
n (H2SO4) = 2 ∙ n(O2) = 2 ∙ 0,0025 моль = 0,005 моль
Найдем массу оставшегося раствора после электролиза. В конечный раствор не будут входить массы кислорода и масса выделившейся меди. Вычисляем массы кислорода и меди:
m (O2) = n (O2) ∙ M (O2) =0,0025 моль ∙ 32 г/моль = 0,08 г
n (Cu) = 2 ∙ n (O2) = 2 ∙ 0,0025 моль = 0,005 моль
m (Cu) = n (Cu) ∙ M (Cu) = 0,005 моль ∙ 64 г/моль = 0,32 г
m (конечного раствора) = m (исходного раствора) — m (O2) — m (Cu)
m (конечного раствора) = 25 г — 0,08 г — 0,32 г = 24,6 г
Приступаем крешению 2 части задачи:
1 этап — теоретическая часть.Обучающиеся делают выводы о качественной составляющей порции массой 4,92 г. Онианализируют условие 2 части задачи и рассчитывают, что 4,92 г является 1/5 частью от массы начального раствора (4,92: 24,6 = 1: 5) и делают предположения о том, из каких веществ состоит порция массой 4,92 г.
2 этап — практическая часть.Обучающиеся отбирают порцию вещества 5г пипеткой путем взвешивания (учитывают массу емкости, в которой взвешивают).
3 этап работы — анализ проведенного эксперимента. Обучающиеся делают теоретические расчеты о количестве каждого вещества в порции. Поскольку отобрали 1/5 часть раствора, следовательно, отобрали 1/5 моль сульфата меди(II) и 1/5 моль серной кислоты. После электролиза раствор содержал 0,02 моль CuSO4 и 0,005 моль H2SO4. Можно найти количества веществ CuSO4 и H2SO4 в отобранной порции:
n (CuSO4 в порции) = 0,02 моль: 5 = 0,004 моль
n (H2SO4 в порции) = 0,005 моль: 5 = 0,001 моль
Приступаем крешению 3 части задачи:
1 этап — теоретическая часть. Обучающиеся делают предположения о том, что гидроксид натрия будет реагировать с двумя составляющими в порции 4,92 г — с сульфатом меди, оставшимся после электролиза и серной кислотой, образовавшейся в результате электролиза.
Учитель уточняет: гидроксид меди не способен образовываться в кислой среде, т.е сначала должна быть нейтрализована вся кислота, и только после этого сульфат меди будет реагировать с гидроксидом натрия.
Обучающиеся записывают 2 уравнения реакции:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (I)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 (II)
Находят количество вещества безводного гидроксида натрия для этих двух реакций.
n (NaOH) (I) = 2 ∙ n (H2SO4 в порции) = 2 ∙ 0,001 моль = 0,002 моль
n (NaOH) (II) = 2 ∙ n (CuSO4 в порции) = 2 ∙ 0,004 моль = 0,008 моль
n (NaOH всего) = 0,002 моль + 0,008 моль = 0,01 моль
m (NaOH всего) = 0,01 моль ∙ 40 г/моль = 0,4 г
Затем рассчитывают массу 20 %-ого раствора гидроксида натрия.
m (раствора NaOH) = m (NaOH всего): ω (NaOH) = 0,4 г: 0,2 = 2 г
2 этап — практическая часть. Обучающиеся отбирают пипеткой 2 г 20 %-ого раствора гидроксида натрия (учитывают массу пустого химического стакана) и приливают его к порции массой 4,92 г.
3 этап работы — анализ проведенного эксперимента.
Обучающиеся делают выводы по наблюдениям о появлении осадка синего цвета. Затем делают общий вывод по решению данной задачи.
С целью закрепления усвоенного способа деятельности, учитель предлагает каждой группе решить подобные задачи, например:
Задача для 1 группы:
Для проведения электролиза (на инертных электродах) взяли 282 г 40 %-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40 %-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Задача для 2 группы:
Для проведения электролиза (на инертных электродах) взяли 340 г 20 %-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79, 44 г. Вычислите массу 10 %-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
Задача для 3 группы:
Для проведения электролиза (на инертных электродах) взяли 312 г 15 %-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20 %-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
Задача для 4 группы:
Для проведения электролиза (на инертных электродах) взяли 360 г 18,75 %-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Задача для 5 группы:
Для проведения электролиза (на инертных электродах) взяли 500 г 16 %-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10 %-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
Таким образом, использование поэтапного решения задач и обязательное закрепление способа действия обеспечивает формирование у обучающихся навыков и предметных результатов образования, необходимых для успешного выполнения заданий ЕГЭ.







