Проведено исследование общей обсемененности бутилированной воды шести различных торговых марок. Был произведен подсчет количества колоний микроорганизмов, определен характер роста на различных средах с момента открытия бутылей воды и повторным исследованием в 1, 3, 7 день со дня вскрытия.
Ключевые слова: обсемененность, питьевая вода, колонии.
Цель работы: изучить общее микробное число (ОМЧ) бутилированной питьевой воды различных торговых марок и оценить скорость обсемененности воды с момента ее открытия.
Материалы иметоды: Оценка качества воды производится комплексно: по санитарно-микробиологическим показателям с учетом органолептических и химических данных и регламентируется соответствующими ГОСТами.
При оценке питьевой воды руководствуются основным требованием: она не должна содержать патогенных бактерий и вирусов [2]. При оценке ОМЧ воды исходят из того, чтобы в 1 мл содержалось не более 50 колоний.
Данное исследование проводилось на базе лаборатории кафедры микробиологии, вирусологии БГМУ, г. Уфа. Анализ микробной обсемененности бутилированной воды проводили в течение 7 дней. Для исследования было взято шесть образцов воды 6 различных торговых марок:
1— «Красный ключ», 2—«Красноусольская», 3—«Святой источник», 4—«Aquantika», 5—«Evian», 6—«Bon Aqua».
Перед посевом воду тщательно перемешивали, так как некоторые виды микроорганизмов имеют свойство оседать. Края емкости так же обеззараживали при помощи спиртового тампона. На используемых пробирках и чашках обозначили номер пробы и дату посева. Перед каждым отбором новой порции воды для анализа мы перемешивали пробу стерильной пипеткой [1]. Общее количество бактерий в бутилированной воде мы определили путём посева 1 мл воды в стерильные чашки Петри, в которые затем последовательно прилили остуженные до 42–45 ˚С питательный агар, среду Эндо, среду Сабуро. В итоге мы получили 18 чашек Петри: чашки с питательным агаром и средой Эндо после застывания поместили вверх дном в термостат и инкубировали в течение 24±2 часов при температуре 37±1 ˚С, а затем в течение 24±2 часов при температуре 20–23 ˚С на свету, чашки со средой сабуро оставили на столе при комнатной температуре на 5 суток. Затем производили подсчёт выросших колоний микробов и изучали их морфологические и культуральные свойства. Идентификацию микроорганизмов проводили бактериоскопическим методом с предварительным приготовлением мазков и окрашиванием их методом по Граму и последующим использованием иммерсионной микроскопии. Проведённое лабораторное исследование повторяли по прошествии трёх и семи дней после вскрытия бутылей.
Результаты иобсуждение. После посева на Питательный агар (ПА) было проведено исследование выросших колоний. Результат первого дня был отрицательным. На третий день был обнаружен сплошной рост колоний мутного цвета в пробах 2 и 5. На седьмой день был отмечен равномерный рост белых мелких изолированных колоний в количестве около 440, в последующих пробах 450, 330, 390, 550, 340 соответственно (Табл 1). Колонии, проросшие на питательном агаре, были подвергнуты микроскопированию. Мазки окрашивали по Граму. Под микроскопом были обнаружены грамположительные и грамотрицательные палочки (Рис 1,A).
На средах Эндо, используемых для дифференциальной диагностики кишечной группы микроорганизмов, на первый и третий день роста не наблюдалось. На седьмой день в первой пробе проросла гладкая, блестящая единичная колония ярко-розового цвета. Во второй и последующих пробах был обнаружен рост изолированных колоний бледно-розового цвета в количестве 11, 10, 14, 15, 27 соответственно (Табл 2). Проросшие колонии также подверглись микроскопированию. Под микроскопом в препаратах были обнаружены грамположительные и грамотрицательные палочки (Рис 1, B).
На средах Сабуро на первый день отмечался сплошной рост колоний в первой, четвёртой и пятой пробах. В чашках под номером 2,3 и 6 отмечался рост только одной колонии, а в чашке под номером 5 проросла 171 колония различных размеров. На третий день в первой и второй пробах наблюдался рост только одной колонии, в третей пробе- одна крупная колония и множество мелких изолированных, в четвёртой-большое количество мелких изолированных колоний, в пятой- 40 крупных изолированных колоний и также сплошной рост, в шестой-большое количество мелких изолированных колоний,20 крупных изолированных. На седьмой день наблюдался рост одной крупной колонии и 240 мелких изолированных, во второй- 3 крупных колоний, в третей- 2 мелких изолированных, в четвёртой- только одна колония среднего размера, в пятой- 395 колоний различного размера, в шестой отмечался сплошной рост колоний (Табл. 3). Проросшие колонии подверглись микроскопированию. Под микроскопом были обнаружены грамположительные и грамотрицательные палочки и кокки, актиномицеты (Рис 1, C).
Результаты подсчета колоний представлены в таблицах.
Таблица 1
ОМЧ на среде Питательный агар
|
№чашки день |
1 |
2 |
3 |
4 |
5 |
6 |
|
1-й день |
- |
- |
- |
- |
- |
- |
|
3-й день |
- |
Сплошной рост колоний на 4-й день после посева |
- |
- |
Сплошной рост колоний на 4-й день после посева |
- |
|
7-й день |
Равномерный рост мелких изолированных колоний, насчитывается около 440 |
450 |
330 |
390 |
550 |
340 |
Таблица 2
ОМЧ на среде Эндо
|
№чашки день |
1 |
2 |
3 |
4 |
5 |
6 |
|
1-й день |
- |
- |
- |
- |
- |
- |
|
3-й день |
- |
- |
- |
- |
- |
- |
|
7-й день |
1 среднего размера |
11 мелких изолированных |
10 изолированных |
13 мелких изолированных, 1 крупного размера |
14 мелких изолированных, 1 крупного размера |
27 мелких изолированных |
Таблица 3
ОМЧ на среде Сабуро
|
№чашки день |
1 |
2 |
3 |
4 |
5 |
6 |
|
1-й день |
Сплошной рост |
1 изолированная колония |
1 изолированная колония |
Сплошной рост |
130 мелких, 9 крупных, 32 средних изолированных колоний, сплошной рост |
1 изолированная колония |
|
3-й день |
1 мелкая изолировання колония |
1 мелкая изолировання колония |
1 крупная колония, Большое количество мелких изолированных колоний |
Большое количество мелких изолированных колоний |
40 крупных изолированных, сплошной рост |
Большое количество мелких изолированных колоний, 20 крупных изолированных |
|
7-й день |
1 крупная изолированная, 240 мелких изолированных колоний |
3 крупных изолированных колоний |
2 мелких изолированных колоний |
1 средняя изолированная колония |
80 крупных изолированных колоний, 315 мелких изолированных колоний |
Сплошной рост неправильной формы |
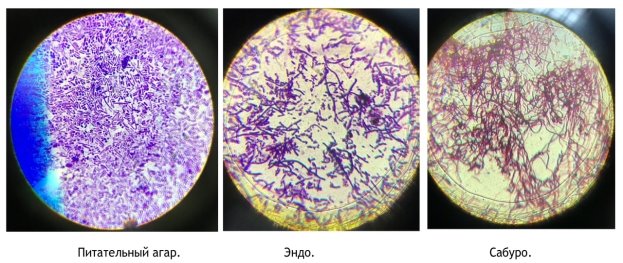
Рис. 1
Заключение ивывод. Таким образом, наибольшее количество микроорганизмов появилось на седьмой день с момента открытия бутылей с водой. Наибольшее ОМЧ на среде ПА отмечалось в воде под номером 5 (Evian) и 2 (Красноусольская) по 550 и 450 колоний соответственно, что превышает допустимые показатели в 10 раз. ОМЧ на среде Эндо во всех пробах соответствует допустимой норме. На среде Сабуро, в первый день эксперимента, наименьший рост показали пробы под номером 2 (Красноусольская), 3 (Святой источник), 4 (Aquantika). На третий и седьмой день после вскрытия бутылей вода подвергается обильному обсеменению микроорганизмами за счет роста общего числа микроорганизмов, в том числе спорообразующих, которые дают активный рост. Микроорганизмы патогенной кишечной группы не обнаружены. Подводя итог нашей работы, мы хотим сказать, что употреблять воду прошествии трех суток с момента открытия бутылей не рекомендуется.
Литература:
- Кочемасова З. Н., Ефремова С. А. Санитарная микробиология и вирусология— М.:Медицина, 1987.— 116 с.
- Колычев Н. М., Госманов Р. Г. Ветеринарная микробиология и микология: Учебник. — СПб.: Лань, 2014. — 624 с.
- ГОСТ 18963–73 Вода питьевая. Методы санитарно—бактериологического анализа (с изменениями N1, 2) — раздел 4, пункт 1.7







