В данной статье рассматривается влияние кислотности почвы (pH) на скорость разложения щелочных элементов питания, на выделение одного из тяжелых металлов — цинка на примере построения модельного эксперимента.
Ключевые слова: цинк, щелочной элемент питания, кислотность, тяжелые металлы.
This article discusses the effect of soil acidity (pH) on the rate of decomposition of alkaline batteries, on the release of one of the heavy metals — zinc on the example of constructing a model experiment.
Keywords: zinc, alkaline battery, acidity, heavy metals.
Можно выделить множество источников поступления цинка в почвы, таких как атмосферные осадки, перенос частиц, содержащих цинк, на различные расстояния и их осаждение на поверхность почвы, листьев растений и т. д. Также, загрязнение почв цинком может происходить в результате антропогенной нагрузки на территорию не только различными промышленными производствами, но и в ходе нашей обычной, повседневной жизни.
Главной целью модельного эксперимента является выявить зависимость кислотности почвы на скорость разложения щелочных элементов питания, а также влияние кислотности на подвижность цинка в почве.
Для проведения эксперимента были взяты 3 емкости с почвой (песчаная), в каждую из которых был помещен щелочной элемент питания фирмы «Energizer» (ААА). В течение полугода образцы были подвергнуты воздействию дистиллированной воды с разным показателем pH.
Для подкисления почвы были выбраны следующие значения pH:
pH водной вытяжки составила 3,8.
- pH = 5,7
- pH = 3,1
- pH = 2,5
Для определения количественного содержания цинка в данных образцах используется методика, основанная на образовании устойчивого комплекса цинка с трилоном Б в слабокислой среде. При титровании соединений цинка с трилоном Б в присутствии индикатора ксиленолового оранжевого красно-коричневая окраска комплекса «цинк-индикатор» в точке эквивалентности изменяется на желто-оранжевую, соответствующую комплексу «цинк-трилон».
Содержание цинка (г/дм3) вычисляют по формуле:
GZn =![]() ,
,
где a — объем раствора трилона Б, пошедшего на титрование, см3;
N — нормальность раствора трилона Б;
32,69 — грамм-эквивалент Zn в данной реакции с трилоном Б;
V — объем анализируемой пробы, см3.
Результаты расчетов:
- Контрольная проба (pH =3,8) — 0,7 мг/кг;
- Проба № 1 (pH = 5,7) — 0,6 мг/кг;
- Проба № 2 (pH = 3,1) — 0,8 мг/кг;
- Проба № 3 (pH = 2,5) — 0,007 мг/кг.
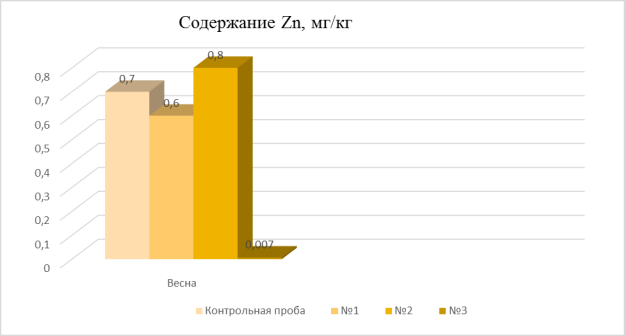 Рис. 1. Сезонная динамика Zn
Рис. 1. Сезонная динамика Zn
Вывод: из полученных результатов видно, что наименьшее значение содержания Zn наблюдается в пробе № 3 с кислотностью 2,5, т. к. соединения Zn обладают энергичной миграцией в кислых растворах и слабоподвижной в нейтральных и щелочных растворах, следовательно, в контрольной пробе, а также в пробе № 1 и № 2 примерно равные показатели содержания Zn при сравнительно одинаковых значениях кислотности почвы.
Литература:
- Организация научно-исследовательской деятельности студентов: теоретико-прикладной аспект: учебное пособие / Н. П. Несговорова, В. Г. Савельев, Н. А. Неумывакина, Г. В. Иванцова. — Курган: Изд-во Курганского гос. ун-та, 2017. — 352 с.
- Мониторинг загрязнения цинком и кадмием городских почв в системе обеспечения экологической безопасности урбанизированных территорий/ Журнал «Технологии техносферной безопасности», 2017, С.87–100.
- Формы соединений тяжелых металлов в почвах урбанизированных ландшафтов в зоне воздействия промышленных комплексов/ Журнал «Экология России: на пути к инновациям», 2014, С. 126–131.







