В статье описан способ синтеза медного комплекса фталоцианина на основе 5-гидроксихинолиновой кислоты, исходным сырьём для синтеза являлся хинолин. Результатом работы является сдвиг полосы поглощения полученного соединения в более длинноволновую область, что даёт потенциальную возможность применения его в качестве фотосенсибилизатора в ФДТ. Максимум поглощения полученного соединения — 720 нм, тогда как максимум поглощения немодифицированного медного комплекса фталоцианина — 642 нм.
Ключевые слова: фотодинамическая терапия, фталоцианин, 5-гидроксихинолиновая кислота.
Фталоцианины, представляющие собой макрогетероциклические соединения с 18π-электронной ароматической системой, наравне с использованием в качестве текстильных красителей, фотоактиваторов роста микроорганизмов, катализаторов восстановления кислорода, также являются перспективными сенсибилизаторами для фотодинамической терапии (ФДТ) раковых опухолей.
Фталоцианины образуют с переходными металлами (Cu, Ni, Pd, Os и др.) высокоустойчивые комплексные соединения. В литературе описано большое количество примеров использования металлокомплексов фталоцианинов в качестве фотосенсибилизаторов, например [1]. Недостатками данных соединений для широкого внедрения является низкая биодоступность вследствие низкой водорастворимости, а также то, что их фотовозбуждение протекает при облучении светом с длиной волны ~700 нм, тогда как наиболее перспективными для ФДТ являются соединения с максимумом поглощения в области 750–850 нм (так называемое «терапевтическое окно»). В связи с этим нами была поставлена цель синтезировать медный комплекс фталоцианина, содержащий гидрофильные группы и имеющий максимум поглощения в области «терапевтического окна». Введение гидроксильной группы и замена бензольных колец в цикле на пиридиновые должны были способствовать сдвигу полосы поглощения в длинноволновую область.
Обсуждение полученных результатов
В качестве исходного соединения для синтеза использовали 5-гидроксихинолиновую кислоту (I). Соединение (I) было получено из хинолина последовательно через 3-бромхинолин и 3-гидроксихинолин. Синтез комплекса (II) (рис. 1) проводили твёрдофазно при микроволновом облучении по методике, описанной в источнике [2].
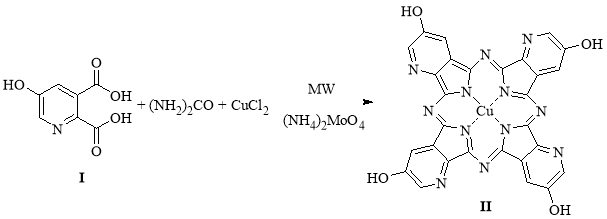
Рис. 1. схема синтеза медного комплекса фталоцианина на основе 5-гидроксихинолиновой кислоты
Комплекс (II) был получен с выходом 58 %. В электронном спектре поглощения (раствор в ДМФА) полученного соединения (II) наблюдается пик поглощения при 720 нм, тогда как в спектре немодифицированного медного комплекса фталоцианина — при 642 нм. Таким образом, замена бензольных колец на пиридиновые и введение в молекулу металлокомплекса гидроксильных групп приводит к батохромному сдвигу в его спектре поглощения. Также введённая гидроксильная группа позволяет проводить дальнейшие модификации для повышения водорастворимости, например, конденсацию с полиэтиленгликолем (ПЭГ).
Экспериментальная часть
Получение 3-бромхинолина. В круглодонную колбу объёмом 250 см3, снабжённую форштоссом, обратным холодильником с хлоркальциевой трубкой и капельной воронкой помещали 0,2 моль (25,8 г; 23,7 см3) хинолина. В течение 3 ч при перемешивании при комнатной температуре прикапывали раствор 0,2 моль (32,0 г; 10,3 см3) брома в 150 см3 тетрахлорметана к хинолину. Образовавшийся оранжевый осадок бромхинолинового комплекса отфильтровывали на воронке Бюхнера и сушили в вакуумном эксикаторе. Получили 49,0 г комплекса ярко-оранжевого цвета с т. пл. 120°C. Расплавляли бром-хинолиновый комплекс в круглодонной колбе объёмом 250 см3, снабжённой форштоссом, обратным холодильником с хлоркальциевой трубкой и капельной воронкой. В течение 3 ч при перемешивании и кипячении прикапывали раствор 0,2 моль (16,0 г; 16,3 см3) пиридина в 50 см3 тетрахлорметана. После окончания прикапывания, смесь кипятили в течение ещё 10 ч. После охлаждения реакционную смесь фильтровали, фильтрат перегоняли под вакуумом, отбирая фракцию с т. кип. 150–160°C (20,0 мм. рт. ст.). Продукт представлял собой жидкость бледно-жёлтого цвета. Выход: 105,8 ммоль (22,0 г; 52,8 % от теоретического). Масс-спектр, m/z (Iотн, %): 209 (50,9); 207(53,6); 128 (100,0); 101 (53,3); 75 (31,6).
Получение 3-гидроксихинолина. В реакционный сосуд из карбида кремния для микроволнового реактора объёмом 10 см3 помещали 5,8 ммоль (1,20 г) 3-бромхинолина, 15,0 ммоль (0,60 г) гидроксида натрия, 2,9 ммоль (0,72 г) пятиводного сульфата меди (II) и 5 см3 20 % водного раствора этанола. Сосуд герметично закрывали с помощью специальной септы, помещали в реактор и нагревали микроволновым излучением, поддерживая температуру 180°C и давление 14–15 атм. в течение 4 часов. Затем реакционную смесь охлаждали до комнатной температуры и фильтровали через слой силикагеля на воронке Шотта, промывали 15 см3 20 % водного раствора этанола. Фильтрат нейтрализовывали соляной кислотой до pH 7. Выпавший осадок отфильтровывали, промывали 30 см3 воды. Перекристаллизовывали из смеси бутанол-толуол (1:2,5). Продукт представляет из себя кристаллическое вещество кремового цвета. Выход: 4,5 ммоль (0,65 г; 76,8 % от теоретического), Т. пл. 198–200°C. Масс-спектр, m/z (Iотн, %): 145 (100,0); 117 (23,5); 89 (63,0); 63 (39,3); ЯМР 1H спектр (ДМСО-d6, δ, м.д.): 7,48 (m, 3H); 7,77 (d, 1H); 7,90 (d, 1H); 8,62 (s, 1H); 10,27 (s, 1H); ЯМР 13C спектр (ДМСО-d6, δ, м.д.): 115,88; 126,33; 127,03; 127,21; 129,15; 143,02; 144,47; 151,48.
Получение 5-гидроксихинолиновой кислоты (I). В круглодонную колбу объёмом 50 см3, снабжённую обратным холодильником, помещали 3,0 ммоль (0,43 г) 3-гидроксихинолина, суспендированного в 20 см3 воды и 3,0 ммоль (0,12 г) гидроксида натрия. В течение полутора часов порциями при перемешивании и комнатной температуре добавляли 17,7 ммоль (2,80 г) перманганата калия. Затем, не прекращая перемешивания, нагревали смесь на водяной бане до 80°C в течение 1 ч. По окончании реакции (через 5–6 часов) смесь охлаждали и фильтровали от оксида марганца (IV) на воронке Бюхнера и промывали 50 см3 воды. Фильтрат и промывные воды объединяли и упаривали до объёма 10 см3. Остаток после упаривания обрабатывали соляной кислотой до прекращения выделения углекислого газа, затем подщелачивали гидроксидом натрия до pH 9. Добавляли 2,5 ммоль (0,52 г) хлорида бария, отфильтровывали выпавшую в осадок бариевую соль 5-гидроксихинолиновой кислоты и промывали до нейтральной среды водой, затем суспендировали в 15 см3 воды, добавляли 0,1 см3 концентрированной серной кислоты и перемешивали в течение 30 мин. Осадок сульфата бария отфильтровывали и промывали 15 см3 горячей воды. Фильтрат и промывные воды объединяли и упаривали досуха. Продукт представлял собой мелкокристаллическое вещество белого цвета, растворимое в воде и плохо растворимое в органических растворителях. Выход: 1,1 ммоль (0,21 г; 37 % от теоретического), Т. пл. 227–228°C. Масс-спектр, m/z (Iотн, %): отрицательная ионизация 182 (100,0) [M-1]; 183 (7,8); 184 (1,3); положительная ионизация 184 (100,0) [M+1]; 185 (7,8); 186 (1,3). ИК спектр (ν, см-1): 1273; 1682; 1690; 3217; 3525.
Получение медного комплекса фталоцианина на основе 5-гидроксихинолиновой кислоты (II). Измельчённую смесь 0,4 ммоль (0,05 г) безводного хлорида меди (II), 5,7 ммоль (0,34 г) мочевины, 1,1 ммоль (0,21 г) 3-гидроксихинолиновой кислоты и 0,05 ммоль (10 мг) молибдата аммония помещали в стеклянный стакан объёмом 100 см3, накрытый часовым стеклом. Стакан ставили в чашку Петри с песком. Чашку Петри помещали в СВЧ-печь и облучали по следующей схеме: 1 мин на 300 Вт, перерыв 15 сек, 1 мин на 450 Вт, перерыв 15 сек, 1 мин на 450 Вт, перерыв 15 сек, 20 сек на 600 Вт, перерыв 15 сек, 20 сек на 600 Вт, перерыв 15 сек, 20 сек на 600 Вт. Реакционную смесь охлаждали до комнатной температуры, промывали на фильтре 10 см3 2 % раствора гидроксида натрия, затем 10 см3 воды, 10 см3 2 % раствора соляной кислоты и снова 10 см3 воды. Очищали продукт переосаждением из концентрированной серной кислоты. Продукт представлял из себя кристаллическое вещество фиолетового цвета. Выход: 0,16 ммоль (0,1 г; 58 % от теоретического). ЭСП (ДМФА), λmax, нм: 670; 720.
Литература:
- Bonnett R. Photosensitizers of the Porphyrin and Phtalocyanine Series for Photodynamic Therapy / R. Bonnett // Chem. Soc. Rev. — 1995. — Vol. 24, № 1. — P. 19–33. doi: 10.1039/CS9952400019
- Villemin D. Applications of Microwave in Organic Syntesis: An Improved One-step Syntesis of Metallophthalocyanines and a New Modified Microwave Oven for Dry Reactions / [D. Villemin, M. Hammadi, M. Hachemi et al.] // Molecules. — 2001. — Vol. 6, № 10. — P. 831–844. doi: 10.3390/61000831







