Панакситриол и его производные — биологически активные вещества, выделенные из натурального продукта — корня красного женьшеня. Было установлено, что именно они ответственны за его основные фармакологические свойства, а именно: цитотоксическое, хемопротекторное, химиопрофилактическое, антиагрегантное и противовоспалительное. В данном обзоре будет рассмотрен субстрат для столь широкого спектра действия.
Ключевые слова: женьшень, панакситриол, панакситриола ацетонид, цитостатики, хемопротекторы.
Природа доказала, что является богатым источником структурно разнообразных биологически активных соединений, из которых можно получить ценные препараты. Ученые уже долгое время пытаются идентифицировать активные компоненты различных лекарственных растений, в надежде использовать их в качестве ведущих компонентов для дальнейшей разработки лекарственных средств. На протяжении тысяч лет корень женьшеня был одним из традиционных лекарств в своих родных регионах Азии и до сих пор широко используется для лечения ряда заболеваний [9].
В настоящее время не прекращаются поиски веществ, обладающих противоопухолевой активностью. Еще в конце ХХ века были описаны результаты исследований свойств красного женьшеня в этой области [1]. В частности, было установлено, что основные химические вещества красного женьшеня, в той или иной мере ответственные за его фармакологический эффект — это гинзенозиды (растительные стероиды из класса сапонинов), полисахариды (гинсанонаны), гликопептиды (панаксаны) и летучие масла. [3] Позднее было установлено, что основное значение имеют такие вещества, как панакситриол, панаксидол и панаксинол, а среди них особый интерес представляет (3R,9R,10R)-панакситриол (Рис. 1) [2].
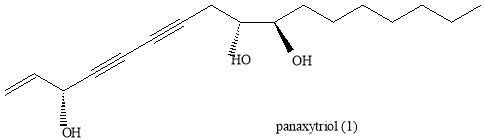
Рис. 1. Схема строения (3R,9R,10R)-панакситриола
Было выявлено, что он обладает ингибиторной активностью по отношению к желудочной карциноме человека (МК-1), лимфоме мышей (P388D1), карциноме молочной железы человека (Breast M25-SF) [3], а также клеткам меланомы [4]. Способность панакситриола подавлять активность опухоли обусловлена тем, что он индуцирует ферменты фазы 2. Так как эти ферменты способствуют протеканию реакций детоксикации, их индукция модулирует метаболизм раковых клеток, нейтрализуя электрофильные агенты, способные проявлять канцерогенные и мутагенные свойства [3]. Было высказано предположение, что для оказания подобного действия необязательно наличие гидроксильной группы при третьем атоме углерода, а особая цитотоксичность и повышение противоопухолевой активности достигается при связывании гидроксильных групп при 9 и 10 атоме углерода в ацетонид. Более того, в экспериментах in vitro было обнаружено, что полученные производные панакситриола (вещества 12, 13, 14 на рис.2) обладают большим ингибиторным эффектом, чем он сам, а ацетонид (13) превосходит по фармакологической активности сам панакситриол примерно в 6 раз. (Рис.2) [2].
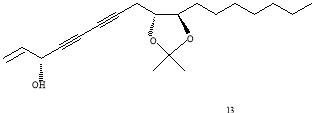
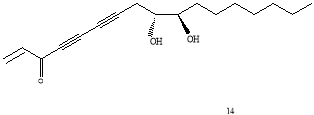
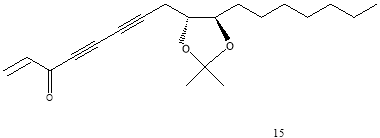
Рис. 2. Схема строения производных (3R,9R,10R)-панакситриола
С каждым из свойств этих веществ следует разобраться отдельно.
Цитотоксичность панакситриола и его производных оценивали in vitro с помощью МТТ-теста. Реактив МТТ представляет собой тиазолий синий тетразолий бромид (3 (4,5 диметилтиазол 2 ил) 2,5 дифенилтетразолиний бромид). С этой целью опухолевые клетки инкубируются в отсутствии (контроль) или в присутствии различных концентраций исследуемых цитостатических препаратов. После 72 ч культивирования клеток и соответствующих проверяемых на цитотоксичность веществ (панакситриол и его производные) в питательной среде при 37° во влажной атмосфере, в каждую лунку добавляется 3- [4,5-диметилтиазолил-2-ел]-2,5-дифенилтетразолиум бромид (МТТ). Через 4 ч экспозиции при 37° С живые клетки восстанавливают желтый МТТ до темно-фиолетовых гранул формазана. Гранулы формазана растворяются в изопропаноле или диметилсульфоксиде (ДМСО), количество восстановленного продукта измеряется фотометрически при длине волны 540 нм.
Панакситриол значительно сокращал превращение тетразольного красителя даже при очень малых концентрациях, что доказывает значительный уровень цитотоксичности панакситриола в отношении опухолевых клеток
В лабораторных условиях панакситриол и его производные(13, 14, 15) были изучены на чувствительных (линия клеток CCRF-CEM\VBL) и, наоборот, невосприимчивых (линия клеток CCRF-CEM (клетки лейкемии человека) к множественной лекарственной устойчивости (multidrug resistance = MDR) клетках. Известно, что Р-гликопротеин — белок множественной лекарственной устойчивости, он локализуется в плазматической мембране нормальных тканей (эпителиальные клетки почек, толстого кишечника, надпочечников), а также опухолевых клеток (рис.3, 4). Он состоит из 12 доменов, из них со стороны цитозоля присутствует 2 участка, связывающие цитостатики [8].
Важно, что каждый из четырех исследованных компонентов (1,13, 14, 15) сохранил свое действие против CCRF-CEM/VBL линии клеток, у которой явно выражена множественная лекарственная устойчивость. Эти результаты доказывают, что панакситриол и его производные не являются субстратами Р-гликопротеина, и, таким образом, не являются уязвимыми из-за множественной лекарственной устойчивости клеток. [2]
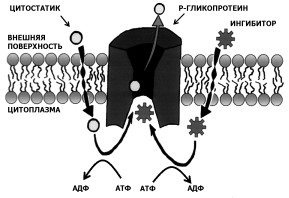
Рис. 3. Р-Гликопротеин
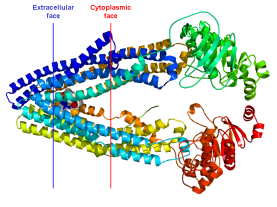
Рис. 4. Р-Гликопротеин
Наличие ацетонидной функциональной группы, по-видимому, влияет на увеличение цитотоксичности, о чем свидетельствует тот факт, что оба производные ацетонида (13 и 15) показали большую активность in vitro, чем его диольные аналоги (1 и 14). Это объясняется пространственным строением молекул в растворе: изогнутого в области С9-С10 панакситриола и относительно линейного ацетонида. По таким полученным данным можно предположить, что заметное увеличение в биологической активности ацетонида панакситриола относительно самого панакситриола может отражаться во влиянии конформации участка С9-С10. (рис. 5)
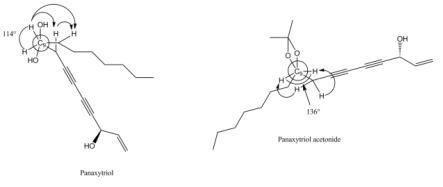
Рис. 5. Структура панакситриола и панакситриола ацетонида
Далее была проверена эффективность панакситриола и ацтонида панакситриола in vivo. Голых мышей, переносящих карциному ксенотрансплантанта молочной железы человека, лечили различными дозами с помощью медленной внутривенной инфузии панакситриола (1) и ацетонида панакситриола (13). Прекращения роста опухоли при лечении панакситриолом наблюдался при дозировке 30мг/кг, в то время как при лечении ацетонидом панакситриола — уже при 10мг/кг. Существенного уменьшения опухоли не наблюдалась даже в случае дозировки 100мг/кг.
Следует особо выделить, что эти обнаружения биологической активности стоят внимания не из-за высокой цитотоксичности, а из-за заметной супрессии опухоли наблюдаемой в естественных условиях при употреблении пищевых добавок. Следовательно, противоопухолевая активность панакситриола не сопровождается никакими побочными эффектами даже при высоких дозировках. [2]
Противораковое ипотенциальное химиопрофилактическое действие панакситриола
Клетки млекопитающих развили многочисленные механизмы для выявления и ответа на различные процессы, которые нарушают гомеостаз и ставят под угрозу жизнеспособность клеток. Такие стресс-индуцирующие стимулы могут быть биологическими, химическими (препараты, токсины) и физическими (облучение). [9] Важный путь клеточной защиты включает в себя следующие элементы: ARE (антиоксидант-респонсивный элемент), транскрипционный фактор Nfr2 Nrf2 /NFE2L2 [= nuclear factor (erythroid-derived 2)-like 2, ядерный фактор (эритроидная производная 2)-подобный 2]. (связывается с ARE), Keap1 — ингибирует Nfr2. Неразрывная связь этих молекулярных структур позволяет объединить их в единую редокс-чувствительную сигнальную систему Keapl/ /Nrf2/ARE, главным назначением которой является поддержание внутреннего гомеостаза при апоптоз-индуцирующих, канцерогенных и стрессовых воздействиях. Это хемопревентивный путь, в котором участвует панакситриол. (Рис. 6)
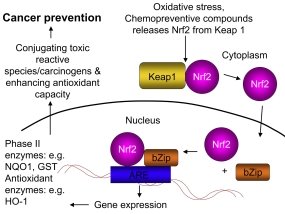
Рис. 6. Keap1/Nrf2/ARE система
Вновь синтезированный Nrf2 находится в цитоплазме и связывается с Keap1, формируя димер Nrf2-Keap1. Keap1 — это белок в цитозоле, который ингибирует Nrf2. Когда оксиданты или химиопрофилактическое (панакситриол) вещество реагирует со специальным центром в Keap1, Nfr2 высвобождается и это позволяет фактору транскрипции проникнуть внутрь ядра. (Фаза двух белков). Nfr2 связывается с ARE, вызывает транскрипцию ARE-регулируемых генов. Решающая роль Nfr2 в защите клеток при воздействии окислительного стресса и канцерогенов — усиление экспрессии и поддержание гомеостаза (оксидативного) путем продуцирования антиоксидативных ферментов. Направленный каскад реакций Nrf2 — важное достижение в изучении противораковой химиопрофилактической активности женьшеня, включая некоторые процессы оксидативного стресса и воспалительной реакции, ответственные за инициацию, стимулирование и развитие карценогенеза. [10]
Хемопротекция
Панакситриол и его производные помимо цитотоксичных агентов являются хемопротекторами. Хемопротектор — вещество, которое защищает здоровые ткани от токсического действия противораковых препаратов. Аналоги панакситриола давали больным в субтерапевтических дозах наряду с основным цитотоксичным препаратом, в результате чего наблюдался эффект увеличения суммированных лекарств, а потеря веса и тошнота, как побочные эффекты основных противораковых препаратов, резко снизились. [10]
Литература:
- Saito, T.; Matsunaga, H.; Yamamoto, H.; Nagumo, F.; Fujito, H.; Mori, M.; Katano, M. Biol. Pharm. Bull. 1994, 17, C. — 798.
- Heedong Yun, Ting-Chao Chou, Huajin Dong, Yuan Tian, Yue-ming Li, and Samuel J. Danishefsky; Total Synthesis as a Resource in Drug Discovery: The First In Vivo Evaluation of Panaxytriol and Its Derivatives, 2005.
- Fay Ng, Heedong Yun, Xiaoguang Lei, Samuel J. Danishefsky, Jed Fahey, Katherine Stephenson, Charles Flexner, Lawrence Lee; (3R,9R,10R)-Panaxytriol: a molecular-based nutraceutical with possible application to cancer prevention and treatment; Columbia University,, USA, 2008
- Katano, M.; Yamamoto, H.; Matsunaga, H.; Mori, M.; Takata, K.; Nakamura, M. Gan to Kagaku Ryoho 1990, 17, 1045.
- Heedong Yun, Straightforward Synthesis of Panaxytriol: An Active Component of Red Ginseng. The Journal of Organic Chemistry/Heedong Yun, and Samuel J. Danishefsky. -USA2003
- O. Sticher Biochemical, Pharmaceutical, and Medical Perspectives of Ginseng — Web [http://pubs.acs.org/doi/pdf/10.1021/bk-1998–0691.ch016], Phytomedicines of Europe, 2009.
- Глебко Л. И. Стандартизация качества женьшеня корней и настойки по содержанию суммы гинзенозидов. / Л. И. Глебко, Н. П. Красовская, Т. В. Покушалова, Г. Я. Ильченко, Т. А. Будина// Химико-фармацевтический журнал. — 2004. — № 4.- С. 20–23.
- Бушма, М. И. Фармакология. Часть 2: для студентов учреждений высшего медицинского образования/ М. И. Бушма, К. М. Бушма. — Минск Выш. шк. 2013. — 464 C.
- Chou TC, Multifaceted cytoprotection by synthetic polyacetylenes inspired by the ginseng-derived natural product, panaxytriol. Proceedings of the National Academy of Sciences/Dong H, Zhang X, Lei X, Hartung J, Zhang Y, Lee JH, Wilson RM, Danishefsky SJ, — USA, 2011.
- Constance Lay Lay Saw, Anti-cancer and potential chemopreventive actions of ginseng by activating Nrf2 (NFE2L2) anti-oxidative stress/anti-inflammatory pathways. Chinese Medicine / Wu Q. Tony Hong A. — China, 2010.







