Применение химических средств защиты растений является одним из важнейших агропромышленных приемов повышения урожайности сельскохозяйственных культур. Использование их, в том числе регуляторов роста растений, способствует повышению устойчивости растений к болезням и неблагоприятным условиям, раннему созреванию урожая, увеличению урожайности и получению более высокосортного продукта. К одному из перспективных классов соединений в качестве стимуляторов роста растений можно отнести α-аминонитрилы- нитрилы жизненно важных α-аминокислот. В ряду последних выявлены высокоэффективные препараты [1–3].
Вместе с этим α-аминонитрилы имеют в своей молекуле несколько реакционных центров (нитрильную, амино- и активированную метиленовую группы, а также (β-углеродные атомы), которые могут подвергаться различным химическим превращениям. Поэтому разработка методов синтеза α-аминонитрилов, изучение их реакций, выявление факторов, влияющих на ход реакций и поиск биологически активных веществ в этом ряду является актуальной задачей.
В литературе известен метод синтеза N-(α-цианизопропил)метиламина и N-(α-цианизопропил)этиламина [4].
Но в этих работах отсутствуют данные о выходах продуктов реакции. Мыисследовали реакцию ацетонциангидрина с метил и этиламинами прикомнатной температуре. Оказалось, что она идет экзотермически изаканчивается быстро. Такая экзотермическая реакция обусловлена сильнойосновностью используемых аминов и кислотностью ацетонциангидрина.
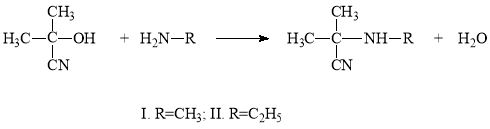
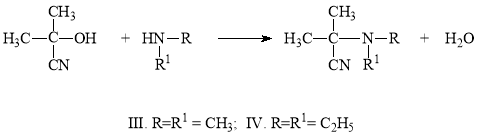
Синтез N-(α-цианизопропил)диметиламина и N-(α-цианизопропил)ди-этиламина также проведен при комнатной температуре.
Надо отметить, что при этом продукты реакции получены с высокими
выходами.
Исследование реакции ацетонциангидрина с гетероциклическими (морфолин, пиперидин) аминами представляет интерес для синтеза потенциальных биологически активных веществ. При проведении ее при комнатной температуре выходы ожидаемых α-аминонитрилов были низкими. Поэтому мы решили проводить реакцию при температуре кипения растворителя (бензола) и с отгонкой выделяющейся воды. В этом случае выходы продуктов реакции были высокие и достигали 90–92 %.
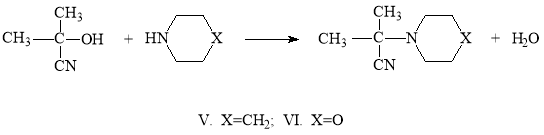
Увеличение выходов продуктов реакции при отгонке выделяющейся воды обусловлено сдвигом равновесия реакции направо в сторону образования α-аминонитрилов.
В литературе известен метод синтеза N,N-бис(α-цианизопро-пил)этилендиамина из ацетонциангидрина и этилендиамина. Это соединение получено как взаимодействием ацетона с цианистым калием и водным раствором этилендиамина, так и из ацетонциангидрина и этилендиамина.
Реакция ацетонциангидрина с этилендиамином может протекать по крайней мере в двух направлениях с образованием моно- и диаминонитриловVII и VIII.
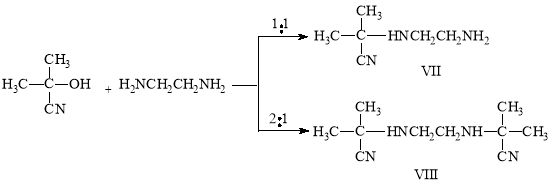
В литературе отсутствуют какие-либо сведения о моноаминонитрилах типа VII. α-Аминонитрилы, имеющие подобную свободную аминогруппу представляют большой теоретический интерес, поскольку они могут служить в качестве исходных веществ для изучения разнообразных химических превращений, из-за наличия в их молекуле NH-, NH2 и CN групп. Кроме того они интересны и с практической точки зрения.
Нам удалось синтезировать как моно-, так и бис-аминонитрилы, подбирая условия реакции.
Для получения монопродукта мы провели реакцию при охлаждении в ледяной бане. Реакцию осуществляли прибавлением ацетонциангидрина к этилендиамину по каплям, а продолжительность ее были 1–2 часа.
На ход реакции ацетонциангидрина с диаминами существенное влияние оказывает температура, природа растворителя и т. д.
Этилендиамин относятся к сильноосновным соединениям. Поэтому при соотношении этилендиамин:ацетонциангидрин 1:1 при комнатной температуре образуется исключительно бис-аминонитрил, а при температуре +5–7°С была получена смесь моно- ибис-аминонитрилов. Проведение реакции при соотношении этилендиамин:ацетонциангидрин 1:1 температуре ниже 0°С (ледяная баня) позволяет получить моно-аминонитрил с хорошими выходами.
Таблица 1
Некоторые физико-химические характеристики моно- ибис-α-аминонитрилов
|
Соединение |
Выход,% |
Т.пл. или Т.кип., °С |
Rf |
Мол.ве с |
Брутто формула |
|
I |
83 |
105–107 (10мм рт.ст.) |
0.86 |
98 |
C5H10N2 |
|
II |
86 |
110–112 (10мм рт.ст.) |
0.72 |
112 |
C6H12N2 |
|
III |
88 |
120–122 (10мм рт.ст.) |
0.67 |
127 |
C6H12N2 |
|
IV |
94 |
132–134 (10 ммрт.ст.) |
0.52 |
140 |
C8H16N2 |
|
V |
86 |
72–73 |
0.77 |
152 |
C9H16N2 |
|
VI |
85 |
81–83 |
0.68 |
138 |
C8H14N2 |
|
VII |
89 |
53–55 |
0.50 |
127 |
C6H13N3 |
|
VIII |
94 |
47–48 |
0.41 |
194 |
C10H18N4 |
Причем анализ реакционной смеси с помощью ТСХ показывает, что при этом образуется исключительно один продукт, т. е. в ней отсутствуют бис-аминонитрилыVIII.
Как видно из этих данных выходы продуктов реакции высокие, что обусловлено относительно высокой основностью используемого диамина.
Изучение ИК-спектров соединений I-VIII показывают, что в них имеются интенсивные полосы поглощения при 2218–2230 см-1, но в большинстве случаев они четко проявляются в области 2223–2226 см-1, характерные для CN-групп.
Надо отметить, что в ИК-спектрах соединений VII-VIII ярко выражены полосы поглощения в области 3460–3480 см-1, что соответствуют свободной аминогруппе, а также наблюдается интенсивные полосы поглощения в области 3318–3338 см-1, характерные для NH-групп.
В масс-спектрах синтезированных соединений наблюдаются пики молекулярного иона с небольшой интенсивностью, а наиболее часто встречаются фрагменты, соответствующим отщеплению изопропилового остатка и нитрильной группы из молекулярного иона.
Таким образом нами разработан метод получения моно- и бис-α-аминонитрилов. Эти соединения представляют собой низкоплавкие или маслообразные вещества, без запаха.
Надо отметить при комнатной температуре N,N-бис(α-цианизопро-пил)этилендиамин превращался из кристаллического состояния в маслообразного состояния. Из ходя из этого мы провели рентгеноструктурный анализ данного α-аминонитрила.
Экспериментальная часть
ИК-спектры получены на Фурье-спектрометре модели 2000 (PerkinElmer) в таблетках КВг, Масс-спектры сняты на приборе MX-1303, спектры ПМР- на приборе JNM-4H-100 VarianUnity 400(+) в CD3OD, внутренний стандарт ГМДС. Чистота продуктов и ход реакции контролировали методом ТСХ на пластинках SilufolUV-254 в разных системах растворителей.
Проявители: пары йода, УФ-свет. Температура плавления полученных соединений определили в микроскопе Боэтуса.
Получение исходных соединений.
Пиперидин, морфолин, этилендиамин и ацетонциангидрин очистили перегонкой в вакууме или при атмосферном давлении или же перекристаллизацией из соответствующего растворителя, также этилендиамин использован в виде 50 % и 70 %-ного водного раствора. В отдельных случаях безводный этилендиаминполучен перегонкой под вакуумом и после сушки над сульфатом натрия или хлоридом кальция.
Растворители очищены и абсолютированы по методике [5]. Циангидринполучен по методике [6].
Литература:
- H. C. Freeman, M. R. Snov, I. Nitta and K.Tomita, A refinement of the structure of bisglycinocopper (II) monohydrate. Acta Crystallografica-1994. T. 17. № 11.С. 1463–1470.
- Ratner S., Clarke H. T. The Action of formaldehyde upon Cysteine// J. Am. Chemical Society, 2014. — Vol. 59. Iss. 1. — P. 200–206
- Ratner S., Clarke H. T. Production of Cystiene: Approaches, Challenges and Potential. J. of Biotechnology for Wellness Industries. 2015 3(3) 95–101
- Tiemann G., Piest К. Ueber Phenylanilidoeisegsaure, his Amid und nitrile// Chem. Ber. -1988. -Jg.15.- P. 2028
- Беккер Г., Бергер В., Домшке Г. Органикум //Практикум по органической химии. Перснем. Под. ред. Попова В. М., Пономарева С. В. -М.: Мир., 1979. Т.2. С. 353–380.
- Назаров И. Н., Архем А. А. Синтез циангидринов // ЖОХ. -1955. -Т.25. С-1345–1347.







