Клапанный аппарат сердца представляет собой сложную анатомическую структуру, важной составляющей которой являются папиллярные мышцы. При развитии гипертрофической кардиомиопатии папиллярные мышцы непосредственно вовлекаются в патологический процесс. В статье описаны возможности эхокардиографии по изучению строения и функции папиллярных мышц при указанной патологии. Прослежено влияние изменений длины и занимаемого в левом желудочке объема папиллярных мышц, их сократимости на работу митрального клапана и внутрисердечную гемодинамику.
Ключевые слова: гипертрофическая кардиомиопатия, эхокардиография, папиллярные мышцы.
Атриовентрикулярное кольцо, створки, папиллярные мышцы и сухожильные хорды являются составляющими элементами сложной комплексной структуры — аппарата митрального клапана, к которому с функциональной точки зрения относятся также левое предсердие и левый желудочек (ЛЖ) [1,2]. Нормальная работа клапана зависит как от анатомической, так и от функциональной полноценности всех его элементов. При гипертрофической кардиомиопатии (ГКМП) отмечается целый ряд патологических изменений сердечно-сосудистой системы, в том числе со стороны папиллярных мышц (ПМ), приводящих к значимым гемодинамическим последствиям [3,4]. Так, по мнению Ferreira C. et al. [5] даже изолированная гипертрофия ПМ имеет непосредственное отношение к ГКМП и может рассматриваться как ее ранняя стадия или вновь выявленный подтип указанного заболевания. Патофизиологически гипертрофия ПМ и сопутствующее изменение их пространственного расположения в полости ЛЖ приводят к уменьшению его «рабочего» объема, нарушению замыкательной функции митрального клапана, обусловливают обструкцию выводного тракта ЛЖ, а также ухудшают его диастолическое наполнение [6,7]. Все перечисленные изменения крайне неблагоприятно сказываются на течении и прогнозе основного заболевания. Целью нашего исследования стало изучение возможности полноценной оценки состояния ПМ у больных ГКМП, используя доступный в клинической практике метод эхокардиографии. Поставлена задача выявить наиболее значимые эхокардиографические показатели изменений клапанного аппарата при ГКМП, которым, на наш взгляд, уделено недостаточно внимания в литературе.
Материал иметоды исследования. В исследование были включены 130 кошек-пациентов Донецкого ветеринарного диагностического центра «INVEKA», проходивших эхокардиографическое обследование в условиях амбулаторного приема и постоянно содержащихся в домашних условиях, предоставляемых им владельцами. Животные были представлены следующими породами: шотландская вислоухая (n=64), британская короткошерстная (n=50), мейн кун (n=16) и разделены на две группы с равнозначным количеством представителей различных пород в каждой. Первая группа (n=65) — кошки с диагнозом ГКМП, установленным согласно рекомендациям экспертов Всемирной организации здравоохранения и Европейского ветеринарного кардиологического общества на основании наличия асимметрической или концентрической гипертрофии миокарда ЛЖ. При этом исключались заболевания, которые также могли привести к гипертрофии и дисфункции ЛЖ, а именно артериальная гипертензия, врожденные и приобретенные пороки сердца [8–10]. Вторая группа (n=65) — контрольная, представленная здоровыми кошками. В исследовании приняли участие кошки в возрасте от 8 месяцев до 10 лет, средний возраст в основной группе составил 5,7±1,1 лет, в контрольной — 6,1±0,8 лет. Доля самцов в соответствующих группах — 59 % и 48 %.
Все кошки были обследованы методом ультразвукового сканирования на аппарате MyLab 50 (Esaote, Италия) с применением соответствующей ветеринарной кардиологической программы фазированными датчиками с частотой 5–10 МГц. Во время обследования, согласно общепринятому протоколу исследования, пациенты удерживались владельцами в положении на правом боку. Седативные препараты и анестезиологическое пособие не применялись.
Оценивались следующие эхокардиографические параметры ПМ в обеих группах: средняя длина, пространственное расположение и процент занимаемой площади в ЛЖ, сократимость.
В левой апикальной позиции, при расположении датчика в области верхушки сердца животного, по длинной оси в В-режиме поочередно лоцировались передняя и задняя ПМ. Визуализация передней ПМ достигалась получением сечения ЛЖ в четырехкамерном срезе (рис.1), задней — в двухкамерном срезе ЛЖ путем поворота датчика на 900 по часовой стрелке от исходного положения (рис.2). Длины ПМ измерялись как расстояние от верхушки мышцы до центральной части соединения между основанием мышцы и стенкой ЛЖ. Расчеты производились в конце систолы и конце диастолы одного сердечного цикла, в качестве итогового показателя принималось среднее арифметическое значение трех измерений. Определение фракции сократимости ПМ осуществлялось на основании вышеописанных измерений по следующей формуле:
(длина ПМ в конце диастолы — длина ПМ в конце систолы)/длина ПМ в конце диастолы × 100 %.
Оценка пространственного расположения и расчет процента занимаемой площади мышц в полости ЛЖ проводились при осмотре кошек в правой парастернальной позиции по короткой оси на уровне ПМ. Площади измерялись планиметрическим способом.
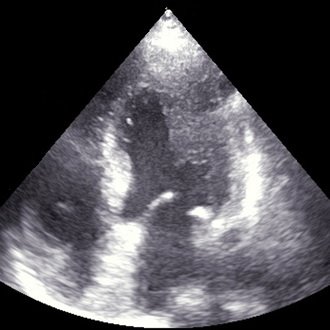
Рис. 1. Левая апикальная четырехкамерная позиция, В-режим. Визуализация передней папиллярной мышцы митрального клапана у кошки.
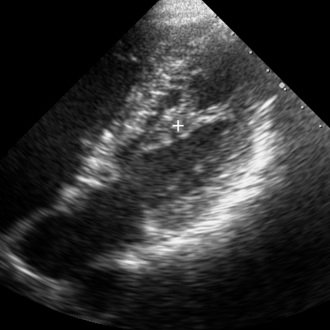
Рис. 2. Левая апикальная двухкамерная позиция, В-режим. Визуализация задней папиллярной мышцы митрального клапана у кошки
Также производилась оценка степени митральной регургитации с градацией по степеням от 0 (отсутствие признаков недостаточности митрального клапана) до 4 (выраженная степень) на основании комплексного изучения обратного тока крови на митральном клапане в правой парастернальной позиции по длинной оси сердца. Согласно стандартным методикам учитывались характеристики спектра потока регургитации при цветном и импульсно-волновом допплеровском картировании, диаметр vena contracta, кровоток в легочных венах.
Статистическая обработка полученных результатов проводилась с применением статистических пакетов «Stadia 6.0» (удостоверение ДР № 0115–97.1.0 Rus, лиц. № 1206), «MedStat» (версия 3, сэр. № MS000027) с использованием адекватных методов биостатистики. Количественные характеристики случайных величин представлены преимущественно в виде средних значений и их ошибок. Оценку связей между количественными показателями проводили с использованием коэффициента ранговой корреляции Спирмена. Критический уровень значимости для всех статистических данных принимали равным 0,05.
Результаты. Изолированная гипертрофия ПМ ЛЖ была выявлена у 8 кошек (12,3 %) и классифицирована нами согласно рекомендациям Европейского ветеринарного кардиологического общества как подтип ГКМП [5]. Увеличение размеров ПМ в сочетании с другими анатомическими признаками ГКМП было обнаружено в 72,4 % случаев.
В проведенном исследовании средний размер задней ПМ в контрольной группе составил 4,5±0,42 мм, передней — 4,9±0,56 мм. У животных основной группы указанные показатели достоверно превышали норму вне зависимости от анатомического варианта заболевания и были равны соответственно 6,1±0,54 мм и 6,6±0,71 мм, р ≤ 0,05. Подчеркнем, что более выраженная гипертрофия была отмечена со стороны передней ПМ.
Согласно данным литературы [11,12], а также полученным нами результатам, в норме при представлении среза ЛЖ по короткой оси на уровне ПМ в виде циферблата передняя и задняя мышцы располагаются в положении 4 и 7 или 3 и 8 часов (рис.3). При гипертрофии верхний край ПМ достигал положения 2 и/или 9 часов соответственно (рис.4), что и субъективно воспринималось исследователем как смещение мышц от их нормального положения.
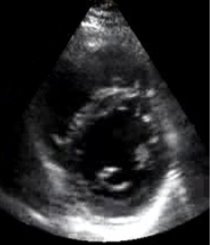
Рис.3. Правая парастернальная позиция по короткой оси на уровне папиллярных мышц левого желудочка. Расположение папиллярных мышц в норме
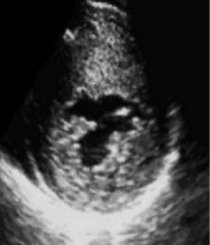
Рис. 4. Правая парастернальная позиция по короткой оси на уровне папиллярных мышц левого желудочка. Положение папиллярных мышц у больных гипертрофической кардиомиопатией
По результатам исследования в группе здоровых животных ПМ в диастолу составляли 6,4±1,8 % объема ЛЖ, а в систолу — 22,8±5,6 %. При этом достоверных отличий диастолического показателя у животных с ГКМП зафиксировано не было, отмечена тенденция к увеличению указанного показателя — 7,1±2,0 %, р ≥ 0,05. В то же время процентное соотношение объема ПМ к объему ЛЖ в систолу у кошек с ГКМП достоверно превышало нормальные показатели и составляло 30,1±4,4 %, р ≤ 0,05.
При оценке сократимости ПМ у кошек в норме и при ГКМП получены следующие данные. У здоровых животных сократимость передней ПМ была 25±6 %, задней — 28±7 %, в то время как в основной группе указанные показатели достоверно отличались и составили 37±8 % и 41±8 %, соответственно, р ≤ 0,05.
В ходе исследования было установлено, что структурно-функциональные изменения ПМ ЛЖ сочетаются с недостаточностью митрального клапана. Между величиной vena contracta потока митральной регургитации и сократимостью передней и задней папиллярных мышц была зафиксирована тесная прямая корреляционная связь (r=+0,97 и r=+0,94, соответственно), корреляция с длиной мышц была не столь интенсивной (r=+0,65 и r=+0,74, соответственно).
Выводы. Впроцесс увеличения толщины мышечных волокон при ГКМП вовлекаются ПМ ЛЖ. Даже их изолированная гипертрофия является признаком заболевания и способствует развитию и закреплению патофизиологических изменений в сердце. С одной стороны, гипертрофия мышц направлена на компенсацию постнагрузки, но с другой стороны, происходит достоверное уменьшение «рабочего» объема ЛЖ за счет изменения объема, занимаемого увеличенными ПМ. Это в свою очередь усугубляет процесс обструкции выводного тракта ЛЖ и приводит к дополнительному снижению сердечного выброса и минутного объема кровотока.
Существует достаточное количество объективных расчетных методов оценки анатомии и функции ПМ, которые могут быть использованы в рутинной эхокардиографической практике. В результате проведенного исследования было установлено достоверное увеличение размеров и повышение сократительной способности ПМ у животных с ГКМП. Прослежено патологическое влияние изменений со стороны ПМ на замыкательную функцию митрального клапана. Выявленное смещение мышц, преимущественно в сторону выводного тракта ЛЖ, что вносит свой вклад в развитие обструктивных форм заболевания.
Таким образом, использование метода эхокардиографии позволяет полноценно и адекватно оценить структурно-функциональные изменения ПМ и связанные с ними патофизиологические процессы в сердце больных ГКМП.
Литература:
- Jensen M. O., Hagege A. A., Otsuji Y., Levine R. A. The unsaddled annulus: biomechanical culprit in mitral valve prolapse? Circ. 2013; 127: 766–768.
- Lang R. M., Badano L. P., Tsang W. et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur heart J cardiovasc Imag. 2012; 13: 1–46.
- Minami Y., Kajimoto K., Terajima Y. et al. Clinical implications of midventricular obstruction in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2011; 57(23): 2346–2355.
- Peteiro J., Bouzas-Mosquera A., Fernandez X. et al. Prognostic value of exercise echocardiography in patients with hypertrophic cardiomyopathy. J Am Soc Echocardiogr. 2012; 25(2): 182–189.
- Ferreira C., Delgado C., Vazquez M. et al. Isolated papillary muscle hypertrophy: A gap in our knowledge of hypertrophic cardiomyopathy? Rev Port Cardiol. 2014; 33: 379.
- Hagege A. A., Bruneval P., Levine R. A. et al. The mitral valve in hypertrophic cardiomyopathy: old versus new concepts. J of cardiovasc translat res. 2011; 4: 757–766.
- Hwang H. J., Choi E. Y., Kwan J. et al. Dynamic change of mitral apparatus as potential cause of left ventricular outflow tract obstruction in hypertrophic cardiomyopathy. Eur J of echocardiogr: the j of the Work Gr on Echocardiogr of the Eur Soc of Cardiol. 2011; 12: 19–25.
- Barsheshet A., Brenyo A., Moss А., Goldenberg I. Genetics of Sudden Cardiac Death. Current Cardiology Reports. 2011; 364–376.
- Rapezzi C., Arbustini E., Caforio A. P. Diagnostic work-up in cardiomyopathies: bridging the gap between clinical phenotypes and final diagnosis. A position statement from the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013; 34: 1448–1458.
- Marz I., Wilkie L., Harrington N. et al. Familial cardiomyopathy in Norwegian Forest cats. J of Fel Med and Surg. 2015; 17: 681–691.
- Correia A. S., Pinho T., Madureira A. J. et al. Isolated papillary muscle hypertrophy: a variant of hypertrophic cardiomyopathy? Do not miss a hypertrophic cardiomyopathy. Eur Heart J Cardiovas Imaging. 2013; 14: 296–310.
- Patil N. P., Katti K. Unusual papillary muscle hypertrophy in a septuagenarian. J Oscul Surg. 2011; 142: 704–705.







