В данной работе проводится исследование содержания пигментов в некоторых растениях. Приводится сравнение эффективности методов экстракции, делается вывод о наличии отдельных классов соединений в растениях.
Ключевые слова: пигменты растений, экстракция.
Содержащиеся в растительных организмах биологические пигменты широко применяются человеком в пищевой промышленности и медицине. В связи с этим возникает необходимость выявления оптимального метода выделения пигментирующих соединений из природного сырья, что и стало конечной целью обсуждаемой работы.
Качественно о содержании тех или иных пигментов в растениях можно судить по цвету, в который окрашены части растения [1]. Так, например, каротиноиды, являющиеся производными ликопина, придают частям растения желтую, оранжевую окраску. Флавоноиды — растительные полифенолы — имеют широкий спектр цветов, от желтого до синего. Тетрапирролы, в частности хлорофиллы, окрашивают побеги в зеленый цвет. Представители класса хинонов, сопряженных циклогексадиенонов, редко встречаются в растительных организмах, они придают им желтую окраску и пр.
Материалы иметоды
В ходе работы было собрано и высушено на воздухе 35 образцов высших растений. Далее из каждого образца были получены экстракты различными способами [2], [3]: выдерживание навески образца в 1 % р-ре NaOH, в 1 % р-ре HCl, в 20 % р-ре этанола; проведена экстракция горячей водой, экстракция гексаном и этилацетатом в аппарате Сокслета. Полученные экстракты были отфильтрованы, после чего были сняты, проанализированы качественно и полуколичественно видимые спектры поглощения экстрактов в области 440–600 нм (видимая область).
Обсуждение результатов
В ходе анализа полученных экстрактов максимумы и минимумы поглощения спектра (D=f(Л)) каждого экстракта были соотнесены с соответствующими пиками поглощения спектров конкретных пигментирующих соединений. Был сделан вывод о наличии или отсутствии определенных пигментирующих соединений в каждом из экстрактов.
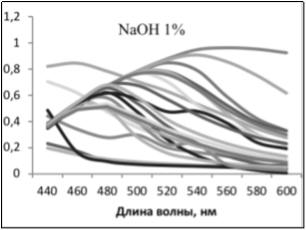
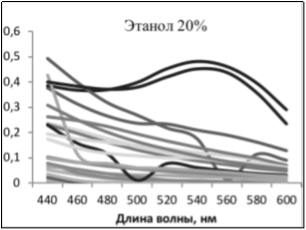
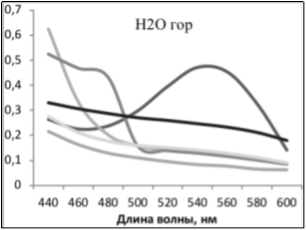
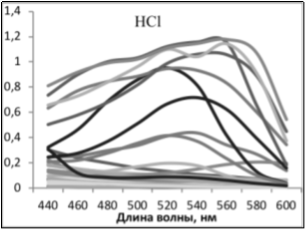
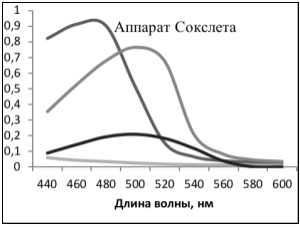
В случае получения экстрактов с одинаковыми спектрами поглощения, но с разной интенсивностью отдельных сигналов, были сделаны выводы об относительном содержании веществ в экстракте и, соответственно, эффективности метода выделения.
В ходе работы было выявлено, что наиболее полно экстрагируются каротиноиды — NaOH 1 %, антоцианы — HCl %, ауроны- NaOH 1 % и EtOH 20 %, халконы — EtOH 20 %, флавонолы- NaOH 1 %, HCl 1 %, EtOH 20 %, H2O гор, хлорофиллы- NaOH 1 %, хиноны- HCl 1 % и NaOH 1 %
Также сделан вывод о том, что р-р HCl и горячая вода экстрагируют из образцов одни и те же пигментирующие соединения, но HCl экстрагирует лучше количественно (экстракты имели одинаковые спектры поглощения, но оптическая плотность экстрактов HCl была больше).
Хуже всего в аппарате Сокслета гексаном и этилацетатом экстрагировались антоцианы, наиболее полно — каротиноиды. При таком способе экстракции пигменты частично осаждались.
Полученные спектры сопоставлены с литературными данными, найденные классы соединений внесены в таблицу.
Таблица 1
|
Спо-соб экстр |
NaOH 1% |
HCl 1% |
EtOH 20% |
H2O горячая |
C6H14 иEtOAc вап.Сокслета. |
|
Абрикос |
Ликопин, α-каротин, лютеин, неоксантин |
Ликопин, кемпферол, кверцетин |
Ничего не экстр. |
- |
- |
|
Апель-син |
α-каротин, лютеин, зеаксантин |
Лютеин,ауроны |
ауроны,кемпферол |
- |
- |
|
Бархат-цы |
Кантаксан-тин,лютеин, α-каротин |
Хлорофилл-а,кемпферол, халконы |
Кемпферол, изофлавон |
Мирицетин |
- |
|
Бугенвилия |
Пеларгонидин,кверцетин,ауроны, ликопин |
Дельфинидин,кверцетин,хлорофиллы a и b |
Дельфинидин |
Дельфини-дин |
- |
|
Василек |
Цианидин |
Цианидин,дельфи-нидин |
Цианидин,Петунидин |
- |
Ничего не экстр. |
|
Венерин Башмачок |
Пеларго-нидин |
Мальвидин, ауроны |
Кверцетин |
- |
- |
|
Вино-град |
Халконы, ауроны, кемпферол |
Ауроны, ликопин, лютеин |
Лютеин, кемпферол |
- |
- |
|
Водо-сбор |
пеонидин, петунидин |
Мальвидин |
Пеонидин, мальвидин |
- |
- |
|
Доро-никум |
Эриодиктиол,мирицетин,Лютеин |
Лютеин, кемпферол |
Мирицетин |
- |
- |
|
Душис. Горошек |
Мальвидин, хлорофилл А |
Мальвидин |
Мальвидин, хлорофилл А |
- |
- |
|
Иван-чай |
Цианидин, лютеин, хлорофилл а |
Дельфинидин,мальвидин |
Цианидин, халконы, кверцетин |
- |
- |
|
Кален-дула |
Ликопин, неоксантин |
Кверцетин, лютеолин |
Кверцетин |
Лютеолин, аурон, халконы |
α,β-каротин, ликопин, зеаксантин, капсантин, кверцетин |
|
Космея |
Цианидин, дельфинидин, мальвидин, ауроны |
Цианидин, дельфинидин, |
Мальвидин, дельфинидин |
- |
- |
|
Куку-руза |
Лютеин,неоксантин |
Лютеин, хлорофилл б, гесперидин |
Зеаксантин, хлорофилл б |
- |
- |
|
Лимон |
α-каротин, лютеин, кверцетин |
Хиноны, эриодиктиол |
α-каротин, халконы,ликопин |
- |
- |
|
Мальва |
Ликопин, мальвидин |
Мальвидин, цианидин |
Халконы,ауроны |
Эриодиктиол,катехины |
- |
|
Одуван-чик |
Лютеин, ликопин, зеаксантин |
Виолаксантин,неоксантин |
Лютеин,мирицетин,халконы |
Халконы, кверцетин, кемпферол |
Лютеин, зеаксантин |
|
Олеандр |
Мальвидин,дельфинидин,лютеин |
Мальвидин,Цианидин |
Антоцианы не экстр,халконы, ауроны |
- |
- |
|
Орхидея |
Неоксантин, мирицетин,ауроны |
Цианидин,пеонидин,ауроны |
Кемпферол,цианидин |
- |
- |
|
Перец красный |
Капсантин, капсорубин, α — каротин, лютеин |
Ауроны, халконы |
Лютеин,аурон, цианидин |
- |
Капсантин, лютеин |
|
Пион |
Пеонидин,дельфинидин, цианидин |
Дельфинидин, пеонидин |
Цианидин |
- |
- |
|
Подсол-нух |
Ликопин,лютеин, α-каротин |
Кверцетин,ауроны,халконы |
Кемпферол, эриодиктиол |
- |
- |
|
Ромаш-ка |
Лютеин, хлорофилл б |
Халконы, кврецетин |
Кверцетин |
α-каротин, виолоксан-тин, хлоро-филл Б |
- |
|
Рудбе-кия |
Ликопин,α-каротин, β-каротин |
Кверцетин, ауроны |
Мирицетин, хлорофилл а |
- |
- |
|
Свекла |
Мальвидин, дельфинидин |
Цианидин, дельфинидин, пеоиндин |
Дельфинидин, ликопин, кверцетин, хлорофилл а |
Дельфинидин,цианидин, ликопин, хлорофилл а |
- |
|
Сирень |
Цианидин, мальвидин |
Антоцианы не экстр, кверцетин, эриодиктиол |
Антоцианы не экстр,кверцетин, эриодиктиол |
- |
- |
|
Спирея |
Гесперидин, хлорофиллы А,Б |
Мирицетин, кверцетин |
Кверцитин, ауроны |
- |
- |
|
Хризантема |
Лютеин, ликопин, зеаксантин, кверцетин |
Лютеин, эриодиктиол, кверцетин, хлорофилл Б, флавон |
Лютеин, эриодиктиол, кверцетин, хлорофил Б, флавон |
- |
Халконы,кемпферол,кверцетин,мирицетин |
|
Шиповник красный |
Цианидин, дельфинидин, пеонидин |
Цианидин, дельфинидин, петунидин |
Халконы |
- |
- |
|
Шиповник белый |
Цианидин, пеонидин |
Халконы, мирицетин |
халконы, мирицетин |
- |
- |
|
Шпи-нат |
Хлорофилл a,b, α-каротин, лютеин, |
Хлор-ллы,каротины, хиноны, кемпферол |
Лютеин, хлорофиллы, каротин |
- |
- |
Выводы
Выявлено, что оптимальный метод экстракции — выдерживание навески образца в течение недели в 1 % р-ре NaOH. Р-ром NaOH экстрагировались все рассматриваемые пигменты, наиболее полно количественно по сравнению с другими растворителями. Вероятно, так происходит из-за того, что щелочь лучше растворяет мембраны клеток растений, а также из-за перевода молекул красителей в солеобразное состояние.
Благодарности
Авторы хотели бы выразить благодарность за помощь в проведении работ Золенко Михаилу, а также Химическому Центру при ПФМЛ № 239 за предоставление лаборатории.
Литература:
- K.Davies, Plant Pigments and their Manipulation. — New Zealand: Blackwell Publishing Ltd, 2004. — 369 с.
- О. А. Харламова, Б. В. Кафка. Натуральные пищевые красители. — М.: Пищевая промышленность, 1979. — 191 с.
- G.Britton. The Biochemistry of Natural Pigments. — England: Cambridge University Press, 1986. — 422 с.







