Язвенная болезнь (ЯБ) желудка и двенадцатиперстной кишки (ДПК) остаётся широко распространенным заболеванием, охватывающим до 10-15% трудоспособного населения. Нарушения моторно-эвакуаторной функции (МЭФ) желудка и ДПК возникают у 10,0-56,3% больных ЯБ [1,3,5,6,9] и до 65% случаев после её оперативного лечения [3,8,12], что делает проблему своевременной диагностики и профилактики послеоперационных нарушений МЭФ желудка не менее актуальной.
Наиболее информативным современным методом изучения функционального состояния желудка и кишечника является периферическая электрогастроэнтерография (ПЭГЭГ) [2,4,7,10,11].
В отличие от электрогастрографии, ПЭГЭГ описывает электрофизиологические изменения всех отделов ЖКТ с наличием большого количества взаимосвязанных показателей, что обусловливает необходимость использования системного подхода к интерпретации данных ПЭГЭГ на основе современного многомерного статистического анализа (МмСА).
Целью нашего исследования было улучшение качества оказания хирургической помощи больным с осложнённой ЯБ путем совершенствования электрофизиологической диагностики моторно-эвакуаторных нарушений.
Материалы и методы
-
Нами обследовано 218 пациентов с осложнённой ЯБ желудка
и ДПК. Критериями включения пациентов в исследование было наличие
подтвержденных эндоскопическим и рентгенологическим методами
язвенного кровотечения и пилородуоденального стеноза (ПДС). В
исследование так же были включены пациенты, оперированные по поводу
перфорации язвы ДПК и язвенного ПДС. Степень компенсации ПДС
определяли по Ю.М. Панцыреву и А.А. Гринбергу [6].
- В соответствии с целью исследования все больные были нами разделены на 3 основные группы. Первую группу составили 65 человек с ЯБ желудка и ДПК, осложненной кровотечением; вторую группу – 57 больных с ЯБ, осложнённой ПДС и третью группу - 96 больных с осложненной ЯБ, которым были выполнены органосохраняющие операции. Контрольную группу составили 28 практически здоровых людей (таблица 1).
- Для электрофизиологической оценки состояния МЭФ желудка и кишечника использовали ПЭГЭГ, которую выполняли аппаратом ”Гастроскан-ГЭМ” по стандартной методике [10].
- В соответствии с целью исследования все больные были нами разделены на 3 основные группы. Первую группу составили 65 человек с ЯБ желудка и ДПК, осложненной кровотечением; вторую группу – 57 больных с ЯБ, осложнённой ПДС и третью группу - 96 больных с осложненной ЯБ, которым были выполнены органосохраняющие операции. Контрольную группу составили 28 практически здоровых людей (таблица 1).
Таблица 1
Распределение больных по возрасту и полу
|
Группа больных |
n |
Средний возраст (M±m) |
Пол |
|||
|
М |
Ж |
|||||
|
n |
% |
n |
% |
|||
|
Контрольная группа |
28 |
40,7±4,1 |
12 |
42,8 |
16 |
57,2 |
|
1 |
65 |
48,0±2,6 |
39 |
60 |
26 |
40 |
|
2 |
57 |
55,3±2,1 |
39 |
68,4 |
18 |
31,6 |
|
3 |
96 |
53,1±1,8 |
67 |
69,8 |
29 |
30,2 |
|
Всего |
246 |
50,0±1,38 |
157 |
63,8 |
89 |
36,2 |
При анализе ПЭГЭГ мы оценивали:
суммарный уровень электрической активности (Ps) органов ЖКТ;
электрическую активность (ЭА) по отделам ЖКТ (Pi);
процентный вклад каждого частотного спектра в суммарный спектр (Pi/Ps) (%);
коэффициент ритмичности (Критм), который характеризует наличие и характер пропульсивных сокращений гладкомышечных структур для каждого отдела ЖКТ;
коэффициент соотношения Pi/P(i+1) - отношение ЭА вышележащего отдела к нижележащему.
Для оценки степени компенсации ПДС, нами были дополнительно предложены относительные показатели:
«показатель компенсации ЭА желудка», который представляет собой отношение значений стимулированного Pi желудка к его базальному значению и характеризует ЭА желудка;
«показатель компенсации перистальтической активности желудка», который представляет собой отношение значений стимулированного Критм желудка к его базальному значению и характеризует перистальтическую активность желудка.
Многомерный статистический анализ (МмСА) показателей ПЭГЭГ включал в себя сравнение средних значений показателей ПЭГЭГ в независимых группах с расчетом непараметрического критерия Манна-Уитни, кластерный анализ в виде иерархической кластеризации, дискриминантный анализ и метод логистической регрессии.
Анализ полученных данных выполнялся в статистическом пакете Statsoft Statistica 8.0.
Результаты исследования
Сравнение средних значений показателей ПЭГЭГ больных первой группы с контрольными значениями выявило достоверное (p<0,05) снижение у больных с язвенным дуоденальным кровотечением ЭА желудка с одновременным повышением ЭА толстой кишки. Нами так же было отмечено возрастание значений базального и стимулированного Pi/P(i+1) ДПК/тощая кишка, что свидетельствовало о дискоординации моторики данного сегмента кишечника.
У больных с желудочной локализацией язвы сравнение показателей ПЭГЭГ с контрольными значениями выявило достоверные различие по 14 показателям, преимущественно за счет изменения показателей ЭА и коэффициента соотношения отделов ЖКТ.
Для проведения дискриминантного анализа группирующим признаком была определена локализация язвы.
Статистически значимыми признаками оказались:
базальные значения Ps, Pi/Ps желудка, подвздошной и толстой кишки; Pi/P(i+1) тощая/подвздошная кишка и Pi/P(i+1) подвздошная/толстая кишка; Критм толстой кишки;
стимулированные значения Pi/Ps тощей кишки; Pi/P(i+1) тощая/ подвздошная кишка, Критм желудка.
Если при сравнении средних значений показателей ПЭГЭГ наибольшее количество достоверных различий в сравнении с контрольной группой было выявлено у больных с желудочной локализацией язвы, то по данным дискриминантного анализа эти пациенты, наоборот, классифицировались как здоровые в 23% случаев, а больные с дуоденальной локализацией язвы – только в 5,1% случаев (таблица 2).
Таблица 2
Прогностическая точность изменений моторики ЖКТ в зависимости от локализации источника язвенного кровотечения по результатам дискриминантного анализа
|
Матрица переклассификации |
|||||
|
Наблюдаемое распределение |
Предсказанное распределение |
||||
|
Группы пациентов |
Группы пациентов |
% правильной классификации |
|||
|
ЯБ ДПК |
ЯБ желудка |
Контрольная группа |
|||
|
ЯБ ДПК |
n=39 |
37 |
0 |
2 |
94,8 |
|
ЯБ желудка |
n=26 |
2 |
18 |
6 |
69,2 |
|
Контрольная группа |
n=28 |
0 |
0 |
28 |
100,0 |
|
Всего |
n=93 |
39 |
18 |
36 |
88,8 |
Выявление дискриминантным методом более выраженные нарушения МЭФ желудка у больных с ЯБ ДПК, осложнённой кровотечением, по-нашему мнению, объясняются его способностью оценивать не только изменения отдельных показателей ПЭГЭГ, но и их корреляционные взаимосвязи с другими показателями.
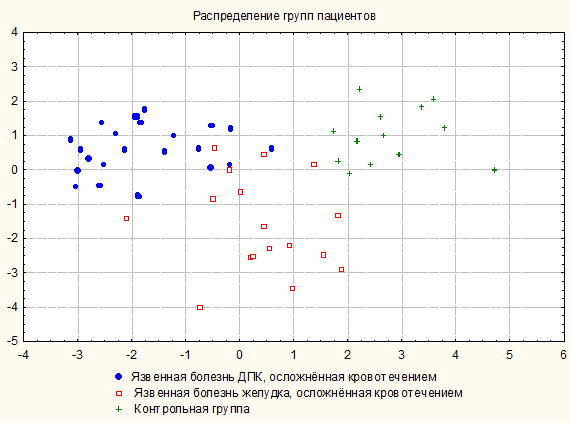
Рисунок 1. Распределение групп пациентов с ЯБ, осложненной кровотечением, по показателям ПЭГЭГ в зависимости от локализации язвы на основании дискриминантного анализа.
Таким образом, созданная на основе дискриминантного анализа электрофизиологическая модель нарушений МЭФ желудка и ДПК у больных с ЯБ, осложнённой кровотечением, в зависимости от локализации язвы показала, что данные группы достоверно отличаются по 10 показателям ПЭГЭГ со средней точностью модели для прогнозирования распределения пациентов в ту или иную группу 88,8% (рисунок 1).
Анализ средних значений показателей ПЭГЭГ у больных 2-й группы показал характерные [10] изменения в виде умеренного (p>0,05) возрастания ЭА и перистальтической активности желудка у больных с компенсированным ПДС, статистически значимого (p<0,05) возрастания базальной и стимулированной ЭА и перистальтической активности желудка у больных с субкомпенсированным ПДС, а так же достоверного (p<0,05) снижения стимулированной ЭА и перистальтической активности у больных с декомпенсированным ПДС.
Традиционно все пациенты с ПДС разделяются по степени его компенсации на компенсированный, суб- и декомпенсированный стенозы [6].
Однако результаты до- и послеоперационного обследования пациентов с субкомпенсированным ПДС, свидетельствуют об их неоднородности по характеру изменений МЭФ желудка, что, по-нашему мнению, связано с наличием в этой наиболее многочисленной группе пациентов переходных типов нарушения моторики от компенсации к её декомпенсации, которые не обнаруживаются стандартным методом сравнения средних показателей ПЭГЭГ.
Для выявления этих переходных типов компенсации моторики желудка мы использовали кластерный анализ, в который были включены 40 показателей ПЭГЭГ 24 пациентов с субкомпенсированным ПДС.
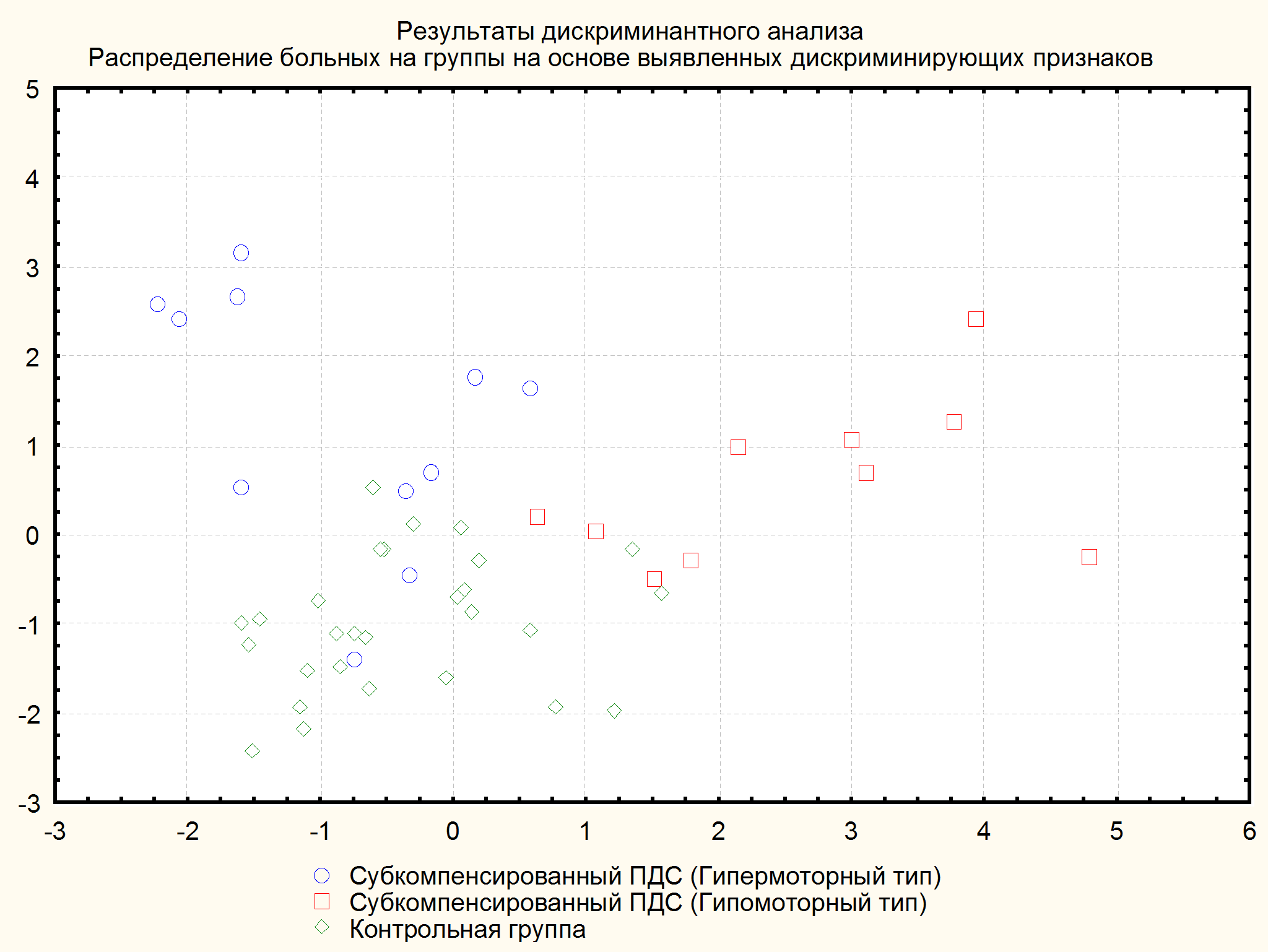
В результате кластеризации были выявлены 2 группы больных (рисунок 2). В первую группу вошли 10 (41,6%) пациентов, которых мы соответственно выявленному характеру изменений электрофизиологических показателей условно обозначили как группу больных с гипомоторным типом ПДС, и во вторую группу - 14 (58,3%) пациентов, которых мы также условно обозначили как группу больных с гипермоторным типом ПДС.
Анализ средних показателей ПЭГЭГ у больных с гипермоторным типом субкомпенсированного ПДС показал наличие у них крайней степени компенсации моторной функции желудка, что проявлялось умеренным (p>0,05) повышением базальной ЭА и перистальтической активности желудка и кишечника со значительным их возрастанием после пищевой стимуляции (p<0,05).
Показатели ПЭГЭГ у больных с гипомоторным типом субкомпенсированного ПДС отражали уже начальные проявления декомпенсации моторики желудка, что проявлялось повышением базального тонуса желудка и его перистальтический активности (p<0,05) со снижением этих показателей после пищевой стимуляции, обусловленное развитием недостаточности нервно-мышечного аппарата желудка и усугублением его двигательных расстройств.
На основе дискриминантного анализа нами была создана электрофизиологическая модель моторно-эвакуаторных нарушений у больных с язвенным ПДС, включающая выявленные переходные типы нарушения моторики желудка, а так же возрастные особенности значений ПЭГЭГ.
В электрофизиологическую модель вошло 23 показателя ПЭГЭГ, из которых статистически значимыми оказались 17 (таблица 3).
Таблица 3
Показатели модели определения степени тяжести ПДС по данным ПЭГЭГ
|
Показатели модели |
Показатели дискриминантного анализа |
||||||
|
Лямбда Уилкса |
Частичная лямбда |
F статистика |
p |
Tolerance |
1-Toler. (R-Sqr.) |
||
|
Ps (мВ) |
Базал. |
0,0099 |
0,5628 |
5,0494 |
p<0,01 |
0,0001 |
0,9999 |
|
Стим. |
0,0107 |
0,5211 |
5,9729 |
p<0,01 |
0,0074 |
0,9925 |
|
|
Pi (мВ) |
желудок базал. |
0,0091 |
0,6115 |
4,1279 |
p<0,01 |
0,0006 |
0,9993 |
|
подвзд. кишка базал. |
0,0113 |
0,4932 |
6,6770 |
p<0,01 |
0,0007 |
0,9992 |
|
|
Подвзд. кишка стим. |
0,0112 |
0,5001 |
6,4959 |
p<0,01 |
0,0055 |
0,9944 |
|
|
тостая кишка базал. |
0,0104 |
0,5388 |
5,5637 |
p<0,01 |
0,0004 |
0,9995 |
|
|
Pi/Ps (%) |
желудок базал. |
0,0096 |
0,5846 |
4,6181 |
p<0,01 |
0,0212 |
0,9787 |
|
желудок стим |
0,0077 |
0,7250 |
2,4646 |
p>0,05 |
0,0984 |
0,9015 |
|
|
ДПК стим. |
0,0078 |
0,7156 |
2,5828 |
p>0,05 |
0,0439 |
0,9560 |
|
|
тощая кишка стим. |
0,0078 |
0,7144 |
2,5980 |
p>0,05 |
0,0182 |
0,9817 |
|
|
подвзд. кишка базал. |
0,0083 |
0,6746 |
3,1344 |
p<0,05 |
0,0863 |
0,9136 |
|
|
подвзд. кишка стим. |
0,0089 |
0,6257 |
3,8881 |
p<0,05 |
0,0346 |
0,9653 |
|
|
толстая базал. кишка |
0,0103 |
0,5414 |
5,5043 |
p<0,01 |
0,0122 |
0,9877 |
|
|
Pi/P(i+1) |
ДПК/тощая кишка базал. |
0,0095 |
0,5871 |
4,5709 |
p<0,01 |
0,0808 |
0,9191 |
|
ДПК/тощая кишка стим. |
0,0071 |
0,7811 |
1,8208 |
p>0,05 |
0,1112 |
0,8887 |
|
|
тощая/подвзд. стим. |
0,0081 |
0,6869 |
2,9619 |
p<0,05 |
0,0452 |
0,9547 |
|
|
подвзд./толстая базал. |
0,0095 |
0,5885 |
4,5434 |
p<0,01 |
0,0259 |
0,9740 |
|
|
Kритм. |
желудка базал |
0,0071 |
0,7885 |
1,7429 |
p>0,05 |
0,0065 |
0,9934 |
|
желудка стим. |
0,0104 |
0,5384 |
5,5727 |
p<0,01 |
0,0073 |
0,9926 |
|
|
ДПК базал. |
0,0107 |
0,5239 |
5,9049 |
p<0,01 |
0,0162 |
0,9837 |
|
|
тощая базал. |
0,0069 |
0,8112 |
1,5119 |
p>0,05 |
0,0087 |
0,9912 |
|
|
подвзд. кишка стим. |
0,0102 |
0,5470 |
5,3815 |
p<0,01 |
0,0061 |
0,9938 |
|
|
толстая базал. |
0,0129 |
0,4322 |
8,5370 |
p<0,01 |
0,0044 |
0,9955 |
|
Примечание: 17 Шагов, переменных в модели 23, число групп – 5. Лямбда Уилкса: 0,03502 approx. F (60,193)=4,3861; p< 0,0000
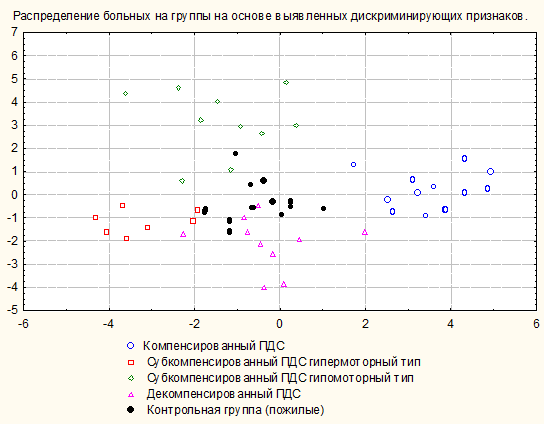
Общий процент правильной классификации наблюдений в соответствующие группы составил 96,2% (таблица 4, рисунок 3).
Таблица 4
Точность диагностики степени ПДС на основе показателей ПЭГЭГ, полученных в результате дискриминантного анализа.
|
Матрица переклассификации |
||||||||
|
Наблюдаемое распределение |
Предсказанное распределение |
|||||||
|
Группы пациентов |
||||||||
|
Группы пациентов |
Контроль- ная группа |
ПДС |
% правильной классифика-ции |
|||||
|
Компенсированный |
Субкомпенсированный |
Декомпенсирован-ный |
||||||
|
гипермоторный тип |
гипомоторный тип |
|||||||
|
ПДС |
Компенсирован ный |
0 |
25 |
0 |
0 |
0 |
100 |
|
|
Суб компенсированный |
Гипермо-торный тип |
0 |
0 |
14 |
0 |
0 |
100 |
|
|
Гипомо-торный тип |
0 |
0 |
0 |
10 |
0 |
100 |
||
|
Декомпенсирован-ный |
1 |
0 |
0 |
0 |
7 |
90 |
||
|
Контрольная группа |
0 |
0 |
1 |
0 |
9 |
90 |
||
|
Всего |
1 |
25 |
15 |
10 |
16 |
96,2 |
||
Рисунок 3. Распределение больных ЯБ, осложненной ПДС, по показателям ПЭГЭГ на основании дискриминантного анализа с учётом возрастных значений ПЭГЭГ.
Для подтверждения соответствия выявленных нами моторно-эвакуаторных нарушений ЖКТ степеням компенсации ПДС был применён метод многофакторной логистической регрессии. Для построения логистических уравнений использовались 40 предикторов (базальные и стимулированные показатели ПЭГЭГ) в разных сочетаниях с их пошаговым исключением из модели.
В созданную модель вошло 27 показателей ПЭГЭГ. Её общая прогностическая точность составила 88,8%.
Таким образом, результаты метода многофакторной логистической регрессии полностью подтвердили данные дискриминантного анализ о соответствии выявленных моторно-эвакуаторных нарушений ЖКТ уточнённым нами степеням компенсации ПДС.
Системный анализ показателей ПЭГЭГ у больных 3-й группы показал, что после ушивания ПЯ ДПК средние значения показателей ПЭГЭГ соответствовали субкомпенсированному ПДС с нарушением пропульсивной перистальтики и начальными признаками декомпенсации моторики желудка. Это проявлялось статистически значимым возрастанием базальной ЭА и перистальтической активности желудка с их снижением после пищевой стимуляции и задержкой появления признаков начала эвакуации пищи из желудка в ДПК до 20±5 минуты исследования.
У больных после радикальной дуоденопластики (РДП), которая устраняла саму язву, сочетанные язвенные осложнения и перидуоденальные рубцовые сращения, лежащие в основе нарушения МЭФ желудка, были отмечены возрастание стимулированных показателей Pi желудка и ДПК, коэффициента соотношения Pi/P(i+1) желудок/ДПК, восстановление физиологического трёхфазного характера стимулированной электрофизиологической кривой и нормализация времени эвакуации из желудка в ДПК. Эти изменения указывали на восстановление пропульсивной ЭА в области дуодено-гастрального перехода.
Выявленные нами изменения показателей ПЭГЭГ после ушивания ПЯ ДПК и РДП так же были подвергнуты дискриминантному анализу.
Статистически значимыми для оценки выявленных методом ПЭГЭГ различий послеоперационных моторно-эвакуаторных изменений оказались базальные значения Ps, Pi подвздошной и толстой кишки; Pi/Ps желудка и толстой кишки; Pi/P(i+1) тощей/подвздошной и подвздошной/толстой кишки; Критм подвздошной кишки, а так же стимулированные значения Pi и Pi/Ps ДПК, Pi/Ps толстой кишки, Pi/P(i+1) желудка/ДПК, К ритм желудка и подвздошной кишки. Статистически значимым оказался и показатель компенсации перистальтической активности желудка.
Это подтвердило наличие статистически значимых различий значений показателей ПЭГЭГ здоровых лиц и в группах пациентов после ушивания ПЯ ДПК и РДП и определило показатели ПЭГЭГ, влияющие на распределение больных по характеру моторно-эвакуаторных нарушений в каждую из групп.
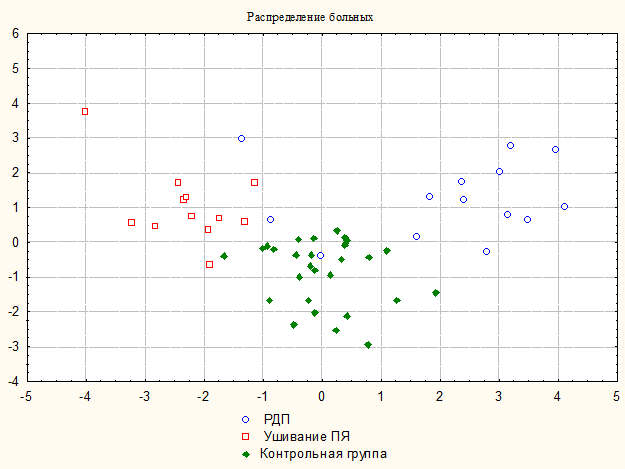
Результаты дискриминантного анализа показали высокую степень различия показателей ПЭГЭГ после ушивания ПЯ ДПК и РДП (рисунок 4).
Рисунок 4. Распределение больных с ПЯ ДПК после ушивания ПЯ и РДП и лиц контрольной группы по показателям ПЭГЭГ на основании дискриминантного анализа.
Таблица 5
Наблюдаемое и предсказанное по данным ПЭГЭГ распределение здоровых лиц и больных с ПЯ ДПК после ушивания ПЯ и РДП
|
Матрица переклассификации |
|||||
|
Наблюдаемое распределение |
Предсказанное распределение |
||||
|
Группы пациентов |
Группы пациентов |
% правильной классификации |
|||
|
Контрольная группа |
После ушивания ПЯ ДПК |
После РДП |
|||
|
Контрольная группа |
n=28 |
28 |
0 |
0 |
100 |
|
После ушивания ПЯ ДПК |
n=26 |
2 |
24 |
0 |
91,6 |
|
После РДП |
n=38 |
6 |
2 |
30 |
78,5 |
|
Всего |
n=92 |
92,5 |
30 |
26 |
92,5 |
Наличие межгрупповых различий позволило создать электрофизиологическую модель моторно-эвакуаторных нарушений у больных с ПЯ ДПК после ушивания ПЯ и РДП с высокой прогностической эффективностью, достигающей 92,3% (таблица 5).
У больных ПЯ ДПК после РДП большинство значений показателей ПЭГЭГ было ближе к контрольным значениям, и они в 21,5% случаев классифицировались как здоровые, в то время как больные после ушивания ПЯ были отнесены в группу здоровых лишь в 8,4% случаев.
Полученные нами данные были учтены в практической работе. Мы отказались от ушивания ПЯ ДПК в пользу выполнения РДП, что сократило количество послеоперационных осложнений на 24% и позволило избежать повторных операций по поводу послеоперационных нарушений МЭФ желудка.
У больных с декомпенсированным ПДС на фоне нарушения нервно-рефлекторных связей желудка и кишечника в послеоперационном периоде развивались наиболее тяжелые формы моторно-эвакуаторных нарушений, с развитием атонии желудка после изолированной РДП и атонии культи желудка после его резекции.
Данные о состоянии моторной функции желудка у больных с ПДС после селективной проксимальной ваготомии (СПВ) в сочетании с дренирующими операциями носят разноречивых характер [5,8,12]. Сообщения об электрофизиологической оценке желудка методом ПЭГЭГ после РДП в сочетании СПВ в литературе отсутствуют.
Системный анализ показателей ПЭГЭГ больных 3 группы после РДП в сочетании с СПВ показал что, у больных с гипермоторным типом субкомпенсированного ПДС отмечено статистически значимое снижение стимулированной ЭА и перистальтической активности желудка, что по-нашему мнению было обусловлено денервацией желудка. При этом базальные значения ЭА желудка соответствовали дооперационному уровню, что указывало на отсутствие влияния на неё СПВ. У больных данной группы в послеоперационном периоде отсутствовали признаки послеоперационного гастростаза и, по данным комплексного обследования, уже через 2 недели после операции отмечалась нормализация размеров и моторики желудка.
У больных с гипомоторным типом субкомпенсированного ПДС, напротив, было отмечено снижение базальной ЭА желудка стимулированной ЭА и перистальтической активности желудка с ещё большим их снижением после пищевой стимуляции. Снижение более высоких, чем у пациентов с гипермоторным типом ПДС уровня базальной ЭА желудка мы связываем с восстановлением пассажа желудочного содержимого после РДП. В этой группе больных имелись клинические, рентгенологические и электрофизиологические признаке послеоперационного гастростаза с восстановлением размеров и МЭФ желудка только через 6-7 месяцев после операции.
Выявленные различия показателей ПЭГЭГ у больных гипер- и гипомоторным типом субкомпенсированного ПДС после РМД+СПВ были так же проверены методом дискриминантного анализа..
В созданную модель послеоперационных моторно-эвакуаторных нарушений вошло 13 показателей ПЭГЭГ. Статистически значимыми оказались базальный и стимулированный Pi желудка, базальный Pi тощей кишки, базальный Pi/P(i+1) тощая/подвздошная кишка, базальный Критм желудка и стимулированный Критм подвздошной кишки.
В результате анализа было выявлено, что около 30% больных обеих групп после РДП+СПВ не имели достоверных отличий по показателям ПЭГЭГ от контрольной группы что позволило их классифицировать как здоровых (рисунок 5).
Рисунок 5. Распределение больных с различными типами субкомпенсированного ПДС после РДП+СПВ по показателям ПЭГЭГ.
У 71,4% больных с субкомпенсированным ПДС по гипермоторному типу и 70,0% больных с субкомпенсированным ПДС по гипомоторному типу после операции имелись значимые различия электрофизиологических показателей с классификацией их в разные группы. Все пациенты контрольной группы были классифицированы правильно (100%).
Общий процент правильной классификации наблюдений в соответствующие группы составил 86,5% (таблица 6).
Таблица 6
Результаты дискриминантного анализа показателей ПЭГЭГ у больных после РДП+СПВ
|
Матрица переклассификации |
|||||
|
Наблюдаемое распределение |
Предсказанное распределение |
||||
|
Группы пациентов |
Группы пациентов |
||||
|
Субкомпенсированный ПДС |
Контрольная группа |
% правильной классификации |
|||
|
Гипермоторный тип |
Гипомоторный тип |
||||
|
Субкомпенси-рованный ПДС |
Гипермоторный тип |
10 |
0 |
4 |
71,4 |
|
Гипомоторный тип |
0 |
7 |
3 |
70,0 |
|
|
Контрольная группа |
0 |
0 |
28 |
100 |
|
|
Всего |
10 |
7 |
35 |
86,5 |
|
Таким образом, системный анализ показателей ПЭГЭГ подтвердил наличие достоверных различий в характере и продолжительности компенсации послеоперационных моторно-эвакуаторных нарушений у пациентов с гипермоторным и гипомоторным типом субкомпенсированного ПДС после РДП в сочетании с СПВ.
Выводы.
Системный подход к анализу показателей ПЭГЭГ с использованием МмСА позволил выявить изменения моторики ЖКТ у больных с ЯБ, осложнённой кровотечением, в зависимости от локализации язвы, с наибольшими её изменениями у больных с дуоденальной локализацией язвы.
Применение МмСА показателей ПЭГЭГ у больных с ЯБ, осложнённой субкомпенсированным ПДС, позволило выявить неоднородные по характеру моторно-эвакуаторных нарушений группы больных с наличием переходных типов от компенсации моторики желудка (гипермоторный тип) к её декомпенсации (гипомоторный тип).
Дискриминантным методом и методом многофакторной логистической регрессии подтверждено, что сохранение язвы ДПК, сочетанных язвенных осложнений, перидуоденальных рубцовых сращений и деформация пилоро-дуоденальной зоны после ушивания ПЯ ДПК приводит к моторно-эвакуаторным нарушениям, соответствующим субкомпенсированному ПДС, а их устранение и пластическое восстановление ДПК при РДП восстанавливает моторно-эвакуаторную функцию желудка.
Системный подход к анализу данных ПЭГЭГ позволил выявить и подтвердить зависимость моторики желудка у больных с ЯБ, осложнённой субкомпенсированным ПДС после РДП в сочетании с СПВ от её дооперационного состояния (гипермоторный и гипомоторный тип).
У больных с субкомпенсированным ПДС по гипермоторному типу отмечено снижение стимулированной электрической и перистальтической активности желудка с сохранением его базальной ЭА на дооперационном уровне, что сопровождалось ранним (до 2-х недель) восстановлением МЭФ желудка.
У больных с гипомоторным типом субкомпенсированного ПДС выявлено послеоперационное снижение базальной и стимулированной электрической и перистальтической активности желудка с признаками послеоперационного гастростаза и длительным (до 6-7 месяцев) восстановлением МЭФ желудка.
Системный подход в оценке данных ПЭГЭГ у больных с осложнённой ЯБ повысил её диагностическую значимость, позволил создать диагностические модели моторно-эвакуаторных нарушений для каждого из этих осложнений и оценить их прогностическую точность. Учёт возрастных особенностей значений показателей ПЭГЭГ повысил её диагностическую ценность.
Литература:
Ермолаев И.А. Сравнительные результаты различных видов оперативного лечения при осложненной дуоденальной язве (показания, методы, осложнения, ближайшие и отдаленные результаты): автореф. дис. . канд. мед. наук. –Санкт-Петербург, 2005. -24с.
Использование накожной электрогастрографии для оценки состояния желудочно-кишечного тракта/ Ворновицкий Е.Г., Фельдштейн И.В./ Ворновицкий Е.Г., Фельдштейн И.В.// Бюллетень экспериментальной биологии и медицины.- 1998.- Том 126.- N11. С.597-600.
Майстренко Н.А., Мовчан К.Н. Хирургическое лечение язвы двенадцатиперстной кишки. - СПб.: Гиппократ, 2000. - 360 с.
Нотова О.Л. Оценка моторной деятельности желудка и различных отделов кишечника по данным периферической полиэлектрографии: Дис.канд.мед.наук.-М., 1987.-271 С.
Оноприев В.И. Новые концепции, тактика и технологии хирургического лечения осложнённых дуоденальных язв // Вестник хирургической гастроэнтерологии. — 2006. — №1. — С. 11—16
Панцырев Ю.М., Гринберг А.А. Ваготомия при осложнённых дуоденальных язвах. — М.: Медицина, 1979. - 159 с.
Периферическая электрогастроэнтерография в диагностике нарушений моторно-эвакуаторной функции желудочно-кишечного тракта/Ступин В.А., Смирнова Г.О., Баглаенко М.В., Силуянов СВ. // Лечащий врач.- 2005.- №2. - С 60-62.
Рудик А. А. Сравнительные результаты различных видов оперативного лечения при осложнённой дуоденальной язве [Текст] : дис. … д-ра мед. наук / А. А. Рудик. – Хабаровск, 2001. – 331 с.
Синченко Г.И. Курыгин А.А. Сочетанные осложнения язвы двенадцатиперстной кишки – СПб: Фолиант,2007.-192с.
Смирнова Г.О. Периферическая электрогастроэнтерография в клинической практике. - Пособие для врачей / под ред. проф. В.А. Ступина.- М.: ИД «Медпрактика-М».- 2009.- 20 С.
Теоретические предпосылки и экспериментальное обоснование использования электрогастроэнтерографии / Н.С. Тропская, В.А. Васильев,Т.С. Попова // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2005. - №5 . - С. 82-87.
Kennedy, T. Duodenoplasty with Proximal gastric vagotomy / T. Kennedy // Ann. roy. Coll. Surg. Engl. - 1976. - Vol. 58. - P. 144-146.