Проведенные исследования флотоэкстракционного удаления ионов меди из водных растворов позволили определить рациональные условия процесса: рН 7–9, молярное соотношение Cu2+: ПАВ = 1: 1,5, температура раствора 298К, продолжительность процесса — 30 минут. При этих условиях степень извлечения ионов меди составила 90–95 % для исходных концентраций ионов меди 50–150 мг/дм3.
Ключевые слова: медь, флотоэкстракция, степень извлечения, сублат.
Одним из основных источников загрязнения поверхностных вод тяжелыми металлами являются сточные воды гальванических производств, а также сточные воды обогатительных фабрик. Для удаления ионов тяжелых металлов из сточных вод гальванических производств используют реагентные методы очистки, основным недостатком которых являются безвозвратная потеря ценных компонентов и необходимость утилизации большого количества влажного осадка. Поэтому поиск методов, позволяющих проводить регенерацию ценных компонентов, является одним из основных направлений развития технологий очистки сточных вод от ионов тяжелых металлов.
Перспективными в этом отношении являются флотационные методы выделения истинно- и коллоидно-растворенных веществ. В частности, флотоэкстракция, являющаяся комбинацией ионной флотации и жидкостной экстракции и сочетающая положительные стороны обоих методов. Под флотоэкстракцией понимают такой флотационный процесс, при котором сфлотированное вещество (сублат) концентрируется в тонком слое органической несмешивающейся с водой жидкости, находящейся на поверхности водной фазы [1–2].
При всех очевидных преимуществах флотоэкстракции, этот метод не нашел широкого промышленного использования, хотя есть целый ряд экспериментальных исследований, которые устанавливают рациональные параметры процесса и все новые области его применения [2]. Исследования по применению флотоэкстракции для очистки сточных вод от ионов тяжелых металлов не системны и малочисленны. Однако, метод позволяет не только удалять полютанты из техногенных вод, но и возвращать в производственный цикл используемые реагенты.
Процесс флотоэкстракции проводили на установке, описанной ранее [3–5]. Азот из баллона подавался во флотоэкстракционную колонку (объем 250 см3, d=34мм, h=375мм) с исследуемым модельным раствором. Расход воздуха контролировали ротаметром. Как экстрагент использовали изоамиловый спирт. Объем органической фазы 10 см3. Процесс проводили до постоянных остаточных концентраций ионов меди, которую определяли фотометрически [6] на сканирующем спектрофотометре Portlab 501, значения рН устанавливали растворами 0,1М азотной кислоты и 0,1М щелочи NaОН, контролировали с помощью рН-метра Portlab 102.
Выбор собирателя для флотоэкстракции основан на нейтрализации заряда катиона или аниона соответствующим ионогенным поверхностно-активным веществом (ПАВ), то есть при флотоэкстракции катиона необходимо использование анионного ПАВ [7–8]. Собиратель должен образовывать с металлом малорастворимое гидрофобное соединение (сублат). В работе использовали два ПАВ — сульфанол и DowFax. Молекулы ПАВ принимают непосредственное участие в образовании сублата. Они влияют также на степень извлечения, уменьшая значение свободной поверхностной энергии на границе раздела органической и водной фаз. ПАВ уменьшает поверхностное натяжение водной фазы и размер пузырьков газа, что увеличивает эффективность флотоэкстракции. Однако, избыток ПАВ приводит к конкуренции за место на поверхности пузырька. Зависимость степени удаления ионов меди от молярного соотношения ПАВ: Сu2+ (рис. 1) показывает, что оптимальное количество ПАВ, обеспечивающее максимальное удаление ионов меди, соответствует Сu2+: ПАВ = 1:1,5. При добавлении большего количества собирателя степень извлечения падает из-за появления избыточного количества анионов ПАВ.
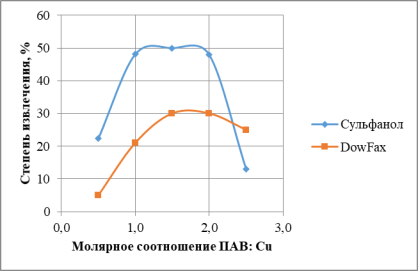
Рис. 1. Зависимость степени извлечения меди от молярного соотношения Ме:ПАВ
Важным фактором флотоэкстракционного процесса является рН раствора, поскольку он определяет наличие частиц, принимающих участие в удалении ионов металла. Изменение рН может приводить к смене заряда колигенда вследствие гидролиза, образования других комплексов, образования осадков. Проведенные исследования позволяют рекомендовать значения рН 7–9 (рис. 2).
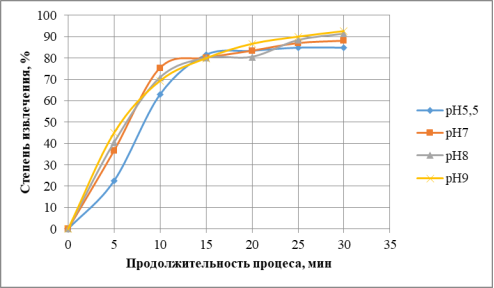
Рис. 2. Зависимость степени извлечения меди от рН раствора
При увеличении исходной концентрации ионов, увеличивается и степень извлечения ионов меди. Исследования проводили при концентрациях 10, 25, 50, 100, 150 мг/дм3 (рис.3).
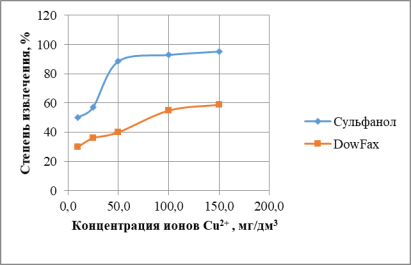
Рис. 3. Зависимость эффективности процесса от начальной концентрации меди
Исследовано влияние температуры растворов на степень извлечения меди (рис. 4). С увеличением температуры степень извлечения меди растет.
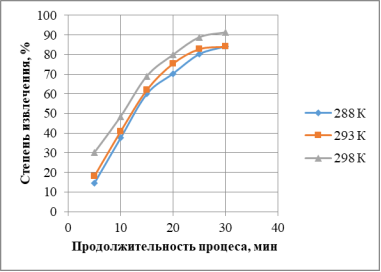
Рис. 4. Зависимость степени извлечения меди от температуры
В работе исследовано извлечение ионов меди из водных растворов методом флотоэкстракции с использованием двух собирателей — сульфанол и DowFax. Было установлено, что собиратель сульфанол более эффективен. Определены рациональные условия удаления ионов меди: молярное соотношение металл:ПАВ = 1:1,5; показатель рН 7–9, температура раствора 298К, продолжительность процесса — 30 минут. При этих условиях степень извлечения ионов меди составила 90–95 % для исходных концентраций ионов меди 50–150 мг/дм3.
Литература:
1. Bi P. The recent progress of solvent sublation / H. Dong, J. Dong // Journal of Chromatography. — 2010. — V. 1217. — P. 2716–2725.
2. Астрелін І.М., Обушенко Т.І., Толстопалова Н. М., Таргонська О. О. Теоретичні засади та практичне застосування флотоекстракции: огляд/ // Вода і водоочисні технології. — 2013.– № 3. — С. 3–23.
3. Обушенко Т. І., Толстопалова Н. М., Токарська Ю. В., Ващук О. О. Видалення іонів важких металів зі стічних вод // Комп’ютерне моделювання в хімії і технологіях та системах сталого розвитку — КМХТ-2016: збірник наукових статей П’ятої міжнародної науково-практичної конференції, 18–20 травня 2016 року, м. Київ. — Київ: НТУУ «КПІ ім. Ігоря Сікорського», 2016. — С. 239–244.
4. Obushenko T., Tolstopalova N., Bolielyi O. The removal of heavy metal (Nickel) ions from waste waters //Вода і водоочисні технології. Науково-технічні вісті, 2017- № 1(21).-С.24–30.
5. Болелый А. С., Обушенко Т. И.,Толстопалова Н. М. Флотоэкстракция ионов никеля из водних растворов //Молодой ученый.– 2017. № 10 (144).–С. 115–118.
6. Набиванець Б. Й., Сухан В. В., Калабіна Л. В. Аналітична хімія природного середовища: Підручник.– К.: Либідь, 1996. — 304 с.
7. Толстопалова Н. М., Обушенко Т. И., Болелый А. С. Флотоэкстракционное удаление ионов тяжелых металлов из сточных вод //Водные ресурсы и климат: материалы докладов V Международного Водного Форума: в 2 ч. — Минск: БГТУ, 2017. — Ч. 2. –С. 90–95.
8. Obushenko T., Tolstopalova N., Baranuk N. Investigation of solvent sublation of cobalt ions from water solutions // Technology audit and production reserves, 2019. — № 2/3 (46). — P. 25–27.







