Взаимодействием 2,4-динитрофенилгидразона бромуксусного альдегида с азот- и фосфорсодержащими нуклеофильными реагентами получены полифункциональные гидразоны. Реакция 2,4-динитрофенилгидразона бром-уксусного альдегида с триэтилфосфитом в толуоле протекает гладко, по схеме Арбузова, давая 2,4-динитрофенилгидразон фосфонуксусного альдегида. Установлено, что наличие кислого водорода при азоте гидразонового фрагмента в 2,4-динитрофенилгидразонфосфонуксусного альдегида в щелочной среде происходит протонотропная изомеризация с образованием продукта с хиноидной структурой. Исследованы реакции 2,4-динитрофенилгидразона бромуксусного альдегида с пиридином и морфолином получены азотосодержащие производные гидразона уксусного альдегида, выявлены особенности протекания этих реакций в зависимости от условий проведения реакции и характера азотистого основания. Пиридин в мягких условиях моноалкилируется с бромгидразоном с образованием пиридиниевой соли. Реакции с морфолином при комнатной температуре замещает атом бром, а при более высоких температурах происходит протонотропное превращение. α-Аминометилфуран и α-аминометилтиофен в реакциях с 2,4-динитрофенилгидразонбромуксусного альдегида ведут аналогично первичным аминам, что приводит к полному N-алкилированию исходных аминоароматических соединений.
Ключевые слова: гидразон, фосфонуксусный альдегид, триэтилфосфит, пиридин, морфолин, таутомерия, хиноидная структура.
Поиск соединений, обладающих различными видами фармокологической активности, являются одним из наиболее важных направлений развития медицинской химии. Одним из подходов к созданию многофункциональных лекарственных препаратов широкого спектра действия является синтез новых типов соединений, содержащих в своей структуре фосфор- и азотсодержащие группы [1–4].
К числу малоизученных типов соединений относятся галоидсодержащие гидразоны. Интерес к синтезу галоидсодержащих гидразонов обусловлен с одной стороны, изучением влияния галоида в α-положении на химические свойства гидразонного фрагмента, а с другой, замещением галоида на различные фосфор- и азотсодержащие группы можно синтезировать новые представители гидразонов со сложной структурой, которые могут быть использованы в синтезе индолов обладающих широким спектром фармакологических и химиотерапевтических свойств [5,6]. Синтез новых представителей гидразонов и следовательно индолов остается главной задачей синтетиков.
Экспериментальная часть
Спектры ЯМР синтезированных соединений записывали на приборе Bruker-300 (300 и 75 Гц) в ДМСО-d6, внутренний стандарт ГМСД. Температуру плавления определяли прибором SMH 30.
Диэтил(Е)- [2-(2-(2,4-динитрофенил)гидразинилиден)этил]фосфонат (2). Смесь 1.4 г (0.004 моль) гидразона бромуксусного альдегида (1), 1 г (0.006 моль) триэтилфосфита в 10 мл. толуола кипятили с обратным холодильником в течении 10 ч. Охлаждали, выпали кристаллы. Выход 1.4 г (68 %), оранжевые кристаллы, т.пл. 1120С. Спектр ЯМР 1Н (δ, м.д., J Гц): 1.25 т (6Н, 2СН3СН2), 3.08 к (2Н, РСН2,2JHP 21.6; 3JHH 6.3 Гц), 7.18 м (3Н, аром.), 8.29 т (1Н, СН=N), 11.50 с (1Н, NH). Спектр ЯМР 13C (δ, м.д.): 16.65; 30.27; 32.06; 62.31; 62.39; 116.68; 123.24; 129.33; 130.08; 137.25; 144.93; 145.76. Найдено, %: C 40.82; H 2.56; Br 8.47; N 15.67. С12Н17N4O7Р Вычислено, %: С 40.00; Н 2.77; Br 8.61; N 15.55.
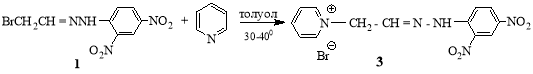
(Е)-1- [2-(2-(2,4-динитрофенил)гидразинилиден)этил]пиридин-1-иум бромид (3). Смесь 1г (0.003 моль) гидразона 1, 0.25 г (0.003 моль) пиридина в 10 мл. толуола, нагревали при 30–40 0С с обратным холодильником в течение 10 ч. Реакционную массу охлаждали, выпавший осадок отделяли. Выход 0.87 г (64 %), желтые кристаллы, т.пл. 220 0С. Спектр ЯМР 1Н, δ, м.д.: 3.6 д (2Н, СН2N+), 7.82 т (1Н, СН=), 6.33–8.90 м (8Н, Аr, пиридин), 11.50 с (1Н, NH). Найдено, %: C 40.65; H 3.43; N 18.43; Br 20.78 С13Н12Br N5О4 Вычислено, %: С 40.82; Н 3.13; N 18.32; Br 20.90.
(Е)-4- [2-(2,4-динитрофенил)гидразинилиден)этил]морфолин (4). Ваналогичных условиях из 1 г (0.003 моль) гидразона 1 и 0.56 г (0.006 моль) морфолина в 10 мл толуола, получили кристаллическую массу, отделяли, промывали спиртом, нерастворенную часть перекристаллизовывали из этилацетата. Выход 0.56 г (48 %), оранжевые кристаллы, т.пл. 133 0С. Спектр ЯМР 1Н, δ, м.д.: 2.11 д (2Н, NCH2), 2.84 м (4Н, 2NCH2), 3.64 м (4Н, 2OCH2), 6.33, 7.42, 7.59 с (3Наром), 8.73 д (1Н, СН=), 11.30 с (1Н, NН). Найдено, %: С 47.3; Н 4.67; N 23.6 C12H15N5O5 Вычислено: С 46.62; Н 4.85; N 22.74
Из спиртового раствора выпали кристаллыN- [4-(E)-2-морфолиноэтилден)гидразинилиден)-3-нитро-1λ54λ5-фенил]–N-(λ1оксиенил)]гидроксиаммо-ниум] (5). Выход 2.7 г (34 %), коричневого цвета, т.пл. 148 0С. Спектр ЯМР 1Н, δ, м.д.: 2.18 м (4Н, N(CH2)2), 2.50 м (2Н, NCH2), 3.58 м (4Н, N(OCH2)2, 6.33, 7.42, 7.59 с (3Наром.), 8.73 д (1Н, СН=), 13.08 с (1Н, N-O-H).
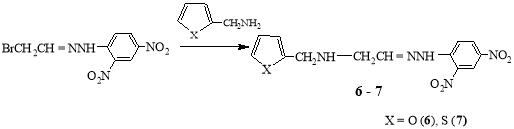
2-(2-(2,4-динитрофенил)гидразинелиден)-N-(фуран-2-илметил)этан-1-амин (6). 1 г (0.003 моль) гидразона 1 растворяли в смеси 6 мл толуола и 4 мл этилового спирта, при перемешивании добавляли 0.5 г (0.005 моль) α- аминометилфурана, нагревали при 40–50 0С в течение 10 часов. Охлаждали, выпали кристаллы, отфильтровывали, промывали спиртом. Выход 1.15 г (72 %), коричневые кристаллы, т.пл. 195 0С. Спектр ЯМР 1Н, δ, м.д.: 1.31 м (1Н, NH-CH2), 2.34 д (2Н, СН2N), 4.2 д (2Н, NCH2CH=), 6.72–8.65 м (6H, Ar, фуран), 8.85 c (1H, CH=), 11.80 c (1H, NH). Найдено, %: С 47.87; Н 4.24; N21.67 C13H13N5O5 Вычислено, % C 48.90; H 4.07; N 21.94
2-(2-(2,4-динитрофенил)гидразинелиден)-N-(тиофен-2-илметил)этан-1-амин (7). Ввыше приведенных условиях реакцией 1 г (0.003 моль) гидразона 1 с 0.5 г (0.004 моль) α-аминометилтиофена в смеси растворителей состоящих из 6 мл толуола и 4 мл этилового спирта после обработки водой из органический фазы выпали кристаллы. Выход 0.85 г (57 %), каштановые, т.пл.75 0С. Спектр ЯМР 1Н, δ, м.д.: 1.25 м (1Н, NH-CH2), 2.18 д (2Н, СН2NH), 4.11 д (2Н, NCH2CH=), 6.72–8.75 м (6Hаром.), 8.85 c (1H, CH=), 11.72 c (1H, NH). Найдено, %: С 46.64; Н 3.45; N 20.17; S 9.21 C13H13N5SO4 Вычислено, %: С 46.57; Н 3.89; N 20.09; S 9.55
Результаты иобсуждение
В настоящей работе изучены химические свойства гидразона бром-уксусного альдегида фосфор- и азотсодержащими нуклеофильными реагентами.
Реакция 2,4-динитрофенилгидразона бромуксусного альдегида (1) с триэтилфосфитом в толуоле протекает гладко, по схеме реакции Арбузова, давая 2,4-динитрофенилгидразон фосфонуксусного альдегида (2)
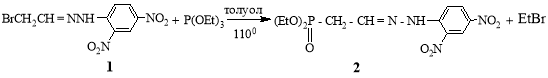
Константы и спектральные данные полученного гидразона (2) индентичны литературным [7], которая синтезировалась реакцией фосфонуксусного альдегида с 2,4-ДНФГ.
Отмечено, что водород у атома азота, в синтезированном 2,4-ДНФГ (2), под действием основания подвергается протонотропной изомеризации.
Так, 2,4-динитрофенилгидразон фосфонуксусного альдегида в слабо щелочной среде подвергается протонотропной изомеризации с образованием изомера с хиноидной структурой, и сопровождается с изменением окраски из оранжевого в темно-каштановый.
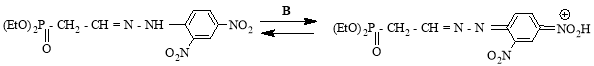
С целью синтеза функциональных азотосодержащих гидразонов разработан ряд препаративных методов.
Проведены реакции 2,4-ДНФГ бромуксусного альдегида с пиридином, морфолином, α-аминометилфураном, α-аминометилтиофеном получены различные азотсодержащие производные гидразона уксусного альдегида, а также выявлены некоторые особенности протекания этих реакцией в зависимости от условий проведения реакции и характера азотистого основания.
Пиридин в мягких условиях (30–400 С) моноалкилируется с бром-гидразоном (1) с образованием пиридиниевой соли (3).
В отличие от пиридина морфолин замещаеть бром в гидразонах при комнатной температуре с образованием соответствующего гидразона 4, а при более высоких температурах (50–600) происходит протонотропное превращение в продукте замещения в соединение 5.
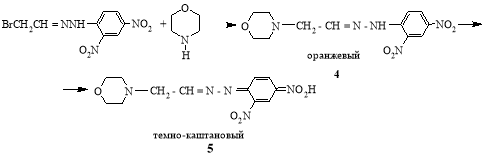
В ПМР спектре наблюдается смещение резонансного сигнала протона при азоте в соединении 4 с δ 11.5 м.д. в слабое поле δ 13.08 м.д., что следует отнести к протону хиноидной структуры соединения 5.
α-Аминометилфуран и α-аминометилтиофен в реакциях с указанным бромгидразоном ведет себя аналогично первичным аминам и реакция заканчивается с полным N-алкилированием исходных аминоароматических соединений.
Таким образом, изученные реакции на основе гидразона бромуксусного альдегида с фосфор- и азотсодержащими нуклеофильными реагентами позволяют получать соответствующие полифункциональные соединения, что открывает возможности для синтеза новых биологически активных веществ.
Литература:
- Allen D. W. and Tebby J. C. Organophosphorus Chemistry. RSC Publishing: The Royal Society of Chemistry (Great Britain), 2009, 38, 9 doi 10.1039/b801337n
- Van Waes F., Debrouwer W., Heugebaert T., Stevens C. Reviews and Accounts. ARKIVOC 2014(i), 386 doi 5550190.0015.100
- Stevens C., Van Meenen E., Masschelein K., Moonen K., De Blieck A., Drabowicz J. Synlett. 2007, 16, 2549 doi 10.1055/s-2007–986654
- Meislich H., Constanza J., and Strelitz J. Journal Organic Chemistry. 1968, 33, 8, 3221
- Bosch S., Amart Morgo, Adrover J. Tetrahedron. 1991, 47, 28, 5269.
- Abdel-Zaber A.Elassar, Hicham H.Did, Nouria A.Al-Awadi and Mohammad H.Elnagdi. Reviews and Accounts. ARKIVOC 2007 (ii), 272.
- Москва В. В., Исмаилов В. М., Разумов А. И. ЖОХ. 1971, 41, 1, 90.







