Введение
Существует много методов обработки токсичных органических соединений, трудно разлагающихся в воде, в которых широко используются полупроводниковые фото каталитические методы, поскольку высокоэффективны [1].
В последнее время некоторые полупроводники используются в качестве фотокатализаторов, таких как ZnO, TiO2, Zn2TiO3.... Среди них TiO2 был изучен очень много. По сравнению с TiO2 оксид цинка (ZnO) имеет большую запрещенную зону (3,27 эВ), что эквивалентно запрещенной зоне TiO2 (3,3 эВ), и его фотокаталитическая реакция аналогична TiO2, но ZnO имеет более широкий спектр поглощения солнечного света [2–3]. Поэтому ZnO является перспективным фотокатализатором для разложения токсичных органических соединений.
Показано, что наиболее эффективным способом увеличения фотокаталитической активности ZnO в видимой области путем уменьшения ширины запрещенной зоны является уменьшение размера материалов или замещение цинка в ZnO некоторыми металлами [1–3].
Цель настоящей работы — синтез нанопорошков Zn1-xMnxO (x=0; 0,01; 0,02; 0,03) и применение разложения Родамина Б в водной среде
Экспериментальная часть
Синтез нано Zn1-xMnxO: нанопорошки Zn1-xMnxO (x = 0; 0,01; 0,02; 0,03), синтезированы методом сжигания геля лимонной кислоты с Zn(NO3)2.6H2O и Mn(NO3)2 согласно соответствующему соотношению молей. Перемешивают и нагревают полученный раствор при 60°С в течение 4 ч, пока раствор не приобретет высокую вязкость, затем сушат при температуре около 70–80°С в течение 12 ч. Затем, прокаленный при температуре 500°С в течение 3 ч, мы получаем нанопорошки Zn1-xMnxO (x = 0; 0,01; 0,02; 0,03).
Материалы после синтеза характеризуются рентгенофазовым анализом (РФА).
Исследование фотокаталитической способности нанопорошков Zn1-xMnxO для реакции разложения Родамина Б:
Добавляли 100 мл раствора Родамина Б 10 мг/л в 4 стеклянных стаканов по 250 мл. Регулировали рН раствора 4. Затем добавляли 120 мг нанопорошков Zn1-xMnxO (х = 0,00; х = 0,01; х = 0,02; х = 0,03) соответственно в 4 стакана, помешивая в темноте в течение 30 минут. Эти растворы освещаются непосредственно компактной лампой 40Вт при постоянном перемешивании в течение 120 минут. Определение содержания Родамина Б в растворе, полученном после центробежной фильтрации, фотометрическим методом при 553 нм.
Эффективность фотокаталитического процесса Н (%) рассчитывали по формуле:
![]()
где C0, C — концентрации Родамина Б в растворе до и после фотокаталитического разложения.
Обсуждение результатов
1. Фазовый состав материалов— спектр РФА
По данным РФА (рис. 1), образцы номинального состава Zn1-xMnxO (x=0; 0,01; 0,02), термообработанные при 500oC в течение 3 ч, являются однофазными и имеют гексагональную структуру (такой же, как у структуры wurtzite ZnO). Основные пики соответствуют гексагональной структуры wurtzite ZnO (JCPDS No. 01–089–1397). По данным рентгеноструктурного спектра (x=0,03) появляются 3 пика новой фазы MnO2.
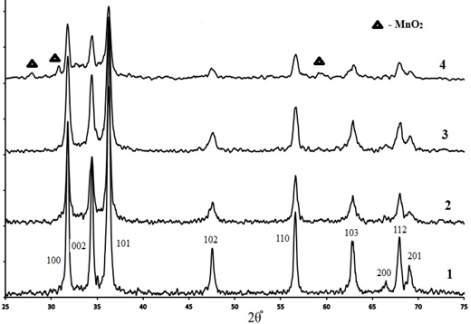
Рис. 1. Дифрактограммы образцов Zn1-xMnxO: x=0 (1), x=0,01 (2), x=0,02 (3), x=0,03 (4)
Расчет размеров областей когерентного рассеяния (ОКР) образцов Zn1-xMnxO проводили по формуле Шеррера по ширине дифракционных максимумов 101. Все результаты приведены в таб.1.
Таблица 1
Размер нанопорошков Zn1-xMnxO (x=0,00 ÷0,03)
|
Образцы Zn1-xMnxO |
2 |
Пик |
|
В, нм |
|
x=0,00 |
36,269 |
101 |
0,328 |
25,5 |
|
x= 0,01 |
36,244 |
101 |
0,432 |
19,4 |
|
x= 0,02 |
36,268 |
101 |
0,501 |
16,7 |
|
x= 0,03 |
36,244 |
101 |
0,507 |
16,5 |
По среднему размеру кристаллов образцов Zn1-xMnxO было обнаружено, что все полученные частицы были наноразмерными. При увеличении содержания замещения Zn на Mn (x) с 0,00 до 0,03 размер частиц Zn1-xMnxO уменьшился с 25,5 до 16,5 нм. Такая закономерность связана с заменой цинка марганцом и, соответственно, с искажением кристаллической решетки, в результате чего создается внутреннее напряжение, приводящее к ограничению роста кристаллов.
2. Влияние массовой доли Mn на эффективность разложения Родамина Б
Экспериментальные результаты были представлены в Таблице 2.
Таблица 2
Эффективность фотокаталитического процесса
|
Zn1-xMnxO |
x= 0,00 |
x= 0,01 |
x= 0,02 |
x= 0,03 |
|
C, мг/л |
2,65 |
2,57 |
0,85 |
2,38 |
|
H,% |
73,5 |
74,4 |
91,5 |
76,2 |
Этот результат можно объяснить тем, что когда концентрация Mn2+, легированного в ZnO, мала (менее 0,02), ион Mn2+ будет частично замещать положение иона Zn2+ в гексагональной структуре ZnO, создавая точечные дефекты из-за странных ионов в структуре ZnO. Это уменьшило ширину запрещенной зоны материала, что привело к увеличению каталитической активности. Поскольку концентрация легирующего Mn2+ продолжает увеличиваться до определенного значения (более 0,02), могут происходить реакции окисления с образованием MnO2 на поверхности ZnO, которые препятствуют поглощению света оксида цинка, что приводит к снижению фотокаталитической активности ZnO.
Ясно, что энергия запрещенной зоны оксида марганца (4,2 эВ) намного больше, чем у ZnO (3,27 эВ), поэтому при увеличении концентрации Mn энергия запрещенной зоны увеличивается, что приводит к снижению фотокаталитической активности материалов. На основании этих результатов было обнаружено, что Zn1-xMnxO с x = 0,02 обладает наибольшей фотокаталитической активностью.
Заключение
Таким образом, методом сжигания геля с использованием лимонной кислоты синтезированы нанопорошки Zn1-xMnxO (x=0; 0,01; 0,02). По данным РФА, образцы имеют однофазными и имеют гексагональную структуру wurtzite ZnO и наноразмеры.
Исследована фотокаталитическая активность материалов Zn1-xMnxO под действием видимого света компактной лампы 40Вт. Результаты показали, что 2 % Mn, легированный ZnO, обладал самой высокой фотокаталитической активностью.
Литература:
- Chen, C., J.Liu, P.Liu and B.Yu. Investigation of Photocatalytic Degradation of Methyl Orange by Using Nano-Sized ZnO Catalysts. // Adv. Chem. Engi. Sci. — 2011. Vol. 1. — P. 9–14.
- R. Velmurugan, M. Swaminathan. An efficient nanostructured ZnO for dye sensitized degradation of Reactive Red 120 dye under solar light. // Solar Energy Materials & Solar Cells. — 2011. Vol. 95. — P. 942- 950.
- A. Jagannatha Reddy, M. K. Kokila, H. Nagabhushana. EPR and photoluminescence studies of ZnO:Mn nanophosphors prepared by solution combustion route. // Spectrochim. Acta Part A. — 2011. Vol. 79. — P. 476- 480.







