Введение
Многие методы обработки тяжелых металлов в сточных водах были изучены и применены, такие, как биохимический метод, физико-химический метод, химический метод…В частности, адсорбционный метод с использованием адсорбирующих материалов, изготовленных из сельскохозяйственных отходов для отделения тяжелых металлов от воды были изучены много, потому что они имеют преимущество в том, что они доступны, дешевые и экологически чистые материалы [1–3].
Было показано, что кокосовое волокноснанопокрытием Fe3O4, обладает хорошей адсорбцией ионов Ni(II) и Cr(VI) в водной среде [1]. Однако факторы, влияющие на процесс адсорбции, детально не изучены.
Цель настоящей работы — исследование факторов, влияющих на адсорбции ионов Ni(II) и Cr(VI) кокосовым волокном с нанопокрытием Fe3O4
Экспериментальная часть
Кокосовое волокно с нанопокрытием Fe3O4 изготавливается в соответствии с литературой [1]. Здесь соотношение массы кокосового волокна и массы Fe3O4 было выбрано равным 5: 2.
Адсорбция Ni (II), Cr (VI): добавили 0,15 г адсорбента в треугольник с 25 мл раствора Ni (II) или Cr (VI) с концентрацией 100 мг/л. Перемешали смесь магнитной мешалкой при комнатной температуре в течение 120 мин со скоростью 200 об/мин. После сорбции отфильтровали раствор и измерили полученную концентрацию Ni (II) и Cr (VI) в растворе с помощью атомно-адсорбционной спектроскопии (AAS). Эффективность адсорбции Н (%) и адсорбционную нагрузку q (мг/г) рассчитывали по формуле:
![]() и
и![]()
где C0, Ct — начальная и полученная концентрация ионов Ni (II) и Cr (VI) после адсорбции (мг/л); V — объем раствора (л); m — масса адсорбента (г).
Изучение факторов, влияющих на адсорбции ионов Ni(II) и Cr(VI) кокосовым волокном с нанопокрытием Fe3O4: влияние pH (pH = 1 ÷ 7; t = 120 минут; C = 100 мг/л); влияние времени на адсорбционное равновесие (pH = 5,9 для Ni и pH = 3,1 для Cr; t = 30 ÷ 180 минут; C = 100 мг/л); влияние концентрации ионов металлов (pH = 5,9 для Ni и pH = 3,1 для Cr; t = 120 минут; C = 50 ÷ 400 мг/л).
Обсуждение результатов
1. Влияние рН
Эксперименты показывают, что pH среды по-разному влияет на адсорбции ионов Ni(II) и Cr(VI) кокосовым волокном с нанопокрытием Fe3O4 (рис. 1).
Для Ni(II) повышение рН среды с 1 до 7, эффективность адсорбции резко возрастает, затем практически не изменяется. Для Cr(VI) эффективность адсорбции достигает максимума при pH = 3.
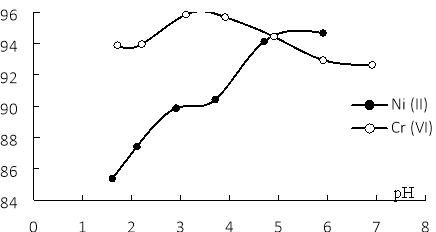
Рис. 1. Влияние pH на эффективность адсорбции Cr(VI) и Ni(II) кокосовым волокном с нанопокрытием Fe3O4
Как известно, в области окружающей среды 1
При увеличении pH среды больше, чем pHI, материал заряжается отрицательно, поэтому адсорбционная способность Ni2+ резко возрастает, но когда pH> 5 Ni(II) превращается в Ni(OH)+, заряд уменьшается до (+1), поэтому эффективность адсорбции практически постоянна.
Таким образом, наилучшее значение рН среды было выбрано 5,9 для Ni(II) и 3,1 для Cr(VI).
2. Влияние времени реакции
Результаты зависимости эффективности адсорбции Ni(II) и Cr(VI) материала от времени приведены на рис. 2.
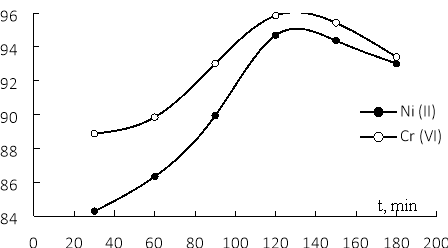
Рис. 2. Влияние времени реакции на эффективность адсорбции Ni(II) и Cr(VI)
Для обоих ионов от 30 минут до 120 минут эффективность адсорбции постоянно возрастала, достигая максимума при t = 120 минут, а затем слегка снижалась. Таким образом, для адсорбционного равновесия как Ni(II), так и Cr (VI), достигнутого через 120 минут, последующее встряхивание могло привести к нарушению равновесия, в результате чего скорость десорбции была больше скорости адсорбции, следовательно, эффективность адсорбции снижается через t > 120 минут.
3. Изотермы адсорбции
Изотермическими моделями, наиболее широко используемыми для адсорбции, являются модели Ленгмюра и Фрейндлиха. Здесь линейная форма этих двух изотермических моделей используется для анализа изотермических данных адсорбции ионов тяжелых металлов Ni(II) и Cr(VI) кокосовым волокном с нанопокрытием Fe3O4.
Изменили начальные концентрации ионов Ni(II) и Cr(VI) с 50 мг/л до 400 мг/л. Регулируем pH = 5,9 для раствора Ni(II) и pH = 3,1 для раствора Cr(VI). Перемешивают магнитной мешалкой в течение 120 минут при комнатной температуре со скоростью 200 об/мин. Результаты определения линейной формы уравнения Ленгмюра и уравнения Фрейндлиха для ионов показаны на рис. 3.
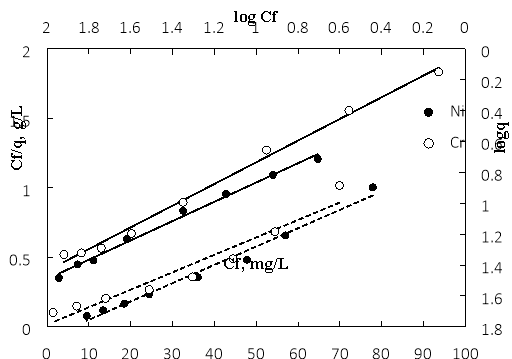
Рис. 3.Уравнения Ленгмюра (![]() ) и Фрейндлиха (----) для ионов Ni(II) и Cr(VI)
) и Фрейндлиха (----) для ионов Ni(II) и Cr(VI)
Модель Ленгмюра дает коэффициент корреляции уравнения регрессии для обоих ионов, приблизительно равный 1 (R2=0,99). В то время как модель Фрейндлиха дает меньший коэффициент корреляции R2, в пределах от 0,94 до 0,98. Степень пригодности адсорбции к модели адсорбции Ленгмюра более точно, чем Фрейндлих, доказывает, что центры адсорбции на поверхности этого материала относительно однородны, и явление монолитной адсорбции является более доминирующим.
Таблица 1
Линейные изотермические параметры: константаФрейндлиха (Kf), гетерогенный коэффициент (n), максимальная адсорбционная нагрузка (qmax) исродство адсорбции (B) для ионов Ni(II) иCr(VI)
|
Иноы |
Ленгмюр |
Фрейндлих |
||
|
qmax, мг/г |
B |
Kf |
n |
|
|
Ni(II) |
71,94 |
0,040 |
4,86 |
1,69 |
|
Cr(VI) |
64,10 |
0,039 |
4,53 |
1,77 |
Обратите внимание, что максимальная адсорбционная нагрузка и сродство к адсорбции уменьшаются на порядок Ni(II)> Cr(VI).
Заключение
Наилучшее значение pH среды для кокосового волокна с нанопокрытием Fe3O4 (с pHI = 3,4) для адсорбции Ni (II) и Cr(VI) составляет 5,9 и 3,1 соответственно. Время достижения адсорбционного равновесия для обоих ионов составляет 120 минут.
Адсорбция ионов Ni(II) и Cr(VI) кокосовым волокном с нанопокрытием Fe3O4 следует изотермическому уравнению Ленгмюра и Фрейндлиха с коэффициентом корреляции R2 ≈ 1. Максимальная адсорбционная нагрузка по модели Ленгмюра: qmax (Ni (II)) = 71,94 мг/г; qmax (Cr (VI)) = 64,10 мг/г.
Литература:
- Динь В. Т., Ву Т. З. Исследование распределения наночастиц Fe3O4 на кокосовом волокне для адсорбции ионов Ni(II) и Cr(VI) в водной среде. // Молодой ученый. — 2019. -№ 20. — С. 21–25.
- Vu Thi Hau, Trinh Thu Nguyen. Исследование адсорбционной способности Ni(II), Cr(VI) угля, приготовленного из стеблей лотоса. // Вьетнамский журнал химии, физики и биологии. — 2017. Vol. 4. — P. 81- 88.
- P. C. Okafor, P. U. Okon, E. F. Daniel. Adsorption Capacity of Coconut Shell for Lead, Copper, Cadmium and Arsenic from Aqueous solutions. // International Journal of Electrochemical Science. — 2012. Vol. 7. — P. 12354–12369.







