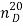Оксид гексена представляет собой бесцветную легковоспламеняющуюся жидкость. Основные физические свойства представлены в таблице 1.
Таблица 1
Физические свойства оксида гексена [7,8].
|
Показатель |
Величина |
|
Молекулярная масса, г/моль |
100,16 |
|
Плотность (при 20 °C), кг/м 3 |
831,2 |
|
Температура кипения, °C |
118,0–120,0 |
|
Давление насыщенных паров (при 20 °C), кПа |
1,586 |
|
Температура вспышки, °C |
15,0 |
|
Показатель преломления
|
1,4055 |
|
Теплота испарения, кДж/моль |
34,39 |
ОГ, подобно остальным представителям гомологического ряда оксиранов, является очень реакционноспособным из-за напряженного трехчленного кислородсодержащего цикла. Большинство реакций проходят под действием кислотных, либо основных катализаторов, однако некоторые из них, например, с аммиаком, протекают достаточно быстро и в отсутствие катализатора [9].
Направление, по которому будет раскрываться кольцо, зависит от типа катализатора и реагента. В общем случае раскрытие эпоксидного цикла происходит по механизму нуклеофильного замещения на одном из атомов углерода цикла. Использование разнообразных нуклеофильных агентов способствует раскрытию кольца по S N 2-механизму, а атака нуклеофильного агента направляется преимущественно по пространственно доступному, незамещенному атому углерода. Таким образом протекает, например, реакция гидролиза, результатом первой является α-гликоль.
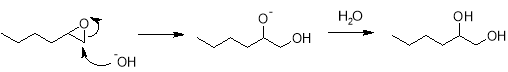
Аналогичным образом в реакциях алкоголиза происходит образование соответствующих эфиров.
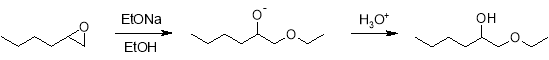
Взаимодействие оксида гексена с аммиаком в водном растворе приводит к образованию гексаноламина, причем реакция не заканчивается образованием монопродукта, а идет дальше, в результате чего на выходе получается смесь моно-, би- и тригексаноламина.
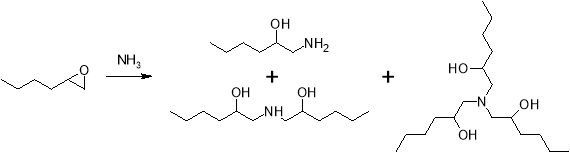
Также помимо аммиака цикл достаточно легко раскрывается под действием различных органических оснований из ряда аминов, например пиррола.
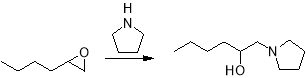
В присутствии же кислотных или электрофильных катализаторов механизм тех же самых реакций гидролиза и алкоголиза может существенно измениться, как и образующиеся в результате продукты. В первой быстрой обратимой стадии оксиран протонируется по атому кислорода, образуя оксониевый катион. Во второй стадии происходит нуклеофильная атака протонированной формы, которая способствует ускорению раскрытия кольца.
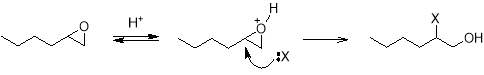
Механизм раскрытия кольца определяется устойчивостью образующегося карбокатиона: чем более он стабилен, тем более вероятно протекание реакции по S N 1-механизму. В этом случае направление атаки нуклеофильной частицы противоположно тому, что наблюдается при S N 2-механизме. Таким образом, атака нуклеофила происходит по наиболее замещенному атому углерода. Так, например, алкоголиз оксида гексена метанолом в кислой среде при реализации S N 1-механизма приводит к образованию 2‑метоксигексанола-1.
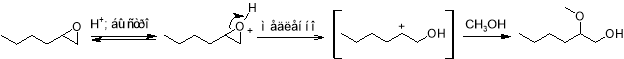
На практике же оба механизма раскрытия кольца конкурируют между собой, и образуется смесь двух изомеров, являющихся продуктами сольволитического расщепления трехчленного цикла.
Оксиду гексена свойственны реакции перегруппировки под действием кислот, в том числе и кислот Льюиса. Так, например, эта реакция катализируется MgBr 2 . Раскрытие цикла в этом случае обусловлено образованием координационного донорно-акцепторного комплекса между атомами магния и кислорода, а его направление определяется стабильностью образующегося карбокатиона, поэтому основным продуктом реакции является капроновый альдегид.
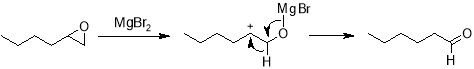
Наличие галогенид иона способствует тому, что реакции с галогенидами магния приводят также к образованию небольших количеств галогенгидрина, в данном случае наряду с альдегидом получается 2-бромгексанол, который может образовываться как напрямую из оксирана, так и из образующегося карбонильного соединения также через координационный комплекс.
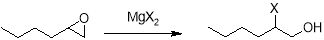
При проведении этой же реакции в малополярных апротонных растворителях в большей степени образуется гексанон-2.
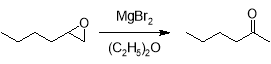
ОГ реагирует с реактивами Гриньяра, однако ввиду возможности перегруппировки исходного оксирана под действием галогенидов магния в ходе этих реакций реактив Гриньяра присоединяется не к исходному эпоксиду, а образующемуся в ходе перегруппировки альдегиду, так как перегруппировка протекает быстрее, чем присоединение к эпоксиду [10].
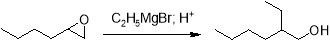
Проведение реакции в эфире приводит к образованию соответствующего изомера. В этом случае она протекает по S N 2-механизму у насыщенного атома углерода эпоксида под действием карбоаниона магнийорганического соединения.
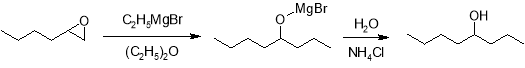
Аналогичным образом протекает реакция и с алкиллитиевыми реагентами, до тех пор, пока они свободны литиевых солей.
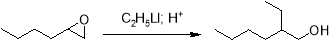
Восстановление оксида гексена с помощью тетрагидроалюмината лития протекает аналогично большинству его реакций с раскрытием цикла при наиболее доступном атоме углерода. Продуктом реакции является вторичный спирт, а сама реакция протекает подобно предыдущим реакциям, протекающим по S N 2-механизму.
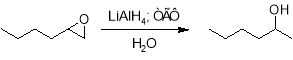
При каталитическом гидрировании оксида гексена на никеле Ренея, напротив, наблюдается образование первичного спирта. Таким образом, в ходе реакции происходит разрыв цикла в наиболее стерически затрудненном положении. Реакция протекает на металлической поверхности и, по-видимому, протекает по совершенно другому механизму.
ОГ не нашел широкого распространения в области нефтехимического синтеза. Большая по сравнению с гексеном доступность сырья его более легких аналогов — в особенности этилена и пропилена, а также большие выходы при их переработке в процессах неполного окисления обуславливают малую область применения оксида гексена и как следствие гораздо меньшие мощности по его производству в промышленных масштабах. Тем не менее, все те же процессы, используемые в производстве оксидов этилена и пропилена, возможно применять с достаточно высокой эффективностью и для производства оксида гексена. К таким процессам относятся традиционные способы производства хлоргидринным методом и с использованием гидропероксидов, а также альтернавтиный процесс эпоксидирования — окисление пероксидом водорода на титан-силикалитном катализаторе TS-1.
Хлоргидринный процесс состоит их двух этапов — гипогалогенирование с получением галогенгидринов и их последующее дегидрогалогенирование под действием оснований.
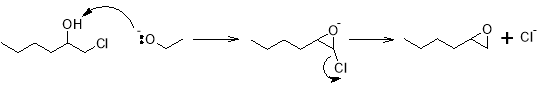
На первом этапе гексен и хлор смешиваются с избытком воды, при этом реакция протекает через образование промежуточного хлорониевого иона, а ее механизм выглядит следующим образом.
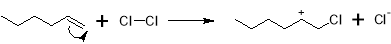
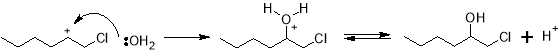
При этом наряду с 1-хлор-2-гексанолом образуются и другие соединения. Данные, полученные в ходе моделирования процесса, где в качестве α‑олефина используется пропилен, говорят о том, что также возможно образование 2-хлор-1-гексанола, 1,2-дихлоргексана, а также различные изомеры дихлоргексилового эфира [11].
Дегидрохлорирование до оксида гексена проводится путем добавления щелочи — водного раствора гидроксида кальция или натрия. Поскольку кислоты и основания катализируют реакции раскрытия оксиранового кольца, то необходимо использовать небольшой избыток гидроксида — для эпоксидирования и нейтрализации образующейся в ходе гипохлорирования соляной кислоты.
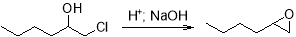
Те же самые реакции в лабораторных условиях можно осуществить путем использования гипогалогенитных кислот или N-бром-, N‑хлорсукцинимидов в системе диметилсульфоксид-вода. Дальнейшее дегидрогалогенирование проводится также под действием оснований, обычно это алкоголят-ионы.
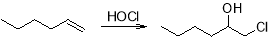
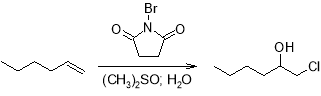
Однако более распространенным лабораторным методом получения эпоксидов является прямое эпоксидирование олефинов надкислотами по реакции Прилежаева.
Литература:
- Clerici, M. G., Ingallina, P. Epoxidation of lower olefins with hydrogen peroxide and titanium silicalite // Journal of Catalysis. — 1993. — V. 140, № 1. — Р. 71- 83.
- Amphiphilic block copolymer-toughened epoxy resins and powder coating made therefrom: pat. U. S. Pat. 8,021,586 B2, Int. Cl.: B29C 47/88/ K. E. Verghese, M. P. Franca, Assignee: Dow Global Technologies LLC, заявл. 02.11.2005, опубл. 20.09.2011
- Aliphatic polycarbonate-based surface active agents: pat. U. S. Pat. 10,011,758 B2, Int. Cl.: C09K 8/584, C09G 64/34/ K. M. Williams, D. T. Plummer, K. D. Sharp, S. D. Allen, C. Simoneau, Assignees: Sasol Chemicals LLC, Novomer Inc., заявл. 26.08.2014, опубл. 03.07.2018
- Refrigerating machine oil and working fluid composition for refrigerating machines: pat. JP. Pat. 5913691 B2, Int.Cl.: C10M 105/38, C09K 5/04/ K. Takigawa, M. Saito, T. Okido, K. Takahashi, Assignee: JX Nippon and Energy Corporation, заявл. 03.09.2015, опубл. 27.04.2016
- Refrigerating machine oil and working fluid composition for refrigerating machines: pat. JP. Pat. 6082704 B4, Int.Cl.: C10M 107/34/ K. Takigawa, Y. Shimomura, Assignee: JX Nippon and Energy Corporation, заявл. 08.05.2014, опубл. 15.02.2017
- Refrigerator oil and working fluid composition for refrigerator: pat. JP. Pat. 2009074018 A, Int. Cl.: F25B 1/00, C10N 30/00/ K. Takigawa, Y. Shimomura, Assignee: Nippon Oil Corporation, заявл. 29.10.2007, опубл. 09.04.2009
- Рид, Р. Свойства газов и жидкостей: Справочное пособие / Р. Рид, Дж. Праусниц, Т. Шервуд. — Л.: Химия, 1982. — 592 с.
- Handbook of the Thermodynamics of Organic Compounds / R. Stephenson, S. Malanowski. — New York: Elsevier, 1987. — 561 p.
- Parker, R. E. Mechanisms of epoxide reactions / R. E. Parker, N. S. Isaacs // Chemical reviews. — 1959. Vol. 59, P. 737–799.
- Органическая химия: учебное пособие. В 3 т. Т. 3. / Дж. П. Клайден [и др.]; под ред. Дж. П. Клайден. — Oxford: Oxford University Press, 2001. — 744 с.
- Потехин, В. М. Химия и технология углеводородных газов и газового конденсата. / В. М. Потехин — СПб.: ХИМИЗДАТ, 2016. — 560 с