Белковая матрица является наиболее важным объектом исследования для понимания обменных процессов в эмали, так как именно на ней запрограммирована вся структура зрелой эмали. Необходимость изучения этих процессов появилась в связи с учащением случаев прорезывания у детей зубов с несовершенной структурой эмали. Изучение такой эмали на гистологическом и биохимическом уровне позволяет сделать вывод о том, что подобные нарушения связаны с различными мутациями в генах белков эмалевого матрикса.
Детальное изучение литературы по нокаутированным мышам позволило выяснить основные причины врождённых патологий эмали у человека и выяснить механизм биоминерализации эмали. В результате анализа были выдвинуты новые теории, опровергающие широко распространенные парадигмы образования эмали.
Сегодня считается доказанным и очевидным, что все минерализованные ткани, в том числе эмаль, формируются на матрицах, роль которых в большинстве случаев выполняют белки. Белковые матрицы исполняют роль специальных структур, на которых запрограммированы расположение, размеры, свойства и структура минеральной фазы. Обычно в минерализованных тканях содержится 20–25 % белка, и лишь эмаль коренным образом отличается от других минерализованных тканей в 200 раз меньшим содержанием белка в ней.
Основными компонентами белковой матрицы эмали являются Са 2+ -связывающие белки; белок, нерастворимый в этилендиаминтетрауксусной кислоте (ЭДТА) и соляной кислоте (HCl) и белки, участвующие в формировании структуры межклеточного матрикса: амелогенин, энамелин, тафтелин, амелобластин, бигликан. Немаловажными компонентами являются эмалевые протеиназы, такие как эмалилизин (ММР-20) и калликреин (KLK-4), способствующие в определенный этап развития эмали удалению из неё органических соединений для обеспечения максимального контакта между кристаллами гидроксиапатита.
Са 2+ -связывающий белок эмали (КСБЭ) способен в нейтральной среде образовывать нерастворимый комплекс с ионами Са 2+ . Поскольку молекула КСБЭ эмали может связывать 8–10 ионов Са 2+ , очевидно, одна часть групп используется на создание белковой трехмерной матричной сетки через Са2+ -мостики, а другая — на взаимодействие этой сетки с минеральной фазой — гидроксиапатитом эмали. Вероятно, связанные с матрицей ионы Са 2+ служат точками нуклеации, а в дальнейшем — зонами роста кристаллов гидроксиапатита, которые ориентируются в соответствии с формирующейся белковой сетью — матрицей эмали. Это обеспечивает их строго упорядоченное расположение, регулярность строения, прочность и другие свойства эмали.
Большое значение придают и белку, не растворимому в ЭДТА и HCl. Высокая устойчивость белка, роднящая его с коллагеном и эластином, позволяет предположить, что он исполняет роль остова, «скелета», придающего устойчивость всей структуре эмали в целом.
Амелогенин — гликофосфопротеин. Это основной секреторный продукт амелобластов, составляющий более 90 % органического компонента, присутствующего в эмали. Было обнаружено, что гидрофобные молекулы амелогенина способны к самосборке в наносферы, которые в свою очередь порождают структуры более высокого порядка, такие как «цепи», или волокна. Сборка наносфер осуществляется в цитоплазме амелобласта без участия АТФ. Собранные наносферы попадают во внеклеточное пространство. В присутствии минерализующих ионов наносферы связываются друг с другом, чтобы сформировать выровненные волокна длиной в 10–15 наносфер. Волокна имеют ширину ~17 нм и расположены параллельно друг другу, сохраняя между собой расстояние от 5 до 20 нм. Пучки выровненных нановолокон амелогенина длиной до 100 мкм образуют органический каркас, имитирующий нановолокна апатита в эмалевой призме. Это говорит о том, что волокна амелогенина могут быть предшественниками эмалевых призм, они обеспечивают направленный рост кристаллов апатита с образованием протяжённых параллельных тяжей кристаллов, составляющих структурную основу эмали [12].
При анализе литературы по исследованиям мышей было выяснено, что существует два амелогениновых самосвязывающих домена, которые играют решающую роль в сборке наносфер. Домен самосборки А состоит из первых 42 остатков N-концевой области нативного мышиного амелогенина. Было обнаружено, что это участок взаимодействия между мономерами амелогенина. Домен самосборки В состоит из 17 аминокислотных остатков, которые граничат с гидрофильным С-концом и способны стимулировать амелогенин-амелогениновые взаимодействия.
Удаление доменов самосборки A или B у мышей приводит к дефектным фенотипам эмали, подтверждая утверждение о том, что сборка наносферы является обязательным этапом биоминерализации эмали. Оба мутанта показали более тонкую эмаль, разрушаемую во время жевания. У мышей, у которых отсутствовал N-концевой домен (домен А), не выявлено наносфер амелогенина. Наблюдались короткие, увеличенные кристаллы, не организованные в призмы. Мутанты без С-концевого домена (домен В) имели наносферы, которые были выровнены, имели очень крупные размеры. Призмы были расположены ненормально, как и кристаллы внутри каждой призмы. Таким образом, самоорганизующиеся домены A и B являются неотъемлемыми для правильного образования эмали и формирования ее необходимой толщины [9].
При исследовании мышей дикого типа и мышей с нулевым аллелем гена амелогенина были выявлены чёткие различия в структуре эмали. Эмаль последних не имеет нормальной призматической структуры, а также уменьшена по толщине по сравнению с эмалью мыши дикого типа. Дефектные зубы сильно подвержены патологической стираемости, значительно снижается их способность к механическим нагрузкам. Соответственно, определенные части гена амелогенина могут иметь решающее значение для контроля толщины эмали, в то время как другие части могут играть важную роль в упорядочении ее структуры.
Амелобластин (также известный как амелин) — второй по распространённости белок эмалевого матрикса. Иммуногистохимические эксперименты показали, что этот белок расположен между эмалевыми призмами в эмалевой оболочке. Белки, расположенные в оболочке, являются продуктами расщепления амелобластина. Напротив, неповреждённый амелобластин в наружной вновь образованной эмали накапливается на призмах эмали, а не в оболочках эмалевых призм, как продукты расщепления. Это были первые данные, свидетельствующие о том, что амелобластин выполняет одну функцию на фронте минерализации и другую функцию после расщепления и накопления в пространстве оболочки.
Интактный амелобластин является элементом развивающейся эмали и никогда не выделялся in vivo . Расщепление амелобластина осуществляется с помощью протеиназы эмалилизина (ММР20) и учитывает все известные продукты расщепления амелобластина в матрице эмали. Продукты N-концевого расщепления накапливаются в оболочках эмалевых призм по всему слою эмали и участвуют в регуляции роста кристаллов гидроксиапатита, в то время как связывающие кальций продукты C-концевого расщепления находятся на поверхности призм. Следовательно, это подтверждает предыдущие данные, показывая, что продукты расщепления N- и C-конца амелобластина локализуются в разных областях образующейся эмали и играют разные роли в развитии эмали [10].
Было осуществлено изучение анализа гетерозиготных мышей по гену амелобластина и мышей с нулевым аллелем гена амелобластина. Выявлено, что у последних образуется дефектная эмаль, сопровождающаяся значительным ее утончением. Такие зубы не способны выполнять своё назначение — откусывание и пережёвывание пищи и впоследствии подвергаются полному разрушению и утрате в результате необратимого процесса. Полученные результаты подтверждают роль амелобластина в инициации и последующей регуляции роста кристаллов гидроксиапатита.
Энамелин является гликопротеином. Это крупнейший из известных белков эмали. Он способен сильно адсорбировать кристаллы эмали и способствует росту кристаллов. Сканирующая электронная микроскопия мышей дикого типа, мышей, гетерозиготных по гену энамелина и мышей с нулевым аллелем гена энамелина из резцов и моляров позволила увидеть следующее:
- Мыши дикого типа и гетерозиготные по данному гену мыши имели толстый слой эмали с четко выраженными призмами.
- Эмаль мышей с нулевым аллелем гена энамелина чрезвычайно тонкая и неправильная, с шероховатой поверхностью. В некоторых местах эмаль даже не сформировалась.
Как энамелин, так и амелобластин имеют сходные функции в отношении инициации и регуляции роста кристаллов, тогда как амелогенин, по-видимому, создает каркас, который обеспечивает удлинение и направленную ориентацию уже инициированных кристаллов (см. рис. 1).
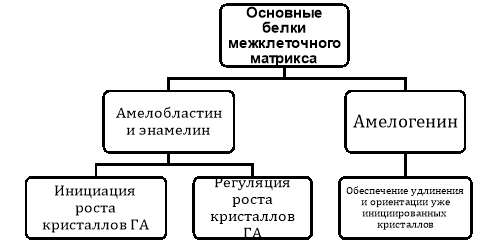
Рис. 1. Назначение белков, участвующих в формировании структуры межклеточного матрикса
Амелогенин сам по себе не может инициировать рост кристаллов или способствовать образованию эмали. Так, при подавлении экспрессии гена энамелина или гена амелобластина не образуется никакой кристаллической структуры. Однако при подавлении экспрессии гена амелогенина образуются кристаллы с хорошо определенной организацией. Кристаллы гораздо меньше и менее хорошо организованы, но они, тем не менее, присутствуют. Поэтому, амелогенин не начинает рост кристаллов, а только определяет их ориентацию в призме. В то же время энамелин и амелобластин и/или продукты их С-концевого расщепления способствуют росту будущих кристаллов. Это имеет смысл, потому что эти белки и/или продукты их С-концевого расщепления присутствуют только на фронте минерализации и отсутствуют в старых, более глубоких слоях эмали.
Таким образом, изучение биоминерализации важно не только для понимания того, как высокоминерализованная эмаль создаётся in vivo . Знание принципов взаимодействия белков в эмали друг с другом и с минеральной фазой, а также их значение в формировании её структуры открывают большие возможности для изучения этиологии врожденных патологий эмали и разработки принципов их лечения.
Литература:
- Биохимия полости рта: Учебное пособие/ О. В. Островский, В. А. Храмов, Т. А. Попова; под ред. проф. О. В. Островского. — Волгоград: Изд-во ВолГМУ, 2010. — 184 с.
- Леонтьев В. К. Эмаль зубов как биокибернетическая система. — М.:ГЭОТАР-Медиа, 2016. — 72 с.
- Cong-Dat Pham, Charles E. Smith, Yuan-Yuan Hu. Endocytosis and enamel formation. Frontiers in physiology, 2017, vol. 8. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5534449/?report=classic
- (Accessed 29 April 2019)
- James P Simmer, Amelia S Richardson, Yuan-Yuan Hu. A post-classical theory of enamel biomineralization and why we need one. International journal of oral science, 2012, vol. 4, pp. 129–134. DOI: 10.1038 / ijos.2012.59
- John D. Bartlett. Dental enamel development: proteinases and their enamel matrix substrates. ISRN Dentistry, 2013. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3789414/?report=classic
- (Accessed 15 April 2019)
- J. Timothy Wright, Yong Li, Cynthia Suggs. The role of amelogenin during enamel crystallite growth and organization in vivo. European journal of oral science, 2011, pp. 65–69. DOI: 10.1111 / j.1600–0722.2011.00883.x
- Karina M. M. Carneiro, Halei Zhai, Li Zhu. Amyloid-like ribbons of amelogenins in enamel mineralization. Scientific reports, 2016, vol. 6. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4806362/ Accessed 29 April 2019)
- Li Zhy, Haichuan Liu, H. Eva Witkowska. Preferential and selective degradation and removal of amelogenin adsorbed on hydroxyapatites by MMP20 and KLK4 in vitro, 2014, vol. 5. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4109566/?report=classic (Accessed 15 April 2019)
- Liam C. Palmer, Christina J. Newcomb, Stuart R. Kaltz. Biomimetic systems for hydroxyapatite mineralization inspired by bone and enamel. Chemistry reviews, 2008, vol. 108, no. 11, pp. 4754–4783. DOI: 10.1021 / cr8004422
- Olivier Duverger, Elia Beniash, Maria I. Morasso. Keratins as a components of the enamel organic matrix. Matrix biology, 2016, vol. 52–54, pp. 260–265. DOI: 10.1016 / j.matbio.2015.12.007
- Pingping He, Yan Zhang, Seong Oh Kim. Ameloblast Differentiation in the Human Developing Tooth: Effects of Extracellular Matrices. Matrix biology, 2010, vol. 29, no. 5, pp. 411–419. DOI: 10.1016 / j.matbio.2010.03.001
- Peter JM Crawford, Michael Aldred, Agnes Bloch-Zupan. Amelogenesis imperfecta. Orphanet Journal of Rare Diseases, 2007, vol. 2, no 17.
- Rodrigo S. Lacruz, Stefan Habelitz, J. Timothy Wright. Dental Enamel Formation and Implications for Oral Health and Disease. Physiological reviews, 2017, vol. 97, no. 3, pp. 939–993. DOI: 10.1152/physrev.00030.2016
- Xiudong Yang, Lijun Wang, Yueling Qin. How Amelogenin Orchestrates the Organization of Hierarchical Elongated Microstructures of Apatite. The journal of physical chemistry, 2010, vol. 114, no. 6, pp. 2293–2300. DOI: 10.1021/jp910219s
- Y.-H. P. Chun, Y. Yamakoshi, F. Yamakoshi. Cleavage site specificity of MMP20 for secretory stage ameloblastin. Journal of dental research, 2010, vol. 8, pp. 785–790. DOI: 10.1177 / 0022034510366903







