В данной статье рассмотрены CAR-T-лимфоциты как инструмент борьбы с опухолями, их создание, результаты лечения, оценка эффективности, побочные эффекты и способы управления ими.
Ключевые слова: иммунитет, опухолевая клетка, CAR-лимфоциты.

Наше тело вовлечено в бесконечную битву. В организме существует 3 линии защиты. Первая — это врожденный, неспецифический иммунитет. Он включает в себя наружные факторы (кожа, слизистые) и внутренние (фагоциты и антимикробные белки). Вторая линия защиты — это адаптивный, специфический иммунный иммунитет. Иммунная система умеет распознавать антигены и выделять в ответ антитела, уничтожая патогенные организмы и токсины. Третья линия защиты начинает свою работу, когда наши кожа и слизистые сделали всё, что могли, а гуморальный иммунитет выработал антитела и всего этого оказалось недостаточно. Теперь пришло время клеточно-опосредованного иммунного ответа. Кроме патогенных организмов иммунный надзор защищает от развития опухоли. Особые белки на мембранах злокачественных клеток действуют на рецепторы Т-лимфоцитов. Лимфоциты в это время активируются и начинают выделять сигналы для других иммунных клеток и токсические вещества, уничтожающие опухолевые клетки.
Однако иногда случается, что иммунитет недостаточно силён, и тогда опухолевые клетки маскируют свои антигены, которые делают их недоступными для иммунитета. Кроме того, злокачественные клетки обладают способностью выделять вокруг себя иммуносупрессоры, которые блокируют пролиферацию Т-лимфоцитов. После этого, иммунитет неспособен адекватно распознать и уничтожить опухоль и встаёт задача о создании специальных клеток, которые будут прицельно опознавать и атаковать злокачественные клетки и вирусы. Этим занимается адоптивная иммунотерапия.
Существует несколько видов клеток, которые применяют в таком типе лечения: LAG-клетки (лимфокин-активированные киллеры); СIK-клетки (цитокин-индцуцирующие киллеры); TIL-клетки (лимцофиты, инфильтрирующие опухоль) и CAR-T-Лимфоциты (лимфоциты с химерными рецепторами).
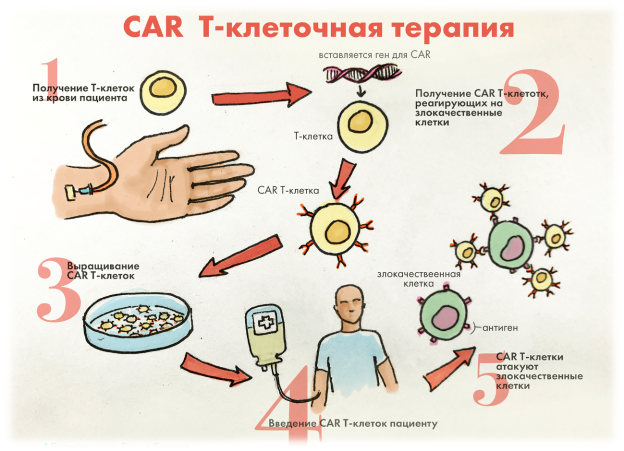
Поговорим подробнее о CAR-T-лимфоцитах. В 1989 году израильский иммунолог Зелиг Эшхар создал первый в истории химерный рецептор на Т-лимфоцитах, получивших название CAR-T- лимфоциты с усиленным противораковым действием. Их получают из крови пациента. Разработкой этих рецепторов сегодня занимаются две американские фармацевтические компании Novartis и Kite Pharma. С помощью электропорации (создание пор в бислойной липидной мембране под действием электрического поля) в Т-лимфоциты встраивается генетическая конструкция — химерный антигенный рецептор. он представляет собой конгломерат белков. Одна из его частей — домены тяжелой и лёгкой цепи иммуноглобулинов(scFv), которые связываются с цитоплазмой с помощью цепей и трансмембранных доменов, распознает раковую клетку и связывается с ней, а другая часть отвечает за активацию и регуляцию механизмов, направленных на уничтожение опухолевой клетки. Кроме того, гены, кодирующие scFv получены из В-клеток, а они в свою очередь продуцируют антитела, специфичные к опухолевому антигену.
С открытия химерных рецепторов прошло более 30 лет, и за это время рецепторы получили изменения. В CAR-лимфоциты второго поколения внесли дополнительный сигнальный домен, который улучшил активацию T-клеток и их распространение. В CAR-лимфоциты третьего поколения добавили еще один сигнальный домен. Все эти модификации способствовали улучшению «выслеживания» опухолевых клеток, а также снижению побочных эффектов. [1] Kite Pharma ведет переговоры с шанхайским фармацевтическим концерном Focus Pharmaceutical. Планируется использование данного препарата для лечения лимфомы Ходжкина и солидных опухолей.
Процесс создания CAR-T-Лимфоцитов можно разложить по пунктам:
– Сбор лейкоцитов с помощью лейкофереза;
– Разделение клеток;
– Разделение Т-клеток на популяции (CD4, CD8,CD25);
– Создание плазмиды из лентивирусного вектора;
– Создание смеси: плазмиды (с СD19)+глутамин+вектор, кодирующий оболочки вируса+бутиратнатрия;
– Фильтрация смеси;
– Вирусная трансдукция Т-клеток (перенос генетической информации между клетками);
– Инкубационный период 72 часа; В это время Т-клетки модифицируются и создают химерные рецепторы на своей поверхности;
– Введение Т-клеток обратно пациенту.
Первые испытания были проведены в 2012 году с девочкой Эмили, болеющей лимфобластной лейкемией. После того, как ей были введены CAR-T-Лимфоциты, состояние стало резко ухудшаться, но в конечном счёте девочка поправилась и уже три года в её организме врачи не находят даже единичных раковых клеток. [2]
В 2016 году проводилось исследование влияния терапии CAR-лимфоцитов на пациентов с множественной миеломой. В эксперименте приняли участие 12 больных. Среди 8 пациентов, получавших самые низкие дозы, наблюдалась ограниченная антимиеломная активность и умеренная токсичность. 1 пациент добился полной ремиссии. 3 пациента получали высокие дозы, результатом чего стала частичная ремиссия. [3]
В 2017 году было проведено лечение CAR-лимфоцитами 22 пациентов с прогрессирующей стадией лимфомы после низкодозированной химиотерапии. Больные получали однократную дозу CAR-клеток. Общая частота ремиссии составила 73 %. Полных 55 % и 18 % частичных. 55 % имели 3 и 4 степени неврологической токсичности, которые полностью разрешились. Ранее проведенная низкодозированная химиотерапии истощила уровень лимфоцитов в крови и повысила уровень сывороточного интерлейкина-15. После проведенного лечения CAR-лимфоцитами наблюдалось повышение уровня лимфоцитов и IL-15. [4]
Побочные эффекты. Многие пациенты, после введения лимфоцитов, страдают от цитокинового шторма, который вызывает множество побочных эффектов. Чрезмерная иммунная реакция клинически приводит к лихорадке, спленомегалии, гепатомегалии, лимфоаденопатии, коагулопатии, цитопении, неврологическим симптомам. Необходима система контроля введенных Т-клеток».
Контроль. Так как терапия имеет множество побочных эффектов, ученые задумались о создании «пульта управления». Ученые Швейцарии и Кореи в 2020 году создали выключающиеся CAR-лимфоциты в виде гетеродимерной трансмембранной молекулы. Первая цепь состоит из антиген-представляющей части и ликерного домена снаружи клетки, трансмембранного домена и костимулирующего домена внутри клетки — участка, который отвечает за димеризацию. Вторая часть гетеродимера существует в виде якоря, к которому присоединены еще 3 домена, один из которых является сигнальным и отвечает за активацию CAR-лимфоцита. После получения новых CAR-лимфоцитов било проведено исследование на мышах. Эффективность новых химеры лимфоцитов была сопоставима с лимфоцитами, не имеющих «выключатель». Кроме того, терапия новыми CAR- лимфоцитами не имела выраженных побочных эффектов в виде цитокинового шторма, как при лечении «старыми» CAR-лимфоцитами. [5] Таким образом, правильно дозируя препарат, можно управлять уровнем активности CAR-лимфоцитов, снизить отрицательные последствия синдрома высвобождения цитокинов.
Литература:
- Ярилин А. А. Иммунология. М.: ГЭОТАР-Медиа, 2010. — 752 с.;
- Emily Whitehead Foundation
- T cells expressing an anti–B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma
- Lymphoma Remissions Caused by Anti-CD19 Chimeric Antigen Receptor T Cells Are Associated With High Serum Interleukin-15 Levels
- Greta Giordano-Attianese, et al. // A computationally designed chimeric antigen receptor provides a small-molecule safety switch for T-cell therapy. // Nature Biotechnology, 03 February 2020; DOI: 10.1038/s41587–019–0403–9







