В связи с ухудшающейся экологической обстановкой в мире, человечество остро ощутило всю ценность средств, добытых из натуральных природных источников. Получение экстракта из ежевики (Rubus anatolicus), а также красителей для приготовления гистологических образцов позволяет расширить группы красителей растительного происхождения и упростить способы получения их из сырья с использованием нетоксичных веществ. В результате проведенных экспериментов были разработаны предложения по получению высококачественных красок из растительного сырья с высоким содержанием антоцианов и по приготовлению из них красителей.
В настоящее время имеет важное значение разработка и рациональное использование научных методов получения экологически чистых растительных красок из растений, растущих в Туркменистане, не оказывающих вредного воздействия на организм.
Ключевые слова : растение, ежевика, краски, красители, экстракт, ежевика, антоцианы, морфологические красители.
Важно всесторонне изучить особенности выращиваемой в Туркменистане ежевики (Rubus anatolicus), которая широко используется в качестве экологически чистого сырья, не оказывая вредного воздействия на организм, и широко применяется в народной медицине для лечения и питания [1].
Во флоре Туркменистана насчитывается около трех сотен видов красильных растений. Синтетические краски были созданы всего 150 лет назад, в то время как наши предки испокон веков окрашивали шёлк и шерсть природными красителями, получаемыми в основном из растений. Например, из цветков зверобоя продырявленного получали цветовую гамму — темно-фиолетовую и темно-красную, которую придавали материалу такие вещества, как гиперицин и псевдогиперицин. Ализарин, извлекаемый из корней марены красильной, имеет свойство окрашивать ткани в ярко-красный цвет. Дубильное вещество — танин, содержащееся в кожуре граната обыкновенного, дает возможность получить коричневый краситель. Распространенные растительные природные соединения флавоноиды предоставляют целый спектр цветов — красный, фиолетовый, синий и черный. Содержащиеся в листьях и стеблях растений хлорофиллы являются источником зеленой, а каротиноиды из цветков — красной, желтой и фиолетовой окрасок. Кроме марены красильной, наличие красящих веществ присуще многим представителям флоры Туркменистана. Краски, полученные из кожуры грецкого ореха, окрашивают шерсть и шелк в тона от песочного до черного. Красящие вещества листьев эремуруса придают шелку бледно-красный или оливково-медовый цвета, его цветки — серо-желтый, стебель — ореховый, а корни — медовый цвет. Ревень туркестанский — источник розового, кремового, сиреневого, черного цветов. Корни барбариса туркменского дают пигменты желтого, золотистого и красно-желтого цветов. Использование солодки позволяет получить желтую, зеленую, коричневую и красную краски. Семена гармалы окрашивают пряжу и ткани в различные оттенки желтого, коричневого, бежевого, а также в розовый и красный цвета. Галлы фисташки содержат пигменты, позволяющие окрашивать шерсть и шелк в малиновый, темно-серый и черный цвета [7].
Имеются данные об использовании в качестве растительного сырья для приготовления гистологических красителей ягод черники, плодов вороньего глаза и покровной чешуи луковиц лука. Все названные красители являются основными и окрашивают ядерные структуры (кариолимфу, хроматин и ядрышко) в фиолетовый (сок черники, плоды вороньего глаза, марены сердцелистной лесной, луносемянника, воронца заострённого) или коричневый (плоды черёмухи Мака, покровная чешуя лука репчатого) цвет. За исключением сока черники и покровной чешуи лука предложенные источники красильных веществ являются несъедобными или даже токсичными [2].
Подавляющее большинство гистологических красителей, используемых для изучения клеток и тканей органов в биологии и медицине, получают на основе химических технологий промышленного производства, сосредоточенного в основном в зарубежных странах. В классификации гистологических красителей отдельно выделена подгруппа красителей растительного происхождения, основным официальным представителем которой является гематоксилин, получаемый из кампешевого дерева, произрастающего в Центральной Америке [6].
Таким образом, несмотря на обилие красящих пигментов растений, имеющих обширный ареал произрастания в России, эта группа гистологических красителей остается малоизученной и несистематизированной.
В предыдущих исследованиях продемонстрированы простые и недорогие методики получения ядерных красителей (для изучения ядер и базофильных структур цитоплазмы клеток) на основе плодов черноплодной рябины, бузины черной, черной смородины и винограда сорта «Изабелла», широко культивируемых в Центрально-Черноземном районе России [3,4,5].
Общим для всех указанных плодов является значительное содержание антоциановых пигментов, имеющих в своей структуре оксониевый кислород, который может образовывать донорно-акцепторные связи с металлом — комплексообразователем протравных солей [8].


Рис. 1. Плоды ежевики
Натуральные краски сохраняют свой цвет десятилетиями и не теряют своих качеств при различных неблагоприятных воздействиях. В связи с этим важно разработать и использовать соответствующие научные методы извлечения красителей из ежевики.
Целью настоящего исследованияявляются способы получения экстракта ежевики (Rubus anatolicus) и получение красителей из растительного сырья, возможности их применения в гистологии.
Материалы и методы . Исследования проводились в лабораторных условиях Государственного медицинского университета Туркменистана имени Мырата Гаррыева и Инженерно-технологического университета Туркменистана имени Огузхана. Плоды ежевики собирали в соответствии с необходимыми правилами, и был проведен следующий эксперимент для приготовления сырья поэтапно. Сырье плодов растения ежевики использовали для получения различных красителей на экспериментах. Для этого в большинстве случаев (50 %) используют этиловый спирт. В 50 мл полученного раствора красителя из ежевики добавили 20 мл калия алюминия и 1 мл водного раствора CH 3 COOH (уксусной кислоты).
В подготовленных образцах сравнительной группы гематоксилин окрашивали основными красителями, а в контрольной группе использовали краситель, полученный из экстракта свежих плодов ежевики. Полученные результаты морфологических исследований отдельных видов тканей и структуры клеток для достоверности проанализированы и обработаны статистически в соответствии с требуемыми правилами.
В результате были использованы все значимые среднестатистические методы. Таким образом, продолжаются соответствующие научные исследования для всестороннего изучения красителей, изготовленных из экстрактов плодов ежевики, которые мы предлагаем впервые, с помощью метода высокочувствительной хроматографии.
Экспериментальная часть . В начале использовались обычные методы морфологического окрашивания, а также красители, полученные путем добавления к предлагаемому нами экстракту ежевики других фиксирующих добавок. Результаты окрашиваний образцов следующие:
Для проведения эксперимента было создано семь групп, в каждой в качестве красителя использовано 0,5 мл экстракта ежевики. 0,5 мл экстракта ежевики в отдельных пробирках маркировали в возрастающей последовательности и помещены в специальный фиксатор, как показано на рисунке 2.


Рис. 2. Препараты, приготовленные с помощью гистологических красителей из экстракта ежевики
- В контрольной группе, эозин-метилен, как функциональное различие для образцов (n = 10), окрашивали стандартными методами по Май-Грюнвальду и фиксировали в растворе аммиака и буферном фосфатном растворе.
Стандарт для приготовления этого раствора: 10 литров раствора можно приготовить, растворив 800 г NaCl, 20 г KCl, 144 г Na 2 HPO 4 и 24 г KH 2 PO 4 в восьми литрах дистиллированной воды, pH полученного раствора должен быть примерно 6,8–7,2. При необходимости кислотный pH можно отрегулировать окружающей средой или гидроксидом натрия и промыть дистиллированной водой, а затем высушить.
- В этойгруппе в стеклянную емкость отобрали 1,0 мл стандартного буферного фосфатного раствора (pH 6,8–7,2) и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и через 5–10 минут образовался светлый красно-коричневый красящий раствор.
- 1,0 мл буферного фосфатного раствора поместили в стеклянный контейнер и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и 0,5 мл раствора этилового (этанолового) спирта C 2 H 6 O и 0,3 мг купороса меди CuSO 4 , а затем встряхивали стеклянный контейнер, через 5–10 минут образовывался черно-синий (чернильный) красящий раствор.
- Буферного фосфатного раствора 1,0 мл поместили в стеклянный контейнер и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и 0,3 мг FeO 2, а затем встряхивали стеклянный контейнер до образования коричневатого (кофейного) красящего раствора.
- Далее 1,0 мл буферного фосфатного раствора поместили в стеклянный контейнер и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и 0,5 мл раствора этилового спирта и 0,3 мг FeSO 4 (железный купорос) и 1,0 мл CH 3 COOH (уксусная кислота). А затем встряхивали стеклянный контейнер до образования темно-синего (синего) красящего раствора.
- Затем 1,0 мл буферного фосфатного раствора поместили в стеклянный контейнер и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и 0,5 мл раствора этилового спирта и 0,5 мг FeSO 4 (железный купорос) и 0,3 мг CH 3 COOH (уксусная кислота), а затем встряхивали стеклянный контейнер до образования светло-красного красящего раствора.
- Впоследнейгруппе 1,0 мл буферного фосфатного раствора помещали в стеклянный контейнер и к нему добавили 0,5 мл предлагаемого нами экстракта ежевики и 0,5 мл раствора этилового спирта и 0,3 мг FeO 2 , 1,0 мл CH 3 COOH (уксусная кислота) и 0,5 мг NaHCO 4 (бикарбонат натрия), а затем встряхивали стеклянный контейнер до образования темного-серого красящего раствора. Для сравнения, образцы I и II группы (n=10) помещают в эозин-метилен синий и раствор Май-Грюнвальда, а также буферный фосфатный раствор и раствор Май-Грюнвальда. Для статистического анализа результатов морфологических и гистологических исследований использовалась программа Microsoft Office Excel.
При морфологическом и гистологическом исследовании препаратов в двух группах можно отметить, что тесты показывают одинаково общие патологические симптомы (изменения ядер, придатков клеток и т. д.). При сравнении результатов морфологических и гистологических исследований с описанными выше красителями, приготовленными из экстрактов ежевики (р <0,001), (р <0,01), (P <0,005), (P ≤0,05) статистическая точность явно отличается по сравнению с группой образцов, приготовленных с использованием существующих красителей. Можно отметить, что достоверность показателей в контрольной группе была нормальной по количеству клеточных входов органелл (р<0,05) и соотношению суммарных патологических изменений 3:1 (группа сравнения: контрольная группа).
Результаты морфологических исследований показали, что при использовании красителя, приготовленного из экстракта ежевики в сочетании с ранее использовавшимися морфологическими красителями, даже в течение относительно короткого времени (30 минут), можно точно определить внутриклеточные изменения и патологические отклонения (можно определить четкие гистоморфологические признаки) по сравнению с контрольной группой. В то же время в результате сочетанного окрашивания, по сравнению с существующими методами, необходимо (обязательно) определить дистрофические образования, например, чтобы отличить патологический процесс от воспаления, а также имеет очень большое значение оценка процесса регенерации. Следует также отметить, что ранее приходилось использовать краски Судан III и Шарлах красного цвета, чтобы увидеть жировые ткани, но предлагаемые нами красители окрашивают все жиры и липиды от светло-оранжевого до желтого, что очень важно для точной идентификации различных патологических процессов.
В связи с этим, тот факт, что краситель, представленный в основной группе, превосходит образцы, приготовленные из существующих красок, очень впечатляет и, как обычно, не требует лишних затрат и дополнительного времени. Это еще раз свидетельствует об их важности по сравнению с ранее существующими красителями.
Гистоморфометрические сравнения различных красителей из экстракта ежевики с существующими методами показаны в таблице.
Таблица 1
Гистоморфометрическое сравнение различных красителей, изготовленных из экстракта ежевики, с существующими методами: патологические явления (n-10)
|
№ |
Экстракт ежевики и др. Красители |
Контрольная группа |
Основная группа |
p- показатель |
|
1. |
Эозин-метилен и раствор Май-Грюнвальда |
3,2± 1,2 |
3,6± 1,5 |
P<0,001 |
|
2. |
Буферный фосфатный раствор и раствор Май-Грюнвальда |
5,4±1,1 |
3,8±1,2 |
P<0,005 |
|
3. |
Буферный фосфатный раствор, измельченный экстракт, медный купорос. |
3,6±1,05 |
6,6±1,8 |
P<0,05 |
|
4. |
Буферный фосфатный раствор и предлагаемый на нем измельченный экстракт и FeO 2 |
3,2±0,8 |
4,3±0,7 |
P<0,01 |
|
5. |
Буферный фосфатный раствор и измельченный экстракт, спиртовой раствор, FeO 2 и уксусная кислота. |
3,3±1,4 |
5,1±1,4 |
P<0,05 |
|
6. |
Буферный фосфатный раствор, измельченный экстракт, спиртовой раствор, FeO 2 и уксусная кислота. |
3,8±1,9 |
5,6±0,49 |
P<0,01 |
|
7. |
Буферный фосфатный раствор, неочищенный экстракт, спиртовой раствор, FeO 2 и уксусная кислота, и бикарбонат натрия |
1,18±0,26 |
1,09±0,25 |
P<0,01 |
* р<0,001 **р<0,01; ***P<0,005; ****(P≤0,05); — с контрольной группой
Сравнение гистоморфометрически концентрированной дифференциации поля различными методами различных красителей из ежевики экстракта. Поместили 100 г свежесобранных ягод ежевики в специальные фильтровальные тканевые пакеты, а подготовленные пакеты поместили в 50–50-кратном растворе этилового спирта в очень распространенном и широко применяемом технологическом методе экстракции. В течение 3 часов мы экспериментировали с фильтрацией кипячением. Порядок проведения эксперимента показан на рисунке 3.
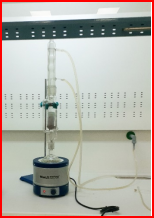


Рис. 3. Извлечение экстракта из плодов ежевики
В итоге 400 мл 50 % раствора этилового спирта из сырья 70 г спелых плодов, с гладким темно-красным блеском, образовалась жидкость. Экстракт выдерживали до появления более густого раствора. Высокое содержание активного пигмента, как показано выше, в экстракте из свежих плодов ежевики, позволяет использовать это средство в будущем как новую форму красителей в лечебных и биологических целях.
Проблема научного исследования. Эта работа позволит расширить группы красителей, получаемых из растений, упростить способы получения различных красителей из сырья с использованием нетоксичных веществ. Результаты экспериментов показывают, что экологически и экономически более целесообразно получать высококачественные красители из растительного сырья, содержащего большое количество антоцианов, и широко использовать их в качестве красителей, используемых для изготовления морфологических образцов в прикладной медицине и биологии.
Разработан новый метод извлечения ягод из плодов ежевики. Его также сравнивали с предыдущими методами для первого экстракта плодов ежевики путем окрашивания и экстракции крупномасштабного красителя при взаимодействии с различными химическими веществами. Полученный продукт сушили и экстрагировали 50 % этиловым спиртом в соотношении 1:10 в течение 3 часов путём фильтрации.
В современных требованиях стандартизации систематическая цепочка использования показателей качества ресурсов «Сырье из лекарственных растений» объективно обоснована и позволяет разработать характеристики показателей качества. Важной задачей является полное изучение химического состава сырья ягод ежевики и получение и приготовление подходящих средств с соответствующих подстанций.
Результаты и обсуждение. Впоследние годы ряд авторов предложили несколько методов для многогранного изучения растений и разработки новых фитохимических препаратов. При анализе представленных данных необходимо точно определить качество и зрелость растений при получении высококачественного сырья.
Ссылаясь на правила сбора и приготовления лекарственных растений в источниках, период подготовки лекарственного растения можно рассматривать как время подготовки плодов в период цветения, то есть время отбора сырья. Это включает интегрированную и измельченную форму фрукта «Внешнее описание сырья».
Многие исследования показали тот факт, что в период плодоношения биологически активные вещества растений различаются. Если изучить сырье плодов предварительно собранного растения, можно отметить, что высокоактивных веществ, содержащихся в нем, очень мало или они полностью отсутствуют. Для того, чтобы выбрать сырье для приготовления экстракта, необходимо доработать раздел «Микроскопия», чтобы выявить какие-либо нарушения его правил. В результате 50 % экстракции 100 г этилового спирта из сырья плодов ежевики было получено 7 г чистого экстракта. Эта цифра эквивалентна соотношению 1:10, что подтверждает наличие огромного производственного потенциала.
Выводы
В эксперименте определена высокая продуктивность плодов ежевики. Использование красителей, приготовленных из экстракта ежевики, идентично с ранее существовавшими методами. Морфологический анализ подчеркивает более точное определение патологических изменений на клеточном уровне и за его пределами. Предлагаемый выше метод получения экстракта растения ежевики и приготовления из него красителей можно применять не только в морфологической лаборатории, но и в пищевой, косметической и фармацевтической промышленности .
Литература:
1. Berdimuhamedow Gurbanguly «Türkmenistanyň dermanlyk ösümlikleri», Aşgabat, I — tom, 2009ý.
2. Ишунина Т. А., Барабанщикова Т. Н., Сгонникова А. О. //Морфологические ведомости 2014// 2014. -N 1. с.112–114.
3. Ишунина Т. А. Гистологические красители на основе экстрактов ягод винограда и черной смородины // Морфологические ведомости. 2015. № 4. с. 65–68.
4. Ишунина Т. А. Разработка технологии приготовления красителей для гистологических целей на основе экстрактов растений // Структура и физико-химические свойства целлюлоз и нано композитов на их основе. Пет-разводок, 2016. с. 111–115.
5. Ишунина Т. А., Солоненко О. В. Гистологический краситель на основе антоцианов ягод черноплодной рябины (Aronia melanocarpa) //Морфологические ведомости. 2014. № 4. с. 58–61.
6. Коржевский Д. Э. Применение гематоксилина в гистологической технике // Морфология. 2007. Т. 132. № 6. с. 77–82.
7. Растения — натуральные красители 252 /Константин Головкин, Институт лекарственных растений АН Туркменистана, фото автора /12.06.2012 / Наука.
8. Horbowicz M., Kossan R., Grzesiuk A., Debski H. Anthocyanin’s of fruits and vegetables — their occurrence, analysis and role in human nutrition // Veg Crops Res Bull. 2008. Vol. 68. Pp. 5–22.







