В статье описывается разработанная и апробированная на основе проведенных исследований методика по изучению углеводного состава растения Горец птичий (спорыш) (Polygonum aviculare L.).
Произведено разделение гидролизата гликонов в Горце птичьем в виде летучих производных и определен его компонентный состав.
Ключевые слова: углеводы, экстракт горца птичьего, гликозиды, агликон, гликон, метод дериватизации.
Углеводы и их производные являются прерогативой мира растений, входят в состав всех растительных (около 80 %) и животных (около 20 %) организмов и по массе составляют основную часть органического вещества на Земле. Образуются они благодаря ассимиляции хлорофилла в пластидах в процессе фотосинтеза под действием квантов солнечной энергии из углекислого газа, воды, минеральных солей. Многообразие свойств близких по химическому строению соединений — следствие различий в стерео структуре макромолекул углеводов [2, 3, 4, 10, 11, 15].
Эти вещества выполняют важнейшую функцию — обеспечение живых организмов энергией. Углеводы входят в состав структурирующих элементов клеток, эластиков, смазок, информационных систем, регулируют процессы иммунитета высших организмов. Моносахариды рибоза и дезоксирибоза в качестве структурного фрагмента входят в состав полиэфирных цепей нуклеиновых кислот РНК и ДНК, которые в каждой клетке живого организма ведут биосинтез разнообразных белковых тел и являются носителями всей жизненной информации, наследственных признаков [2; 3; 4; 10; 11].
Человечеству жизненно необходимо изучать среду своего обитания. С этой целью, усилия многих исследователей направлены на изучение состава живой материи и в частности углеводов (гликозидов), которые играют первостепенное биохимическое значение в живой природе, и в жизни человека. Лечебные свойства растений обусловлены наличием в их составе разнообразных групп химических соединений: алкалоидов, гликозидов, углеводов, сапонинов, дубильных веществ, горечей, слизей, смол, жиров, белков, эфирных масел, красящих веществ, ферментов, микроэлементов, витаминов, фитонцидов и т. д.
Наибольшей биологической активностью обладают производные углеводов (моносахаридов, олигосахаридов, полисахаридов) — гликозиды флавоноидов (полифенолов). Молекулы гликозидов состоят из сахарной части, называемой гликоном и несахарной — агликона, связанных через атомы углерода, кислорода, серы или азота. Чаще всего — это кислород.
По строению сахарной — гликоновой части, гликозиды подразделяются на пиранозиды (шестичленное кольцо) и фуранозоиды (пятичленное кольцо); α– и β- гликозиды, а также на пентазиды, гаксозиды, биозиды. Причем, в качестве cахаров в пиранозной форме встречаются D-глюкоза, D-галактоза, D-ксилоза, L-рамноза и L-арабиноза, может присоединяться также одна D-глюкуровая кислота, а в фуранозной форме — арабиноза. Сахара в флавоноидах, как правило, соединены β-связью с фенольными гидроксилами агликона [2; 6; 8; 9; 10; 11; 13; 15; 17].
Наибольшее разнообразие глизидов обусловлено строением агликона. В зависимости от химической природы агликона гликозиды разделяются на 6 групп:
1) сердечные гликозиды (агликон–производное циклопентано-пергидрофенантрена);
2) сапонины (агликоны–соединения стероидной и тритерпеновой природы);
3) антрагликозиды (агликоны–производные антрацена различной степени окисленности);
4) иридоиды — горькие гликозиды (агликоны — производные циклических монотерпенов);
5) цианогенные гликозиды (агликоны — соединения, содержащие циановодородную кислоту в связанном состоянии);
6) тиогликозиды — серосодержащие (агликон — анион глюкозинолата).
Первые 5 групп — это О-гликозиды, 6-я группа — S-гликозиды; C–гликозиды относятся к классу флавоноидов; N–гликозиды усложненного строения — это некоторые антибиотики (например, стрептомицин) [5; 6].
Растение Горец птичий (спорыш) (Polygonum aviculare L.) (Стандартизован ГФ ХI, вып. 2, ст. 56 и Изменение № 1). Применяется в качестве кровоостанавливающего, а также диуретического и способствующего отхождению мочевых конкрементов средства. Спорыш оказывает вяжущее и мочегонное, противовоспалительное и антимикробное действие за счет дубильных веществ. Повышает скорость свертывания крови, не изменяя вязкости крови [6; 8; 9;13].
Из научной информации о химическом составе, полученной на основе методов анализа (качественных химических реакций, фотоколориметрии, УФ-спектроскопии, тонкослойной хроматографии, титрометрии) установлено, что в траве спорыша содержатся флавоноиды 0,2–1 % (авикулярин, гиперозид, кверцетин, кверцитрин, изорамнетин, кемпферол); дубильные вещества (1,8–4,8 %); кислота аскорбиновая (в три раза больше, чем у лимона) до 900 мг %; каротиноиды (39 мг %); катехины, кремниевая и фенолкарбоновые кислоты (кофейная, галловая, п-кумаровая, хлорогеновая), антрахиноны, кумарины, эфирные масла, слизи, Е [8; 13].
Однако до настоящего времени не исследована углеводная составляющая (гликоны) биологически активных гликозидов. Анализ углеводов представляет сложность по причине присутствия их в сложной биологической матрице с трудно отделяющими сопутствующими примесями других органических соединений различных классов. Поэтому для исследования углеводов приемлемы только методы, основанные на разделении (тонкослойная хроматография). Однако, методы тонкослойной хроматографии являлись недостаточно воспроизводимы (неточными) и эффективны для разделения углеводов и тем более оптически активных изомеров углеводов. Применение методов газожидкостной хроматографии (ГЖХ) для прямого изучения соединений (сахаров) затруднено по причине, что сахара по своей природе не летучие соединения с высокими температурами плавления. Работа же газохроматографической системы имеет температурные ограничения до 300-400 0 С. Поэтому принято исследовать углеводы газохроматографическим методом в виде летучих производных соединений после их предварительной дополнительной реакции дериватизации. Однако идентификация производных углеводов методом ГЖХ с пламенно-ионизационным детектором требует наличия большого многообразия дорогостоящих стандартных (эталонных) образцов углеводов и их различных производных. При использовании приборов и методов ГЖХ с масс-спектрометрическим селективным детектором идентификация возможна по базе данных масс–спектров прилагаемых библиотек (около 2600 соединений) к приборам.
Цель работы В связи с вышеизложенным, целью данной работы является исследование компонентного состава углеводной часть (гликон) в молекулах гликозидов экстракта растения Горец птичий ( Polygonum aviculare L .)
Результаты исследования и обсуждения Объектом исследования являлась надземная часть весеннего сбора растения травы Горец птичий (спорыш). При анализе углеводов проведены исследования по оптимизации — условий экстракции, проведения гидролиза, нейтрализации гидролизата, газохроматографического разделения углеводов в зависимости от температуры, скорости газ-носителя, с целью достоверности идентификации. Проба подготовка образцов исследования проводилась в соответствии с методическими рекомендациями, описанными ранее [7; 16; 17; 19; 20; 21; 22; 23] при использовании разных навесок 1–3 грамма растения, измельченного до однородного порошка. Образцы помещали в колбу вместимостью 25 мл с раствором 70 % этанола при модуле 1:5 (навеска: растворитель). Экстракцию проводили на водяной бане с обратным холодильником в течение 1 часа. Экстракт фильтровали через бумажный фильтр и экстрагировали неполярными растворителями с целью удаления гидрофобных сопутствующих примесей и экстракт упаривали. Далее сухой экстракт помещали в колбу и добавляли 15мл 2н. раствора серной кислоты и подвергали гидролизу на водяной бане в течение 3 часов. После охлаждения полученный гидролизат нейтрализовали щелочью и упаривали при температуре 40°С. Затем, с целью получения летучих производных углеводов, аликвоту нейтрального гидролизата, подвергали методу дериватизации (ацетилирование, силилирование) по схеме [20; 21]:
ROH + (CH3CO)2O ® R-O-CO-CH3 + CH3COOH
ROH + (CF3CO)2O ® R-O-CO-CF3 + CF3COOH
ROH + Cl-SiMe3 ® R-O-SiMe3 + HCl
2ROH + Me3 Si-N= N-SiMe3 ® 2(R-O-SiMe3) + N2
Аналитическим инструментом, являлся газовый хроматограф 6890 с масс-спектрометрическим квадрупольным детектором 5975VL (Agilent Technologies), настроенным на возбуждение электронным ударом (70 эв). Режим сканирования (SCAN), диапазон регистрируемых ионов составлял 50–550 m/z, также применяли режим регистрации.
Разделение проводили на капиллярной колонке (слабополярная, 5 % фенилметилсилоксан) HP 5MS 30м х 0,2мм в различных условиях программирования температуры в зависимости от природы сложной извлекаемой многокомпонентной биологической растительной матрицы, содержащей разделяемые углеводы с сопутствующими примесями (например, режим программируемой температуры термостата: изотермическая выдержка 1–3 мин при 80° С, затем нагревали со скоростью 6°/мин — 15°/мин до 280°С). Температуры инжектора и устройства сопряжения хроматографа с детектором составляли 270° С и 290° С соответственно. В качестве газ-носителя применяли гелий при расходе 1 мл/мин. Инжектор настраивали на ввод пробы со сброса (split) 1:50. Объем вводимой пробы 1–3мкл. Предел определения компонентов смеси в среднем составлял нанограммы, пикограммы (10 -9–10 -12 гр.).
Для обработки хроматограмм и масс-спектров использовали систему AMDIS (NIST) с целью автоматической идентификации разделяемых производных компонентов смеси гидролизата проб, после их предварительного ацетилирования и силилирования. Два способа дериватизации были использованы так же для сравнения получаемых масс- спектров производных углеводов, с целью повышения достоверности идентификации углеводов и других соединений, особенно, в случаях наложения сигналов целевых соединений с сопутствующими примесями, и когда автоматическая идентификация прибора по базе данных библиотек масс — спектров давала вероятность идентификации менее 50 %.
Результаты и обсуждение: результаты характерного (из пяти параллельных проб) газо-хроматографического разделения в разных условиях для ацетилированных и силилированных производных c результатами их идентификации по масс- спектрам представлены на рис.1 и 2. Было проведено 18 анализов в разделении оптимизации проб подготовки. Видно, что при оптимизированных условиях (температура, селективность колонки (НЖФ), природы и скорости газ-носителя, достигнуто разделение основных углеводов. Разделяемые соединения воспроизводимо элюируют в виде симметричных сигналов пиков, что свидетельствует об отсутствии адсорбции разделяемых соединений на межфазных границах газ-жидкая фаза-твердое тело (внутренняя поверхность капилляра). Поэтому, сигналы пиков могут быть использованы для достоверной идентификации углеводов.
На стадии пробы подготовки, полученные экстракты спорыша подвергали дериватизации (ацитилирование и силилирование) без предварительного гидролиза. Результаты показали, что в экстрактах отсутствуют свободные моносахариды и какие-либо другие соединения. Углеводы в растении спорыш представлены в виде высокомолекулярных, нелетучих полисахаридов или полиоз связанных с агликонами.
Из результатов хроматограмм (рис. 1, 2) видно, что основные анализируемые силилированные производные соединения смеси элюируют в основном до 17 минут (рис.1), в то время, как время элюирования ацетилированных производных соединений приходится на 2–18 минут. Это объясняется повышенной летучестью простых и сложных О-триметилсилилованных эфиров углеводов, за счет полного замещения гидроксильной группы на силильную группу при их силлилировании по сравнению с ацетилированными производными (рис.2), где образуются сложные ацетилированные эфиры углеводов за счет реакции этерификации соединения ацетильной группы через группы кислород гидроксильной группы углевода.
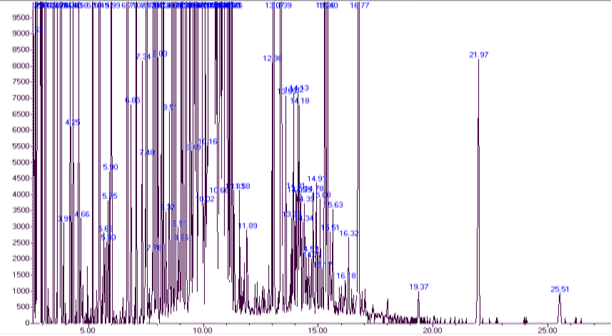
Рис. 1. Хроматограмма разделения силилированных производных соединений после кислотного гидролиза экстракта растения Горец птичий (Polygonum aviculare L.)
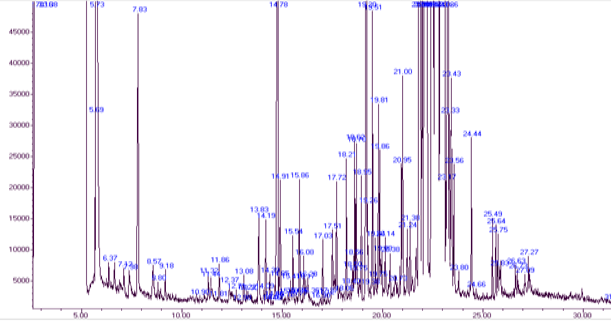
Рис. 2. Хроматограмма разделения ацетилированных производных соединений после кислотного гидролиза экстракта растения Горец птичий (Polygonum aviculare L.)
В таблице 1 приведены сравнительные результаты идентификации для ацетилированных и силилированных производных углеводов, полученных при разных условиях хроматографирования. Результаты показали, что в полученных образцах, моносахариды (углеводы) закономерно имеют общую формулу Cn(H2O)m, представлены в виде открытой и циклической таутомерных формах. Из таблицы 1 видно, что среди определяемых моносахаридов имеются альдозы и кетозы, например, глюкоза и фруктоза соответственно. Глюкоза (гексоза) — конечный продукт гидролиза дисахаридов и полисахаридов. Циклические формы образуются в результате внутримолекулярного взаимодействия альдегидной (кетонной) группировки с одним гидроксидом в молекуле. Более устойчивыми являются шести- и пятичленные циклы, называемые соответственно пироназными и фуранозными циклами. Образование цикла происходит, как отмечалось ранее за счет присоединения атома водорода гидроксильной группы к атому кислорода альдегидной группировки за счет разрыва π- связи. При этом образуется полуацетальный (гликозидный) гидроксид. При такой циклизации в молекуле моносахарида образуется дополнительный асимметричный атом углерода. По расположению полуацетального гидроксила все образующиеся циклы отличаются друг от друга так называемыми α -, β — аномерами моносахаридов [12].
Из таблицы 1 видно, что при получении силилированных производных образуется более богатая смесь (большее число сигналов — пиков) производных углеводов. При этом, в данных условиях хроматографирования, достигнуто разделение как D-, L-изомеров моносахаридов (табл.1, № 2 L-(-)-Arabitol, D-(+)-Arabitol), так и аномеров (№ 1.alpha.-D-Allopyranose,.beta.-D-Allopyranose).
Кроме того, в таблице 1 выявлено, что при силилировании № 1 для D-Altrose,.beta.-D-Allopyranose, alpha.-D-Allopyranose, D-Allofuranose, № 3 для D-(+)-Cellobiose, № 12 для D-Psicofuranose (isomer 1) и D-Psicofuranose (isomer 2), № 15 D-(-)-Tagatofuranose (isomer1), № 16 L-(+)-Threose, № 17 D-Xylose эквивалентные углеводы ацетилированных производных отсутствуют. В то время, как для ацетилированных производных углеводов № 5 Methyl tetraacetyl-.beta.-D-galactopyranoside, Galactopyranoside, 2,3,4,6-tetra-O-acetyl-1-O-octyl-, beta.-l-Galactopyranosyl azide, -deoxy-2,3,4-triacetate,2-Deoxy-galactopyranose, tetrakis (trimethylsilyl), № 6 Glucose propylglycoside tetraacetate, № 7 Ethyl tetra-O-acetyl-.beta.-D-glucopyranoside,1-O-(tert-Butyl)-2,3,4,6-tetra-O-acetyl-,.alpha.-d-glucopyranoside, Methyl 2,3,4,6-tetra-O-acetyl-.alpha.-D-glucopyranoside, № 9 Methyl 2,3,4-tri-O-acetyl-.alpha.- D-xylopyranoside, № 9. Methyl 2,3,4-tri-O-acetyl-.alpha.- D-xylopyranoside, № 11 Muco-Inositol, hexaacetate, Allo-Inositol, hexaacetate, № 14.alpha.-l-Sorbopyranose tetraacetate № 18 Methyl 2,3,4-tri-O-acetyl-.alpha.- D-xylopyrano side отсутствуют силилированные производные.
Видно, что при разных способах дериватизации получаются не эквивалентные производные углеводов. Причем для идентификации, как видно из таблицы 1, наиболее приемлемы силилированные производные. Это обусловлено, по- видимому тем, что при использовании ацетилирования на процесс реакции сказывается кислотность уксусной кислоты, поэтому число получаемых производных меньше по сравнению с использованием в качестве дериватов силанов. При использовании силанов реакция происходит в более нейтральных условиях.
Однако, по нашему мнению, для более полного изучения углеводного состава необходимо применять оба способа дериватизации, поскольку они дополняют друг друга. Из табл.1 видно, что для некоторых углеводов более приемлемы условия ацетилирования, а для других силилирования.
При исследовании углеводов — гликонов достигнуто разделение и идентифицированы классы других производных соединений фенолы, кислоты, стерины, углеводороды. Интерпретация и результаты анализа планируется опубликовать в последующих статьях.
Таблица 1
Сравнительное исследование идентификации по масс-спектрам ацетилированных и силилированных производных углеводов после гидролиза экстракта спорыша. При идентификации использованы 5 параллельных измерений с выбранной статистической вероятностью производных углеводов 70–97 %
|
№ |
Силилированные производные |
Ацетилированные производные |
|
1 |
D-Altrose, 2,3,4,5,6-pentakis-O-trimethylsilyl) - D-Allofuranose, pentakis(trimethylsilyl)ether .alpha.-D-Allopyranose, pentakis(trimethylsilyl) ether .beta.-D-Allopyranose, pentakis(trimethylsilyl) ether |
|
|
2 |
D-Arabinose, tetrakis (trimethylsilyl)- L-(-)-Arabitol, pentakis (trimethylsilyl) ether D-(+)-Arabitol, pentakis (trimethylsilyl) ether Arabinofuranose, 1,2,3,5-tetrakis- O-(trimethylsilyl)- alpha.-DL-Arabinofuranoside, methyl 2,3,5-tris-O-(trimethylsilyl)- .beta.-L-Arabinopyranose, 1,2,3,4- tetrakis-O-(trimethylsilo)- |
1-Nitro-.beta.-d-arabinofuranose, tetraacetate |
|
3 |
D-(+)-Cellobiose, octakis(trimethylsilyl) ether, methyloxime (isomer 2) |
|
|
4 |
d-Galactose, 2,3,4,5,6-pentakis-O-(trimethylsilyl)-, o-methyloxyme, (1Z)- D-Galactose, 2,3,4,5,6-pentakis-O- (trimethylsilyl)- |
alpha.-d-Galactose pentaacetate |
|
5 |
D-(+)-Galactopyranose, pentakis(trime thylsilyl) ether (isomer 1) D-(+)-Galactopyranose, pentakis(trimethylsilyl) ether (isomer 2) beta.-D-Galactofuranoside, ethyl 2,3,5,6-tetrakis-O-(trimethylsilyl)- alpha.-L-Galactopyranose, 6-deoxy -1,2,3,4-tetrakis-O-(trimethylsilyl)- .alpha.-D-Galactofuranose, 1,2,3,5,6-pentakis-O-trimethylsilyl)- |
alpha.-d-Galactose pentaacetate beta.-D-Galactofuranose, pentaacetate alpha.-D-Galactopyranose, 2-(acetylamino)-2-deoxy-, 1,3,4,6- tetraacetate Methyl tetraacetyl-.beta.-D-galactopyranoside Galactopyranoside, 2,3,4,6-tetra-O-acetyl-1-O-octyl- beta.-l-Galactopyranosyl azide, -deoxy-2,3,4-triacetate 2-Deoxy-galactopyranose, tetrakis (trimethylsilyl) |
|
6 |
D-(+)-Glucose,pentakis(trimethyls ilyl) ether, trimethylsilyloxime (isomer2) D-Glucose, 2,3,4,5,6-pentakis-O-(trimethylsilyl)- |
D-Glucose, 2,3,4,5,6-pentaacetate Glucose propylglycoside tetraacetate |
|
7 |
.beta.-D-Glucopyranose, 1,2,3,4,6- pentakis-O-(trimethylsilyl)- beta.-D-Glucopyranose, 6-O-methyl -1,2, 3,4-tetrakis-O-(trimethylsilyl)- Glucopyranose, pentakis-O-trimethylsilyl- |
.alpha.-D-Glucopyranose, pentaacetate .beta.-D-Glucopyranose, 1,6-anhydro-, triacetate Ethyl tetra-O-acetyl-.beta.-D-glucopyranoside 1-O-(tert-Butyl)-2,3,4,6-tetra-O-acetyl-.alpha.-d-glucopyranoside Methyl 2,3,4,6-tetra-O-acetyl-.alpha.-D-glucopyranoside |
|
8 |
l-Fucose, tetra-TMS-ether D-(-)-Fructofuranose, pentakis(trimethylsilyl)ether (isomer 1) D-(-)-Fructofuranose, pentakis(trimethylsilyl)ether (isomer2) D-(-)-Fructose, pentakis (trimethylsilyl) ether, benzyloxime (isomer 2) |
.beta.-d-Fructofuranose, 1,3,4-tri -O-acetyl-2,6-anhydro |
|
9 |
D-(-)-Lyxose, tetrakis (trimethyl silyl) ether, trimethylsilyloxime (isomer 1) alpha.-DL-Lyxofuranoside, methyl 2,3,5-tris-O-(trimethylsilyl)- .beta.-DL-Lyxopyranose, 1,2,3,4-tetrakis-O-(trimethylsilyl)- D-(-)-Lyxofuranose, tetrakis(trime thylsilyl) ether Lyxose, tetra-(trimethylsilyl)-ether |
Lyxopyranose, tetraacetate Methyl 2,3,4-tri-O-acetyl-.alpha.- D-xylopyranoside |
|
10 |
Mannose, 6-deoxy-2,3,4,5-tetrakis- O-(trimethylsilyl)-, L- D-(+)-Mannose pentakis(trimethyls ilyl) ether, trimethylsilyloxime (isomer 1) d-Mannose, 2,3,4,5,6-pentakis-O-(trimethylsilyl)-,o-methyloxyme,(1 Z)- .beta.-D-(+)-Mannopyranose, pentakis (trimethylsilyl) ether .alpha.-D- Mannofuranoside,methyl 2,3,5,6-tetrakis-O-(trimethylsilyl)-, beta.-L-Mannofuranose, 6-deoxy-1,2,3,5-tetrakis-O-(trimethylsilyl)- |
.beta.-D-Mannopyranoside, methyl, tetraacetate .alpha.-D-Mannopyranoside, methyl, tetraacetate alpha.-l-Mannopyranose, 6-deoxy-, tetraacetate alpha.-D-Mannopyranoside, methyl, tetraacetate |
|
11 |
Myo-Inositol, 1,2,3,4,5,6-hexakis- O-(trimethylsilyl)- |
Myo-inositol, hexaacetate Muco-Inositol, hexaacetate Allo-Inositol, hexaacetate |
|
12 |
D-Psicofuranose, pentakis(trimethylsilyl) ether (isomer 1) D-Psicofuranose, pentakis(trimethylsilyl) ether (isomer 2) |
|
|
L-(+)-Rhamnopyranose, tetrakis(trimethylsilyl) ether 72 |
Tetraacetyl.beta.-d-rhamnose |
|
|
13 |
D-Ribose, 2,3,4,5-tetrakis-O-(trimethylsilyl)-. D-Ribopyranose, 1,2,3,4-tetrakis-O-(trimethylsilyl)- D-Ribofuranose, 1,2,3,5-tetrakis-O -(trimethylsilyl)- D-(-)-Ribofuranose, tetrakis(trimethylsilyl) ether (isomer 2) D-(-)-Ribofuranose, tetrakis(trimethylsilyl) ether (isomer 1) D-(-)-Ribofuranose, tetrakis(trimethylsilyl) ether (isomer 2) d-Ribose, 2,3,4,5-tetrakis-O-(trimethylsilyl)-,O-methyl oxime .alpha.-D-Ribofuranoside, methyl 2,3,5-tris-O-(trimethylsilyl) |
beta.-D-Ribopyranose, tetraacetat |
|
14 |
L-Sorbose, pentakis (trimethylsilyl) ether, trimethylsilyloxime (isomer 2) L-(-)-Sorbofuranose, pentakis(trimethylsilyl) ether |
.alpha.-l-Sorbopyranose tetraacetate |
|
15 |
D-(-)-Tagatofuranose, pentakis(trimethylsilyl)ether (isomer1) |
|
|
16 |
L-(+)-Threose, tris(trimethylsilyl) ether, benzyloxime (isomer 2) |
|
|
17 |
D-Xylose, tetrakis(trimethylsilyl) Xylulose tetrakis (trimethylsilyl)- |
|
|
18 |
.beta.-D-(+)-Xylopyranose, tetrakis(trimethylsilyl) ether D-Xylopyranose, 1,2,3,4-tetrakis-O-(trimethylsilyl)- .alpha.-D- Xylopyranoside, methyl 2,3,4-tris- O-(trimethylsilyl)-, .alpha.-D-Xylopyranose, 1,2,3,4-tetrakis-O-(trimethylsilyl)- |
Xylopyranose, 3-deoxy-3-fluoro-, triacetate,.beta.-d-2,4,6- Methyl 2,3,4-tri-O-acetyl-.alpha.- D-xylopyrano side |
Заключение На основе оптимизации условий пробаподготовки и хроматографического разделения, разработан метод анализа углеводного состава гликозидов растения Горец птичий (спорыш) (Polygonum aviculare L.). Достигнуто удовлетворительное разделение компонентного состава гидролизата, что позволяет при наличии эталонных смесей моносахаридов проводить калибровку и количественное их определение.
Впервые получены результаты по изучению углеводного состава растения горец птичий (спорыш) (Polygonum aviculare L.), произрастающего на территории Туркменистана.
Литература:
- Бабкин В. А., Остроухова Л. А., Малков Ю. А. и др. Биологически активные экстрактивные вещества из древесины лиственницы. // Химия в интересах устойчивого развития, 2001, № 9. С. 363–367.
- Базарнова Н. Г., Маркин В. И., Калюта Е. В. и др. Химические превращения целлюлозы в составе растительного сырья. // Химия растительного сырья, 2005. № 3. С. 75–84.
- Бердымухамедов, Г. Лекарственные растения Туркменистана, т. I. — А.: Туркменская государственная издательская служба, 2009. — 384 с.
- Бочков А. Ф., Афанасьев В. А., Заинов Г. Е. Углеводы. — М.: Наука, 1980. С. 173.
- Георгиевский В. П., Комисаренко Н. Ф., Дмитрук С. Е. Биологически активные вещества лекарственных растений. — Новосибирск: Наука, Сиб.отд-ние, 1990. С. 333.
- Гришина Е. И., Погодин И. С., Лукша Е. А. Фармакогнозия. — Омск. 2008. С. 482.
- Дренин А. А., Ботиров Э. Х., Туров Ю. П. Новый гликозид изофлавона из trifolium pratense l. // Химия растительного сырья. 2010. № 2. С. 53–56.
- Карпук В. В. Фармакогнозия: учеб.пособие / В. В. Карпук. — Минск.: БГУ, 2011. С. 340
- Коренская И. М., Ивановская Н. П., Измалкова И. Е. Лекарственные растения и растительное сырье, содержащие флавоноиды, кумарины, хромоны. // Воронежский гос. ун-т, 2007. С. 81.
- Кочетков Н. К., Бочков А. Ф., Дмитриев Б. А. и др. Химия углеводов. — М.: Химия, 1967. С. 672.
- Красильникова Л. А., Авсентьева О. А., Жмурко В. В. и др. Биохимия растений. — Ростов н/Д: Феникс — Харьков: Торсинг, 2004. С. 224.
- Кузьменко Н. Е., Еременко В. В., Попков В. А. Краткий курс химии. –М.: Высш. школа, 2002. С. 415.
- Маркарян А. А., Абрамов А. А. Хроматографическое изучение фенольного состава сухого экстракта “нефрофит”. // Вестн. моск. ун-та., сер. 2. Химия. 2003. № 5, C. 44.
- Пецев Н., Коцев Н. Справочник по газовой хроматографии. −М.: Мир, 1987. С. 260.
- Преображенский Н. А., Евстигнеева Р. П. Химия биологически активных природных соединений. — М.: Химия, 1976. С. 456.
- Степаненко Б. Н. Химия и биохимия углеводов (моносахариды). -М.: Химия, 1977. С. 87–93.
- Ahirateki Y., Yokoe I., Noguchi M. Studies on the constituents of Sophora species. // Chem. Pharm. Bull., 1988. №. 36. Р. 2220–2223.
- Blau K., King G. S. Handbook of Derivatives for Chromatography.- London, Philadelphia.: PA. Rheine, 1978, P. 357.
- Hadizadeh F., Khalili N., Hosseinzadeh H. Kaempferol from Saffron Petals. // Iranian Journal of Pharmaceutical Research, 2003, № 4. P. 251–252.
- Mabry T. J., Markham K. R., Thomas M. B. The Systematic Identification of Flavonoids. — New York, 1970. P 354.
- Markham K. R. Techniques of Flavonoid Identification. — London, 1982. P. — 113.
- Naczka M., Shahidi F. Phenolics in cereals, fruits and vegetables: Occurrence,extraction and analysis. // Journal of Pharmaceutical and Biomedical Analysis, 2006. № 41. Р.1523–1542.
- Siqueira Chaves J., Batista Da Costa F. A proposal for the quality control of Tanacetum parthenium (feverfew) and its hydroalcoholic extract. // Chem. Pharm. Bull., 2008. № 5. Р. 1450–1452.







