Одним из важнейших белков играющих важную роль в процессе гломерулярной ультрафильтрации является подоцин. Вместе с некоторыми другими протеинами подоцин участвует в формировании щелевой диафрагмы, которая обеспечивает фильтрацию элементов крови в мочу. Наличие мутаций в гене NPHS2, кодирующий данный белок, приводит к развитию стероидрезистентного нефротического синдрома. Нами была исследована нуклеотидная последовательность гена NPHS2 в российской популяции детей, больных стероидрезистентным нефротическим синдромом.
- Введение.
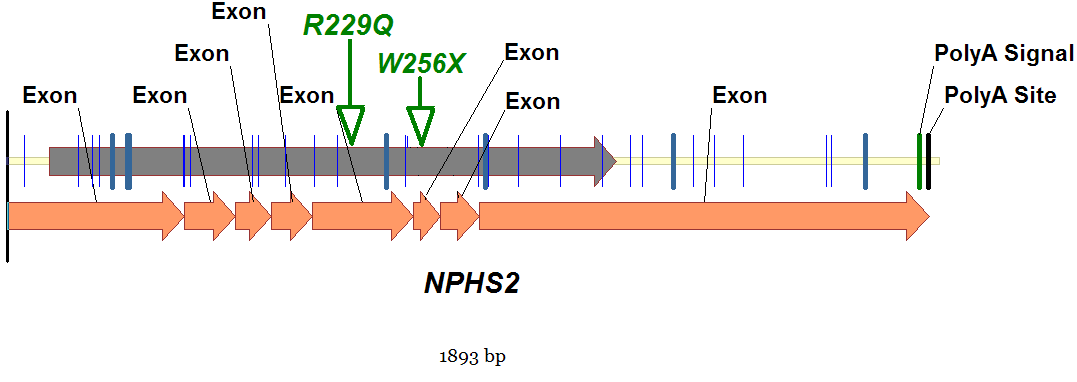
В настоящее время показано [1, 2, 3, 5, 6], что одной из причин развития стероидрезистентного нефротического синдрома является наличие мутаций в гене NPHS2, этот ген ответственен за синтез белка подоцина. Ген NPHS2 состоит из восьми экзонов [3] и находится в единственной копии в положении 1q25-31 на первой хромосоме [6]. В результате транскрипции гена образуется мРНК величиной 1893 оснований (NM_014625.2), существует также и альтернативный сплайсинг для мРНК этого гена [1]. Белок подоцин состоит из 383 аминокислот, имеет молекулярную массу 42 кДа и относится к белкам стоматинового семейства [3, 5]. Последовательность его аминокислот на 46% идентична стоматину человека и на 40% идентична таким белкам как MEC-2 и Unc1 [3]. Подоцин подобно шпильке закрепляет нефрин в гломерулярной мембране, через которую происходит фильтрация крови в первичную мочу [3,5,7]. Таким образом, подоцин, взаимодействуя с такими белками как нефрин и CD2AP, участвует в образовании трансмембранного белкового комплекса [7]. Показано, что определённые мутации и полиморфные варианты гена подоцина могут быть ассоциированы с нарушением проницаемости мембраны в подоцитах, приводящим к появлению протеинурии, липидемии и другим патологическим изменениям фильтрации крови в первичную мочу [5]. Мутации в гене, кодирующем подоцин, могут являться причиной резистентности к терапии стероидами при стероидрезистентном нефротическом синдроме [7]. По данным базы NCBI, мутации в гене NPHS2 обнаруживаются примерно в 50% случаев семейных форм стероидрезистентного нефротического синдрома и в 8-20% - при спорадических случаях (www.ncbi.nlm.nih.gov/omim/600995). В настоящее время в европейской популяции наиболее частым полиморфизмом, ассоциированным со стероидрезистентным нефротическим синдромом, является R138Q (rs74315342). Этот полиморфный маркер впервые был описан Fuchshuber A. с соавторами [14]. Другой известной “точкой” является полиморфный маркер R229Q, впервые идентифицированный Tsukaguchi с соавторами [2].
В настоящий момент известно более 60 полимофизмов и мутаций в гене NPHS2, из них - 10 точечных делеций, 5 точечных инсерций и 4 мутации, затрагивающие сайты сплайсинга (http://www.hgmd.cf.ac.uk/ac/all.php). База данных NCBI содержит 35 полиморфизмов для мРНК подоцина и 377 полиморфизмов и мутаций для гена NPHS2, включая интронную, промоторную и 3’ не кодирующую область. Анализируя спектр полиморфизмов и мутаций в гене NPHS2, можно увидеть, что, в основном, это точечные нуклеотидные замены.
Целью данного исследования был анализ нуклеотидной последовательности экзонной и интронной частей гена NPHS2 в российской выборке больных детей, находящихся на лечении в НЦЗД РАМН, со стероидрезистентным нефротическим синдромом.
- Материалы и методы.
Обследовано 39 детей со стероидрезистентным нефротическим синдромом (девочек 23, мальчиков 16), в возрасте от 1 года до 17 лет, с длительностью заболевания – от 5 мес. до 15 лет. Среди обследованных – 7 детей с инфантильным нефротическим синдромом, 32 – с первичным стероидрезистентным нефротическим синдромом (один больной – семейная форма). Ретроспективное разделение больных, имеющих стероидрезистентный нефротический синдром, осуществлялось (по анамнестическим данным) в соответствии с ответом на стандартный курс стероидной терапии (преднизолон 60 мг/м2/сутки). При неэффективности терапии в течение 6-8 недель определялся стероидрезистентный вариант нефротического синдрома.
Биопсия почки проведена 35 детям. По данным световой и электронной микроскопии, фокально-сегментарный гломерулосклероз (ФСГС) выявлялся в 16 биопсийных образцах, болезнь минимальных изменений (БМИ) – в 15, мезангиопролиферативный гломерулонефрит (МезПГН) – в 2, мембранопролиферативный гломерулонефрит – в 1, мембранозная нефропатия – в 1 случае.
Из 39 детей со стероидрезистентным нефротическим синдромом в активной стадии находились 29 детей, в стадии частичной ремиссии – 3 детей, в стадии полной ремиссии – 7 детей.
Функционально-компенсированная стадия болезни была определена у 30 детей. Хроническая почечная недостаточность III стадии выявлена у 4 детей, IV стадии – у 1, V стадии – у 1 ребенка.
Из 10 детей со стероидрезистентным нефротическим синдромом, достигших полной (n = 7) и частичной ремиссии (n = 3), 9 детей оказались чувствительны к терапии сандиммуном, 1 – к комбинированной терапии (сандиммун + селлсепт). Контрольная группа состояла из 15 человек, не имеющих патологи почек.
Выделение ДНК проводили с помощью наборов Axygen (AxyPrep Multisource Genomic DNA). Качество и количество выделенной ДНК оценивали по данным электрофореза и спектрофотометрических измерений. Для проведения гель-электрофореза использовали TAE буфер, электрофоретическое разделение проводили в 1,3 % агарозном (Fermentas) геле. При проведении ПЦР использовали разработанные нами последовательности олигонуклеотидов, которые приведены в таблице 1. ПЦР проводили в объёме 30 мкл реакционной смеси в амплификаторах Терцик (ДНК-Технология) и DNA Thermal Cycler Engine (BIO-RAD). При постановке ПЦР использовали Taq-полимеразу и буфер для ПЦР фирмы «Силекс». Условия ПЦР были следующими: на первом шаге пробу выдерживали при 94 °С в течение 2 минут, далее 35 раз повторяли 3 этапа (прогрев при 95 °С в течении 20 с., прогрев при соответствующей температуре отжига олигонуклеотидов (Табл. 1) в течении 20 с., на третьем этапе элонгацию цепи проводили при 72 °С в зависимости от величины фрагментов от 30 с. до 1,5 мин). Амплификацию последовательности первого экзона проводили в 2 этапа: на первом этапе нарабатывался фрагмент с внешних пар олигонуклеотидов, после чего использовали один мкл. этой смеси для второго этапа, при котором ПЦР проводили с внутренних пар олигонуклеотидов (Табл. 1). Для очистки полученных фрагментов ДНК от остатков олигонуклеотидов солей и дезоксинуклеотидов использовали элюат из агарозного геля, элюцию из агарозного геля проводили как описано [4]. Количество продукта после элюции оценивали по данным электрофореза. Сиквенсовую реакцию проводили с помощью наборов BigDye® Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems). Очистку продуктов сиквенсовой реакции осуществляли согласно протоколу набора, разгонку продуктов сиквенсовой реакции выполняли на генетическом анализаторе ABI 3130 (Applied Biosystems). При разгонке продуктов сиквенсовой реакции использовали капиллярную сборку длиной 36 см. и полимер POP-7™.
Статистическая обработка данных. Полученные результаты были проанализированы с помощью набора программ Статистика 6.0, а также с использованием калькулятора для расчета статистики в исследованиях "случай-контроль" (http://gen-expert.ru/calculator_or.php). Рассчитывался OR между больными детьми и здоровыми (СI=95%).
- Результаты и обсуждение.
У 39 детей российской популяции со стероидрезистентным нефротическим синдромом была изучена нуклеотидная последовательность в гене NPHS2. В результате исследований, как видно на таблице 2, были выявлены 3 различных нонсенс мутации (S96S, A318A, L346L), 4 замены в интронной области (IVS3+1507C>T, IVS7+7A>G, IVS7+54G>A, IVS7+1078G>C) и 2 различные миссенс мутации (R229Q, W256X).
Из 39 исследованных больных у 34 были выявлены по 2 и более полиморфизмов в гене NPHS2. Обе нуклеотидные замены R229Q и IVS3+1507C>T в гетерозиготном состоянии имели 2 больных. Всего нами было обнаружено 9 различных нуклеотидных замен, из них 5 находились в кодирующей области, 1 в сайте сплайсинга, 3 в интронной области. Также нами были обнаружены 3 новые ранее не описанные нуклеотидные замены, 2 из них находились в интронной области и 1 - в кодирующей.
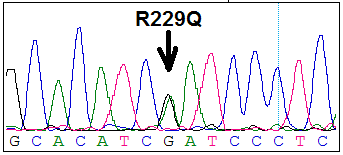
Анализируя полученные данные, мы выявили новую, ранее не описанную нуклеотидную замену (W256X), обрывающую синтез белка. Эта нуклеотидная замена обнаружена у одного больного в гетерозиготном состоянии в шестом экзоне, в положении мРНК 768 G>A. Она приводит к образованию терминирующего опал-кодона (Рис. 1Б) и находится в 256 положении при общей длине белка в 383 аминокислоты и приводит к замене триптофана на стоп – кодон (Рис.2).
Рис. 1. Полиморфный маркер R229Q (А) и нуклеотидная замена W256X (Б) в гетерозиготном состоянии.
Рис. 2. Схема экспрессии гена NPHS2 (белок и мРНК)
Другим изменением, влияющим на последовательность белка, был полиморфный маркер R229Q (rs61747728), приводящий к аминокислотной замене в 229 положении аргинина на глютамин (Рис. 1). Данный полиморфный маркер был выявлен у 10 из 39 больных. В группе больных частота мутантного аллеля (аллель А) полиморфизма R229Q составляла 11%, а в контрольной группе этот полиморфизм не встречался. Большинство авторов говорят об ассоциации этого маркера с резистентностью к терапии при стероидрезистентном нефротическом синдроме [8, 9]. Другие же авторы относятся к нему более осторожно, говоря об аминокислотной замене, но не говорят о её функциональной значимости [11].
В процессе исследования секвенированием были охвачены также интронные области гена NPHS2. В результате работы идентифицированы четыре полиморфизма в интронной области; один из них оказался новым ранее не описанным (IVS3+1507C>T), и три ранее известных полиморфных вариантов (IVS7+7A>G, IVS7+54G>A, IVS7+1078G>C). Частоты их приведены в таблице 2. Для гена NPHS2 не показано наличие регуляторных участков в интронных областях. В этой связи, выявленные в настоящей работе полиморфные маркеры, расположенные «глубоко» в интронной области гена, вряд ли оказывают какой - либо эффект на экспрессию и регуляцию NPHS2 или других генов. Авторы, впервые описавшие полиморфный маркер IVS7+7A>G в российской популяции, на основании результатов компьютерного анализа сайтов сплайсинга пришли к выводу об отсутствии его влияния на экспрессию гена подоцина [13]. Однако, судя по имеющимся данным, мутации в 7 положении интрона относятся к мутациям сайта сплайсинга и, следовательно, могут модифицировать экспрессию гена [12].
Для гена NPHS2 в литературе описано множество полиморфных маркеров и мутаций, ассоциациативно связанных с резистентностью к терапии нефротического синдрома стероидами. Выявленные нами полиморфизмы в основном не влияют на структуру и синтез белка. В то же время не обнаружен часто встречаемый в европейской популяции полиморфный маркер R138Q. Однако, при обследовании больных со стероидрезистентным нефротическим синдромом мы выявили другой полиморфный маркер R229Q. Эта мутация была обнаружена у каждого третьего больного. Мы предполагаем, что это причинная мутация в кодирующей части гена, которая связана с резистентностью нефротического синдрома к терапии стероидами. В европейской популяции эта мутация встречается несколько реже, чем R138Q [3].
Таким образом, в настоящей работе показано, что в выборке детей из российской популяции наиболее частым полиморфным маркером, ассоциированным с стероидрезистентным нефротическим синдромом, является R229Q в гетерозиготном состоянии. Нами также выявлена новая мутация W256X, значение которой может быть выяснено в последующих исследованиях.
Результаты проведенного исследования являются первым шагом к анализу генетической гетерогенности стероидрезистентного нефротического синдрома у детей российской популяции. Мы считаем, что данные о генетической структуре стероидрезистентного нефротического синдрома у детей во многом повысят эффективность диагностики резистентности к этому заболеванию, наметят пути к адекватному лечению резистентных форм этого заболевания, позволят избежать назначения иммуносупрессивной терапии как заведомо неэффективной и наметят пути к поиску адекватного лечения. Однако для окончательного решения вопроса о роли подоцина в механизмах развития стероидрезистентного нефротического синдрома у детей необходимо, наряду с поиском мутаций в гене подоцина, провести у больных, у которых выявлены патологические полиморфизмы в гене NPHS2, иммуногистохимический анализ биоптатов почки с использованием моноклональных антител к подоцину, тем более, что в литературе уже описаны подобные подходы [15].
Таблица 1
Последовательности олигонуклеотидов для проведения «вложенной» ПЦР при амплификации первого экзона, температура отжига и концентрация ионов Mg2++
|
Название |
|
Экзон |
|
|
|
tgcgatgagcttctgtatctccgtcag |
1 |
62 |
0,8 мМ |
|
cttcgtccccaacctgtaccacactc |
|||
|
agacacagctgtcggggttcc |
1 |
58 |
2,5 мМ |
|
cttacgcccttccgttcctg |
|||
|
NPHS2-ex2-F |
ggaccaacagatgctagtcagtg |
2 |
61 |
2,5 мМ |
|
NPHS2-ex2-R |
agaaaacagaagtgagaatgggcatg |
|||
|
NPHS2-ex3-F |
ggccttttgaagactttttctttctgggag |
3 |
60 |
5 мМ |
|
NPHS2-ex3-R |
ggttgaagaaattggcaagtcaggag |
|||
|
NPHS2-ex4-F |
cagaaaggtgaaacccaaacagcc |
4 |
60 |
2,5 мМ |
|
NPHS2-ex4-R |
gagtataaataatcattttgtccacggtagg |
|||
|
NPHS2-ex5-F |
ccacataggaaaggagcccaaga |
5 |
58 |
5 мМ |
|
NPHS2-ex5-R |
ttaataaatgtccaatgaacaaatgaataaaag |
|||
|
NPHS2-ex6-F |
gggtttaggcatgctctcctc |
6 |
62 |
2,5 мМ |
|
NPHS2-ex6-R |
aaaccagaatattttcctttatcatacag |
|||
|
NPHS2-ex7-Fnew |
agaggcttgcaagtctgtgtgaa |
7 |
55 |
2,5 мМ |
|
NPHS2-ex7-R |
cccagtgcctaatgaatggacag |
|||
|
NPHS2-ex8-F |
aacgcattccaccttaaattgtgatta |
8 |
55 |
2,5 мМ |
|
NPHS2-ex8-R |
ctgtcattacatcatttcaccgtcttc |
Таблица 2
Нуклеотидные замены у больных со стероидрезистентным нефротическим синдромом
-
1 Указанный аллель является более частым- Аминокислотные
- замены
- №
- db SNP*
- Номер
- экзона
- Частота мутантного
- аллеля в группах
χ2
Аллель
OR***
- Контрольной
- (n=15)
- Больных
- (n=39)
- Интронная область
- Интронная область
IVS3+1507C>T*
(новая)
-
0
15%
5.19
C1
0.09
T
11.47
IVS7+7A>G**
-
-
0
3%,
1.19
A1
0.35
G
2.83
IVS7+54G>A
rs11808359
-
0
5%
1.60
G1
0.27
A
3.68
IVS7+1078G>C
rs2274624
-
3,3%
7%
0.68
G1
0.41
C
2.42
Экзонная область
R229Q*
rs61747728
5
0
11%
3.78
G1
0.12
A
8.34
W256X
(новая)
6
0
1%
0.39
C1
1.18
T
0.85
S96S
rs3738423
1
3,3%
7%,
0.68
С1
0.41
T
2.42
A318A
rs1410592
8
63,3%
46 %.
0.79
T1
0.68
C
1.48
L346L
rs3818587
8
3,3%.
6%
0.39
A1
0.50
G
1.99
- * Для указанных полиморфных маркеров p< 0,05
- ** Хотя указанный полиморфный маркер описан в литературе, для него отсутствует номер rs.
- ***Значение OR (CI=95%) между группами стероидрезистентных больных и здоровых детей.
- Аминокислотные
- Литература:
- Relle M, Cash H, Brochhausen C, Strand D, Menke J, Galle PR, Schwarting A. “New perspectives on the renal slit diaphragm protein podocin”. //Mod Pathol. 2011, V 24, 1101-1110.
- Tsukaguchi, H., Sudhakar, A., Le, T. C., Nguyen, T., Yao, J., Schwimmer, J. A., Schachter, A. D., Poch, E., Abreu, P. F., Appel, G. B., Pereira, A. B., Kalluri, R., Pollak, M. R. NPHS2 mutations in late-onset focal segmental glomerulosclerosis: R229Q is a common disease-associated allele. //J. Clin. Invest. 2002, V 110, 1659-1666,.
- Franceschini N, North KE, Kopp JB, McKenzie L, Winkler C. “NPHS2 gene, nephrotic syndrome and focal segmental glomerulosclerosis: a HuGE review”. //Genet Med. 2006 V 8, 63-75.
- Корниенко В.Ю., Серегин Ю.А., Пинелис В.Г. “ Методы выделения ДНК из агарозного геля ”. //Вопросы диагностики в педиатрии, 2010. N 4.-С.49-54.
- Löwik MM, Groenen PJ, Levtchenko EN, Monnens LA, van den Heuvel LP. “Molecular genetic analysis of podocyte genes in focal segmental glomerulosclerosis--a review”. Eur J Pediatr. 2009 , V 168, 1291-304.
- Fuchshuber A, Gribouval O, Ronner V, Kroiss S, Karle S, Brandis M, Hildebrandt F. “Clinical and genetic evaluation of familial steroid-responsive nephrotic syndrome in childhood”. //J Am Soc Nephrol. 2001, V 12, 374-378.
- Caridi G, Perfumo F, Ghiggeri GM. “NPHS2 (Podocin) mutations in nephrotic syndrome. Clinical spectrum and fine mechanisms”. //Pediatrics Res. 2005 V 57, 54R-61R.
- Megremis S, Mitsioni A, Mitsioni AG, Fylaktou I, Kitsiou-Tzelli S, Stefanidis CJ, Kanavakis E, Traeger-Synodinos J. “Nucleotide variations in the NPHS2 gene in Greek children with steroid-resistant nephrotic syndrome”. //Genet Test Mol Biomarkers. 2009 V 13, 249-56.
- McKenzie LM, Hendrickson SL, Briggs WA, Dart RA, Korbet SM, Mokrzycki MH, Kimmel PL, Ahuja TS, Berns JS, Simon EE, Smith MC, Trachtman H, Michel DM, Schelling JR, Cho M, Zhou YC, Binns-Roemer E, Kirk GD, Kopp JB, Winkler CA. “NPHS2 variation in sporadic focal segmental glomerulosclerosis”. //J Am Soc Nephrol. 2007 V 11, 2987-2995.
- Ruf RG, Lichtenberger A, Karle SM, Haas JP, Anacleto FE, Schultheiss M, Zalewski I, Imm A, Ruf EM, Mucha B, Bagga A, Neuhaus T, Fuchshuber A, Bakkaloglu A, Hildebrandt F. “Patients with mutations in NPHS2 (podocin) do not respond to standard steroid treatment of nephrotic syndrome”// J Am Soc Nephrol. 2004 V 15, 722-732.
- Berdeli A, Mir S, Yavascan O, Serdaroglu E, Bak M, Aksu N, Oner A, Anarat A, Donmez O, Yildiz N, Sever L, Tabel Y, Dusunsel R, Sonmez F, Cakar N. ”NPHS2 (podicin) mutations in Turkish children with idiopathic nephrotic syndrome”.// Pediatr Nephrol. 2007 V 12, 2031-2040.
- Tazi J, Bakkour N, Stamm S. ” Alternative splicing and disease”. //Biochimica et biophysica acta. 2009 , V 1792, 14-26.
- Полтавец Н. В., Приходина Л. С., Галеева Н. М., Тверская С. М. “Генетические аспекты наследственной формы нефротического синдрома”. //Медицинская генетика : ежемесячный научно-практический журнал. 2006. Том 5, 9 . С. 44-48.
- Fuchshuber A, Jean G, Gribouval O, Gubler MC, Broyer M, Beckmann JS, Niaudet P, Antignac C. “Mapping a gene (SRN1) to chromosome 1q25-q31 in idiopathic nephrotic syndrome confirms a distinct entity of autosomal recessive nephrosis”. //Hum Mol Genet. 1995, V4, 2155-2158.
- Zihua Yu, Jie Ding, Na Guan Yan Shi at al. “A novel mutation of NPHS2 identified in Chinese family”.//Pediatric nephrology. 2004, V 19, 1285-1289.