Введение
Загрязнение окружающей среды, особенно воды, становится все более популярным в глобальном масштабе. Поэтому исследование и обработка токсичных органических веществ в водной среде — важная работа. Существует множество методов обработки их в воде, в которых широко применяется метод полупроводникового фотокатализатора из-за его высокой эффективности [1].
В статье [2], представлены результаты синтеза наноматериалов Zn 1-x Ag x O методом сжигания геля. Исследована фотокаталитическая активность материалов Zn 1-x Ag x O под действием видимого света компактной лампы. Результаты показали, что 2 % Ag, легированный ZnO (Zn 0.98 Ag 0.02 O), обладал самой высокой фотокаталитической активностью для разложения метиленового синего и ализарина красного.
В этой статье мы представляем результаты изучения кинетики фотокаталитического разложения метиленового синего (MC) Zn 0.98 Ag 0.02 O, синтезированного методом сжигания геля, и исследуем факторы, влияющие на каталитическую способность материала.
Э кспериментальная часть
Исследование фотокаталитической способности нанопорошков Zn 0.98 Ag 0.02 O для реакции разложения метиленового синего
Использование Zn 0.98 Ag 0.02 O с массой m (г) для обработки метиленового синего 10 ppm. Регулировали рН раствора 8, помешивая в темноте в течение 30 минут. Эти растворы освещаются непосредственно компактной лампой при постоянном перемешивании в течение 120 минут. Определение содержания метиленового синего в растворе, полученном после центробежной фильтрации, фотометрическим методом при 665 нм.
Эффективность фотокаталитического процесса Н (%) рассчитывали по формуле:
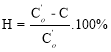
где
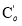
Константа скорости фотокаталитического разложения MC определяется согласно модели Ленгмюра — Хиншелвуда путем построения зависимости ln (C 0 /C) от времени t (C 0 — концентрация MC после достижения адсорбционного равновесия). Из наклона уравнения линейной регрессии выведите k.
Факторы, влияющие на фотокаталитическое разложение MC, были исследованы, включая: содержание материала; начальная концентрация MC и pH среды.
Обсуждение результатов
1. Кинетика фотокаталитического разложения MC материала Zn 0.98 Ag 0.02 O
Добавили 0,1 г материала Zn 0.98 Ag 0.02 O к 100 мл раствора MC с концентрацией 10 ppm (pH = 8). Перемешать в темноте 30 мин, затем осветить компактной лампой мощностью 40 Вт. Через каждые 20 минут аспирировали 1 мл раствора, центрифугировали для удаления материала и фотометрически измеряли, чтобы определить концентрацию MC, остающегося в растворе. График зависимости концентрации MC от времени представлен на рис. 1.
Экспериментальные результаты показали, что в присутствии катализатора Zn 0.98 Ag 0.02 O в видимом свете концентрация МC со временем уменьшалась (рис. 1а). После 120 минут освещения, разлагается около 86 % МC. На рис. 1б показано, что в видимой области максимумы оптической плотности появляются в положениях 650–664 нм, соответствующих n-π * -переходу МC [3].
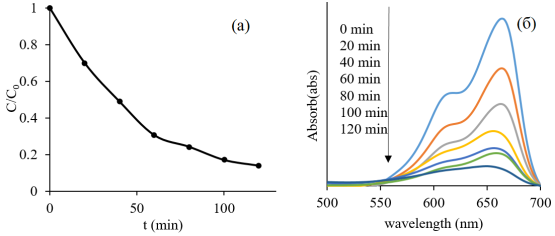
Рис. 1. (а): Зависимость C/C 0 от времени освещения; (б): УФ-видимый спектр раствора МC в присутствии катализатора Zn 0.98 Ag 0.02 O в зависимости от времени освещения
Пик оптической плотности неуклонно уменьшается со временем, примерно через 120 минут освещения характерный пик МC практически исчезает. Интересно, что со временем положение пика немного смещается в сторону более коротких волн. Это говорит о том, что при разложении МC могут образовываться промежуточные соединения с меньшими массами.
Рис. 2. График для определения константы скорости фоторазложения МC катализатора Zn 0.98 Ag 0.02 O
График зависимости ln (C 0 /C) от времени освещения имеет линейный вид (с R 2 = 0,99 (рис. 2)), что полностью соответствует модели Ленгмюра-Хиншелвуда. Это показывает, что МC фоторазлагается. Реакция разложения подчиняется кинетическим законам реакции первого порядка. По результатам линейной регрессии получены уравнения: y = 0,0169x + 0,0477 (R 2 = 0,9904). Из наклона рассчитывается константа скорости разложения МC k = 0,0169 мин -1 .
2. Факторы, влияющие на фотокаталитическую способность разложения MC материала Zn 0.98 Ag 0.02 O
2.1. Влияние содержания Zn 0.98 Ag 0.02 O
Чтобы оценить влияние содержания Zn 0.98 Ag 0.02 O на разложение МC, эксперименты проводили при следующих условиях: начальная концентрация МС 10 ppm; pH = 8; содержание Zn 0.98 Ag 0.02 O варьируется от 0,5 до 1,5 г/л. Зависимость константы скорости разложения МC от содержания катализатора показана на рис. 3.
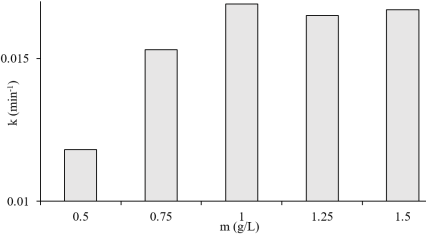
Рис. 3. Зависимость константы скорости разложения МC от содержания Zn 0.98 Ag 0.02 O
Результаты показали, что при увеличении содержания Zn 0.98 Ag 0.02 O с 0,5 г/л до 1,5 г/л константа скорости разложения МC резко увеличивалась, а затем несколько снижалась. Максимальная константа скорости достигается при содержании Zn 0.98 Ag 0.02 O 1,0 г/л. Это может быть связано с увеличением количества каталитических центров для фоторазложения с увеличением содержания Zn 0.98 Ag 0.02 O.
Однако, когда количество катализатора слишком велико, взаимодействие частиц увеличивается, делая значительную часть Zn 0.98 Ag 0.02 O недоступной для МC или излучения. В результате скорость разложения постепенно снижается.
Поэтому в следующих экспериментах содержание Zn 0.98 Ag 0.02 O было выбрано равным 1.0 г/л.
2.2. Влияние начальной концентрации МC
Начальная концентрация МC также влияет на скорость фоторазложения МC (рис. 4). Экспериментальные результаты показывают, что при увеличении концентрации МC с 5 до 15 ppm константа скорости разложения МC постепенно уменьшается.
Это можно объяснить тем, что чем выше концентрация МC, тем больше молекул МC адсорбируется на поверхности материала, слой МC может мешать процессу поглощения света материалом, поэтому скорость реакции невысока.
Однако количество разложенного МC увеличивалось с увеличением концентрации МC. Действительно, рассчитали среднюю скорость разложения МС по формуле:
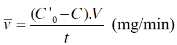
где C' 0 и C — начальная концентрация и концентрация МC (ppm), остающаяся после времени освещения t (t = 120 мин); V — объем раствора МC (V = 0,1 л).
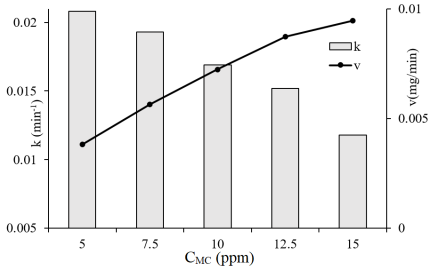
Рис. 4. Влияние начальной концентрации МC на константу скорости и среднюю скорость фоторазложения МC
На рис. 4 показано, что с увеличением начальной концентрации МС значение средней скорости фоторазложения постепенно увеличивается. Поэтому значение начальной концентрации МC было выбрано 10 ppm.
2.3. Влияние pH
Результаты исследования влияния pH на каталитическую эффективность Zn 0.98 Ag 0.02 O для фоторазложения МC показаны на рис. 5.
При увеличении pH раствора с 3 до 8 скорость фоторазложения МC увеличивалась в 9,5 раза. Однако при изменении pH от 8 до 10 скорость несколько снизилась.
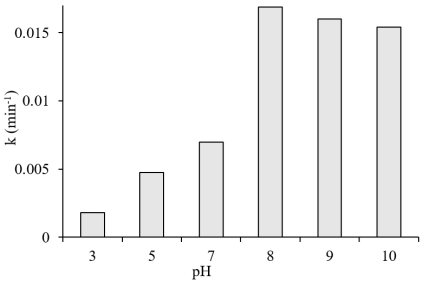
Рис. 5. Влияние pH на скорость фоторазложения МC
Как известно, МC имеет pKa = 3,8, при pH <3,8 МC существует в основном в незаряженной форме, а при pH> 3,8 МC существует в форме катиона МC
+
. В то время как изоэлектрическая точка Zn
0.98
Ag
0.02
O составляет pH = 7,4. В среде 3,8
Когда pH> 7,4, материал будет иметь отрицательный заряд, который притягивает МC + , поэтому скорость реакции увеличивается.
Однако, когда pH слишком велик, количество МC, адсорбированного на поверхности, слишком велико, что препятствует процессу поглощения света материалом, поэтому скорость реакции снижается.
Заключение
Реакция фоторазложения МC в видимом свете с использованием катализатора Zn 0.98 Ag 0.02 O, синтезированного методом сжигания геля, подчиняется кинетическому закону реакции первого порядка, полностью совместимому с моделью Ленгмюра-Хиншелвуда.
Исследованные факторы, такие как содержание катализатора; начальная концентрация МC и pH среды, и было обнаружено, что они сильно влияют на каталитическую способность материала.
При условиях: каталитическое содержание Zn 0.98 Ag 0.02 O 1,0 г/л, начальная концентрация МC 10 ppm, pH = 8 и освещение компактной лампой 40 Вт в течение 120 минут, константа скорости разложения МС достигала 0,0169 мин -1 .
Литература:
- Chen, C., J.Liu, P.Liu and B.Yu. Investigation of Photocatalytic Degradation of Methyl Orange by Using Nano-Sized ZnO Catalysts. // Adv. Chem. Engi. Sci. — 2011. Vol. 1. — P. 9–14.
- Динь В. Т., Ву Т. З. Синтез фотокаталитических наноматериалов Zn 1- x Ag x O методом сжигания геля. // Молодой ученый. — 2021. -№ 10. — С. 11–14.
- Dominik Heger, Jaromír Jirkovský. Aggregation of Methylene Blue in Frozen Aqueous Solutions Studied by Absorption Spectroscopy. // The Journal of Physical Chemistry A. — 2005. Vol. 109. — P. 6702–6709.







