В работе проведён синтез комплексных соединений Cu(II), Ni(II), Cd(II), Co(II), Fe(III) с оксимом ацетона в качестве лиганда с целью установления его возможной дентатности. Для ряда веществ сняты спектры поглощения в видимой области, проведён рентгеноструктурный анализ и получены микрофотографии кристаллов. Установлено, что оксим ацетона в данных соединениях является преимущественно монодентатным лигандом с невысокими константами связывания.
Оксимы представляют собой таутомеры нитрозосоединений и являются производными карбонильных соединений. В результате их молекулы имеют группировку =N-OH, в которой есть два атома (азот и кислород) с неподелёнными электронными парами. Это приводит к тому, что оксимы способны координироваться через данные атомы к переходным металлам, образуя как моноядерные, так и полиядерные комплексы [1]. Чаще всего можно встретить комплексы, в которых оксим координируется через атом азота, однако известны примеры координации через атом кислорода [2]. Координационная способность оксимов находит своё применение в аналитической химии, например, известный реактив Чугаева (диметилглиоксим), образующий нерастворимое соединение с никелем. Также примером применения данного класса соединений в аналитической химии является разделение катионов с близкими физико-химическими свойствами [3].
Координация оксимов может происходить как через один атом (азот или кислород), так и через два атома, однако комплексные соединения с таким типом координации встречаются крайне редко ввиду того, что трёхчленные циклы напряжены и имеют более низкую термодинамическую стабильность. Примерами такой координации являются комплексы уранила, имеющие составы [UO 2 (NO 3 )(dmso) 2 (L-l)] и [UO 2 (dmso) 2 (L-l) 2 ] (L-l — оксим ацетофенона) [4].
Поэтому в данной работе будет рассматриваться дентатность оксима ацетона в комплексных соединениях с медью, железом, кадмием, никелем и кобальтом.
Материалы и методы
Синтез исходного соединения проводился по реакции ацетона с гидроксиламином. В двухгорлую колбу помещали стехиометрические количества сульфата гидроксиламиния и карбоната натрия. Смесь растворяли в воде и перемешивали на магнитной мешалке до прекращения выделения газа. После этого смесь ставили на ледяную баню. Далее в делительную воронку помещали расчетное количество ацетона и устанавливали медленное прикапывание к раствору при перемешивании с обратным холодильником. После окончания прикапывания смесь перемешивают ещё некоторое время, после чего давали отстояться. Далее выпавшие кристаллы отфильтровывали, а раствор переносили в отдельную ёмкость и экстрагировали оставшийся оксим с помощью гексана, который в дальнейшем отгоняли на роторном испарителе. Данная методика, модифицированная под возможности лаборатории, в которой выполнялась работа, взята из [5]. Наблюдаемый выход по этой методике составлял около 60 %.
(NH 3 OH) 2 SO 4 + Na 2 CO 3 = Na 2 SO 4 + 2NH 2 OH + H 2 O + СO 2
(CH 3 ) 2 CO + NH 2 OH = (CH 3 ) 2 C=NOH + H 2 O
Синтез комплексов осуществлялся по следующей методике. В термостойкий стакан помещали стехиометрические количества соли металла и оксима ацетона, смесь растворяли в небольшом количестве воды и медленно упаривали до момента, когда остаётся ⅕ от объёма раствора или когда появляется плёнка кристаллов (или муть). Когда такое наблюдали, то растворы снимали с плиты и охлаждали в бане со снегом. Выпадавшие кристаллы фильтровали и сушили между слоями фильтровальной бумаги.
Для установления дентатности необходимо было синтезировать каждый комплекс по два раза: с предположением, что лиганд монодентатен и бидентатен соответственно. Полная информация о проведённых синтезах представлена в таблице ниже.
|
Металл |
Исходное соединение |
Соотношения металла и оксим а |
|
Cu(II) |
Cu(NO 3 ) 2 |
1:2 и 1:4 |
|
CuCl 2 |
1:2 и 1:4 |
|
|
Ni(II) |
Ni(NO 3 ) 2 |
1:2 и 1:4 |
|
Co(II) |
Co(NO 3 ) 2 |
1:2 и 1:4 |
|
Cd(II) |
CdCl 2 |
1:3 и 1:6 |
|
Fe(III) |
FeCl 3 |
1:3 и 1:6 |
Методами характеризации полученных соединений были спектрофотометрия в видимой области, рентгеновская дифракция и оптическая микроскопия.
Изучение комплексов
Спектрофотометрия проводилась для наблюдения различий в поглощениях растворами исходной соли и комплекса, а также для оценки порядка константы связывания. Для этого проводились наложение спектров, снятых на одинаковых концентрациях (рисунок 1б), и снятие спектров раствора комплекса относительно раствора исходной соли (рисунок 1а). Здесь и далее Охас — оксим ацетона.
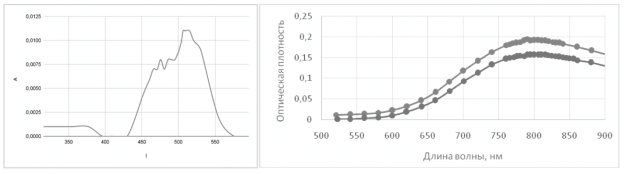
Рис. 1. Спектры поглощения комплексов а)Co(NO 3 ) 2 +2Oxac б)Cu(NO 3 ) 2 +4Oxac
Микрофотографии делались для первичной оценки полноты протекания реакции комплексообразования: если видны кристаллы преимущественно одного типа, то комплексообразование прошло. На рисунке 2 представлены микрофотографии кристаллов различных комплексов.
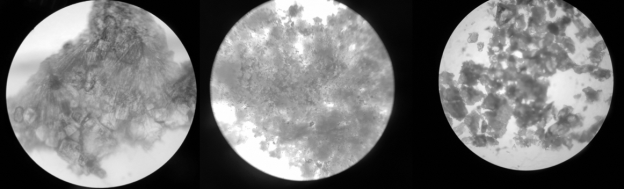
Рис. 2. Микрофотография кристаллов комплекса а) CuCl 2 +4Oxac; б) Cu(NO 3 ) 2 +4Oxac Ni(NO 3 ) 2 +4Oxac
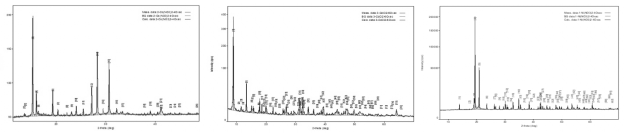
Рис. 3. Дифрактограммы полученных комплексов
Методом рентгеновской дифракции производилось определение фаз в кристаллах комплексов. На рисунке 3 представлены дифрактограммы трёх синтезированных соединений.
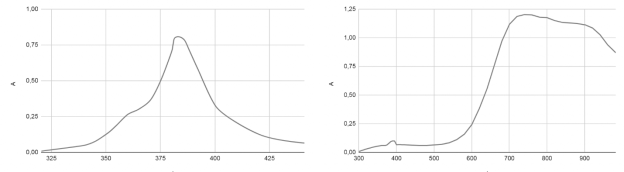
Рис. 4. Спектры поглощения растворов а) хлорида железа (III) и б) комплекса Cu(NO 3 ) 2 +2Oxac
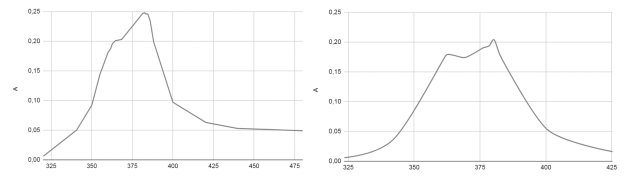
Рис. 5. Спектры поглощения растворов а) комплекса FeCl 3 +6Охас б) FeCl 3 +3Охас
Обсуждение результатов
На микрофотографиях можно заметить, что в случае хлорида меди структура более неоднородная, чем в случае нитратов. Это может говорить о том, что хлорид-анион — лиганд более сильного поля, чем оксим ацетона, и получать его комплекс с медью из растворов хлорида значительно труднее, чем из нитрата.
В случае никеля видна большая однородность кристаллов, что может свидетельствовать о высокой устойчивости комплекса.
С помощью видимых спектров можно очень грубо оценить порядок константы связывания. Для этого, пренебрегая изменением коэффициента экстинкции при переходе от аквакомплекса к комплексу с оксимом и остаточной концентрацией лиганда, можно использовать выражение,
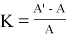
На дифрактограмме комплекса CdCl 2 +6Oxac видно, что помимо фазы хлорида кадмия в кристалле имеется также некоторая основная фаза, которая пока трудно поддаётся трактовке ввиду отсутствия в базах. Вероятно, это и есть искомый комплекс.
В случае комплекса Co(NO 3 ) 2 +6Oxaс основной фазой является шестиводный кобальт, присутствуют также следы СоО(ОН). Значит, связывания не было, и для кобальта комплекс с оксимом ацетона неустойчив (или его нужно получать методами, отличными от использованного в работе).
Для кристаллов комплекса Ni(NO 3 ) 2 +6Oxac было обнаружено, что они содержат шестиводный никель и гидроксид никеля, но не как основную фазу. Основной фазой (как и в случае кадмия, пока не поддающейся трактовке) может (не обязательно) являться комплексный катион с оксимом ацетона.
Для комплексов с железом было обнаружено, что их характеризация методом видимой спектрофотометрии затруднительна, так как катион железа (+3) сильно гидролизован и имеет более тёмную окраску, чем комплекс, в связи с чем выражение для приближённой оценки порядка константы связывания для него не работает (рисунки 10–12).
Выводы
В работе показано, что в получившихся соединениях оксим ацетона (там, где это удалось определить) монодентатен. Нельзя исключать, что в образцах могут быть обнаружены частицы, содержащие бидентатный лиганд. Это видно из анализа видимых спектров.
Также установлено, что комплекс ацетонооксима с медью не может быть получен из хлорида меди. Обнаружено, что полученный описанными методами препарат, содержащий комплекс ацетонооксима с никелем, не имеет достаточную чистоту, а в случае кобальта комплекс и вовсе нельзя получить по описанной методике.
Показана возможность грубой оценки константы связывания методом спектрофотометрии, но описанный способ не работает для железа и комплексов с высокой константой связывания.
Авторы выражают благодарность Л. М. Лукину и В. С. Алабушевой за помощь в выполнении работы, ресурсному центру СПбГУ (Rigaku «MiniFlex II») за предоставление возможности получить дифрактограммы.
Литература:
- Несмеянов А. Н. Начала органической химии: учебное пособие: в 2 т. / А. Н. Несмеянов, Н. А. Несмеянов — М.: Изд. «Химия», 1970.– Т. 2.–С. 153–157
- Rundle, R. E. On solubilities and structures of nickel and copper dimethylglyoximes / R. E. Rundle, C. V. Banks // J.Phys.Chera., — 1963., V.67. — N.2. — p.508–509
- Суховерская, А. В. Оксимы 3-фенил-5,5-дизамещенных-4- изоксазолонов и их взаимодействие с солями никеля(II), кобальта(II) и марганца(II): авт. докт. дис. / А. В. Суховерская — Кемерово, 2010.
- Бейрахов А. Г. Координационные соединения уранила с гидроксиламинами и оксимами: дис. докт.хим.наук.-М., 2010. — Режим доступа:http://fizmathim.com/koordinatsionnye-soedineniya-uranila-s-gidroksilaminami-i-oksimami
- Пат.315434 СССР. Способ получения оксимов/Быкова Л. У., Горбунова В. И., Горбунов В. И., Гаврилин Т. Ф.







