Изучено эпоксидирование полициклических мостиковых олефинов, синтезированных на основе С 5 -С 7 циклических непредельных углеводородов и их некоторых производных гидропиритом (аддуктом Н 2 О 2 и СО(NH 2 ) 2 ) в присутствии фосфорномолибденового гетерополисоединения, модифицированного СоСО 3 и HBr. Установлено, что эпоксидирование этих углеводородов без изменения их структуры селективно протекает при 60–75°С, мольном соотношении субстрат: Н 2 О 2 и СH 3 СООН 1:2:0,3, продолжительности опыта 4–5 ч, рН среды 3,0–3,5 в растворе ксилола. При более жестких условиях (Т=80–85°С, τ=6–7 г, рН-1,8–2,0, мольное соотношение субстрат: СH 3 СООН=1:2–3), основными продуктами реакции являются гликолы или их моноацетаты. При гидролизе (ацетолизе) эпоксипроизводных норборнено наблюдается перераспределение гидроксилыних (или ацетоксипроизводных) групп в соответствии с правилом Вагнера-Меервейна.
Ключевые слова: полициклические непредельные углеводороды, эпоксидирование, гидропирит, модифицированный бромидом кобальта фосфорплиоксомолибдат.
К настоящему времени накоплен достаточно широкой материал по эпоксидированию алифатических и алкенилароматических углеводородов. Однако сведения об эпоксидах с макро- и полициклическими фрагментами весьма ограничены. Хотя известно, что соединения этого класса обладают рядом уникальных свойств и могут быть использованы в качестве синтонов для получения душистых веществ и лекарственных препаратов [1, 2], мономеров и стабилизаторов [3], биологически активных соединений [4, 5].
Рост объемов пиролизного производства низкомолекулярных непредельных углеводородов делает актуальной проблему комплексного использования таких продуктов процесса как циклопентадиен и его метилпроизводные. Особенности продуктов димеризации и тримеризации этих углеводородов обусловленные их полициклической структурой и наличием двойных связей, позволяют осуществлять синтез их функциональных производных с различными полезными свойствами.
В настоящей работы приведены результаты по эпоксидированию С 10 -С 12 три- и тетрациклических непредельных углеводородов и их некоторых производных гидропиритом (аддуктом пероксида водорода и карбамида) с участием кобальтомолибденового гетерополисоединения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные непредельные углеводороды С 10 -С 12 мостиковой структуры синтезированы по реакции [4+2]-циклоприсоединения циклопентадиена, циклогекса-1,3-диена, норборнена, винилциклогексана и стирола с участием HNa-клиноптилолита (SiO 2 /Al 2 O 3 =5,4) или HNa-морденита (SiO 2 /Al 2 O 3 =10) при температура 180–200°С и продолжительности 2–3 ч.
В качестве эпоксидирующего агента использовали клатратный комплекс пероксида водорода и карбамида (гидропирит, количество активного кислорода 30–50 %).
Катализатором эпоксидирования являлась фосфорполиоксомолибденовая кислота, модифицированная CoBr 2 и HBr, приготовленная по методу [6].
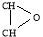
Реакцию окисления проводили в стеклянном термостатированном реакторе стационарного типа, снабженном капельной воронкой, термометром, магнитной или механической мешалкой, пробоотборником и обратным холодильником. В реактор помещали 0,05 моль полициклического непредельного соединения, 0,03 моль уксусную или муравьиную кислоту, 20–50 мг катализатора 20 мл толуола (или ксилола) в качестве растворителя и 0,05–0,1 моль гидропирита. Реакцию проворили при 40–70 °С и атмосферном давлении в течение 4–7 часов. По ходу реакции через определенные промежутки времени отбирали пробы реакционной смеси для анализа. Содержание активного кислорода определяли перманганатометрическим методом [7]. Состав и структура исходных соединений и продуктов реакции определяли ГЖХ, ИК- и масс-спектроскопическими методами и определением числа эпоксидных групп. Значение эпоксидного числа для синтезированных оксиранов составляет 8,2–8,5. В спектрах ЯМР 1 Н данных соединений имеется двойной дублет протонов оксиранового фрагмента (2,87 м.д.).
Окончание реакции определяли методом ГЖХ и определением эпоксидного числа в органической фазе. Реакционную смесь обрабатывали насыщенным раствором NaHCO 3 , органический слой отделяли, водный слой экстрагировали MgSO 4, растворитель отгоняли атмосферной разгонкой, остаток разделяли под вакуумом.
Эндо-3-окса-экзо-6-фенилтрицикло [3.2.1.0
2.4
] октан-Т
пл
-63–65 °С. ИК-спектр, ν, см
-1
: 3040 (ν
s
, CH оксирана), 2890 (СН, ν), 2855 (СН
2
, ν
s
), 1660 (С
6
Н
5
, ν), 1430 (СН
2
, δ
а
s
), 1265 (

Эндо-3-окса-экзо-6-циклогексилтрицикло [3.2.1.0
2.4
] октан-Т
кип
-94–95 °С (0,2 кПа), d
20
4
1.0683, d
20
4
1.4926. ИК-спектр, ν, см
-1
: 3050 (HC-оксирана, ν
s
), 2890 (СН, ν), 2850 (СН
2
, ν
s
), 1440 (СН
2
, δ
а
s
), 1345 (CH, δ), 1260 (


Эндо-4-окса-экзо-экзотетрацикло [6.2.1.0
3.5
. 0
2.7
] ундекан-Т
кип
-44–45 °С (0,24 кПа), d
20
4
1.0235, n
20
4
1.4876. ИК-спектр, ν, см
-1
: 3040 (HC-оксирана, ν
s
оксирана), 2890 (СН, ν), 2860 (СН
2
, ν
s
), 1458 (СН
2
, δ
а
s
), 1340 (CH, δ), 1260 (


Эндо-4-окса-экзо-тетрацикло [6.2.1. 0
3.5
. 0
2.7
] додекан-Т
кип
-75–77 °С (0,66 кПа), d
20
4
1.0426, n
20
4
1.4906. ИК-спектр, ν, см
-1
: 3035 (СН, ν
s
оксирана), 2892 (СН, ν), 2855 (СН
2
, ν
s
), 1450 (СН
2
, δ
а
s
), 1350 (СН, δ), 1245 (


5-оксапентацикло [7.2.1. 1
3.7
. 0
2.8
.0
4.6
] тридекан-Т
кип
-70–73 °С (0,27 кПа), Т
пл
-62–64 °С. ИК-спектр, ν, см
-1
: 3030 (CH, ν
s
оксирана), 2890 (СН, ν), 2855 (СН
2
, ν
s
), 1460 (СН
2
, δ
а
s
), 1340 (CH, δ), 1265 (


РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На селективность реакции и выход продуктов окисления влияют температура, продолжительность, природа растворителя и значение рН-среды. С повышением температуры от 40 до 70 °С и продолжительности реакции от 3.0 до 6.5 ч конверсия исходного углеводорода и выход эпоксида увеличивается. Наиболее высокие выходы (76.0–88.0 %) эпоксидов достигается при 70–80 °С и продолжительности 6.5 ч. (рис. 1.) При более жестких условиях выход эпоксидов уменьшается. В оксидате накапливается значительное количество гликолей (или их моноацетаты) и продуктов окислительной олигомеризации.
![Динамика накопления продуктов окисления ТЦДЕ 35 % -ным раствором H2O2 (а) и гидропиритом (б) при разных температурах. 1,2,3,4-оксатетрацикло [6.2.1.03.5.02.7] ундекан, 1´,2´,3´,4´-трицикло [5.2.1.02.6] декандиол](https://moluch.ru/blmcbn/84271/84271.002.png)
Рис. 1. Динамика накопления продуктов окисления ТЦДЕ 35 % -ным раствором H 2 O 2 (а) и гидропиритом (б) при разных температурах. 1,2,3,4-оксатетрацикло [6.2.1.0 3.5 .0 2.7 ] ундекан, 1´,2´,3´,4´-трицикло [5.2.1.0 2.6 ] декандиол
Выход последних увеличивается при использовании в качестве окислителя 35–41 %-ного водного раствора Н 2 О 2 . При этом используемый растворитель существенно влияет на сольватацию «in-situ» образующегося пероксокомплекса и направлению реакции. Наиболее высокая селективность по эпоксиду достигается при использовании толуола или ксилола. Наоборот в случае использования апротоных полярных растворителей (СН 3 СN, ДМФА) селективность реакции по эпоксиду снижается.
При окислении водным раствором Н 2 О 2 реакция протекает либо в органической фазе, либо на поверхности раздела фаз. При этом перенос активного кислородного атома на кратную связь полициклических мостиковых углеводородов происходит не за счет кислорода пероксида водорода, а через стадии образования «in-situ» пероксакомплекса в водной фазе. После передачи электрофильного кислорода субстрату восстановленный комплекс с пероксидом водорода в водной фазе регенерирует свою активность. Постоянство содержания активного органической фазе достигается варьированием интенсивности перемешивания реакционной смеси. Наиболее высокая конверсия субстратов достигается при интенсивности перемешивания 600–700 об/мин. (рис.2) При использовании Н 2 О 2 ·СО(NH 2 ) 2 в уксусном (или муравьином) растворе скорость вращения мешалки не превышала 150–200 об/мин.
![Зависимость конверсии ТЦДЕ от скорости перемешивания смеси. (T=80 °C, окислитель-35 %-ный водный раствор H2O2, катализатор P0.25Mo3.0CoBr0.25O10/MKM, TTDE: [0]:CH3COOH=1:2:0,2)](https://moluch.ru/blmcbn/84271/84271.003.png)
Рис. 2. Зависимость конверсии ТЦДЕ от скорости перемешивания смеси. (T=80 °C, окислитель-35 %-ный водный раствор H 2 O 2 , катализатор P 0.25 Mo 3.0 CoBr 0.25 O 10 /MKM, TTDE: [0]:CH 3 COOH=1:2:0,2)
Продолжительность реакции, час:1–2.0; 2–3.0; 3–4.0; 4–5.0; 5–6.0; 6–7.0; 7–8.0
ВЫВОДЫ
Разработаны условия каталитического эпоксидирования полициклических непредельных мостиковых углеводородов пероксидом водорода или гидропиритом (аддуктом Н 2 О 2 и карбамида) в присутствии фосфорполиоксомолибдата, модифицированного бромидом кобальта.
Найдены оптимальные условия выхода эпоксидов, при которых выход целевых продуктов достигает 76,0–88,0 %.
Литература:
- Машковский М. Д. Лекарственные средства. В 2-х Т. М.: Медицина, 2002.
- Алимарданов Х. М., сулейманова Э. Т. Химия природных и синтетических душистых веществ. Баку. Элм-2018, 517 с.
- Кашковский В. И., Григорьев А. А.// Катализ и нефтехимия, 2006, Вып.14, с.1
- Пальчиков В. А.// Жорх.2013.Т.49.вып6, стр.807
- Kuehnel M. F., Orchard K. I., Dalle K. E., Reisner E.//J.Arner.Chem.Soc. 2017. 139. Pp.7217–7223
- Гасанов А. И., Алиев В. М., Коробов Н. А., Талыбов Г. М., Гулиева Э. Т., Байрамов Р. К., Алимарданов Х. М. А.с. 1468585 (1988)// Б.и.1989, № 12
- Бабко А. К., Пятницкий И. В. Количественный анализ. М.: Высшая школа, 1962, 508 с.







